紫杉醇所致周围神经病变的机制研究进展*
化疗诱发的周围神经病变 (chemotherapy-induced peripheral neuropathy, CIPN) 是限制抗肿瘤药物使用最常见的不良反应之一,常见的化疗药物有铂类、紫杉烷类、长春新碱类和沙利度安类等,患病率达19%~85%。其中紫杉醇所致周围神经病变(paclitaxel chemotherapy induced peripheral neuropathy, PIPN)通常发生于用药的24~72 h,患病率最高达到87%。在临床上,CIPN是一种感觉神经病变可能伴随着强度和持续时间不同的运动和自主神经变化。例如恶心、头晕、疲劳、嗜睡和失眠,在严重的情况下,这些症状可能会导致感觉知觉丧失,如四肢麻木、无力、灼烧感并伴有刺痛甚至自主神经功能紊乱等,这些症状影响了药物疗效并严重降低了病人的生活质量。最近的研究表明,在化疗后的第1个月时测量CIPN的发生率约为68.1%,3个月时为60.0%,6个月后为30.0%。与其他周围神经病变(如痛性糖尿病性多发性神经病变)相比,CIPN病人可能会出现更剧烈的疼痛,同时影响手和足,并伴有热痛或冷痛觉过敏,并且症状的发展也更快。
目前临床上尚无有效预防CIPN的药物,对于PIPN神经性疼痛病人来说,主要以镇痛为主,辅以其他镇静药和非甾体消炎镇痛药。阿片类药物(吗啡)长期使用具有依赖性。苯二氮䓬类药物(地西泮、奥沙西泮)长期使用会产生药物耐药性和依赖性,仅对部分病人有效。其他治疗方法包括降低化疗药物剂量、延长滴注时间、免疫调节剂、针灸等,均可不同程度缓解症状,但疗效不佳。在中医方面,化疗所致周围神经病变被归结为麻木、络病、痹症、血痹等范畴。中医常以益气养血、温阳理气、活血通络、温通解毒等进行治疗。口服汤剂如黄芪桂枝五物汤、当归四逆汤、补阳还五汤等,辅以中医传统针灸疗法。美国临床肿瘤学会 (American Society of Clinical Oncology, ASCO) 在2014年发布临床实践指南中把度洛西汀作为ASCO治疗CIPN的唯一推荐药。但是对度洛西汀的长期毒性实验缺少报道,亦不能区分度洛西汀对不同化疗药物所造成的外周神经病变的症状改善情况差异及机制。因此,对CIPN发生机制的探索迫在眉睫。本文根据PIPN的发病机制,围绕线粒体功能障碍和氧化应激、炎症刺激、离子通道异常和轴突变性等方面对其发病机制进行总结和展望,以期为临床治疗PIPN提供基础理论参考。
有些单位选择树种不当,一旦听说某地某品种不错,就立刻去考察;有的将苗木地选在贫瘠土壤、盐碱或涝洼地上。选择的苗木品种不适合本地自然环境条件。在移栽中,根部受损,未补充充足的营养,最终导致枯萎死亡。
一、PIPN发生机制
PIPN的确切机制尚不清楚。一种理论认为紫杉醇导致微管蛋白结构的破坏,导致蛋白质和其他成分在神经内的运输受损以及背部中L段背根神经节(dorsal root ganglion, DRG)发生病变死亡。国内外大量研究证明了紫杉醇治疗引起的周围神经病变的作用靶标是DRG,包括感觉神经元胞体和神经轴突。由于血脑屏障的存在,化疗药物很少进入中枢神经系统,主要在周围神经系统的DRG积累,引起机体的免疫和炎症反应。人体中最长的轴突是手和足的神经元,它们高度依赖营养物质的运输,因此手和足在PIPN初期最常受到影响。另一种理论认为是初级传入神经元中的线粒体的毒性作用,导致轴突能量供应的缺乏,从而导致感觉神经病。
1. 线粒体功能障碍和氧化应激
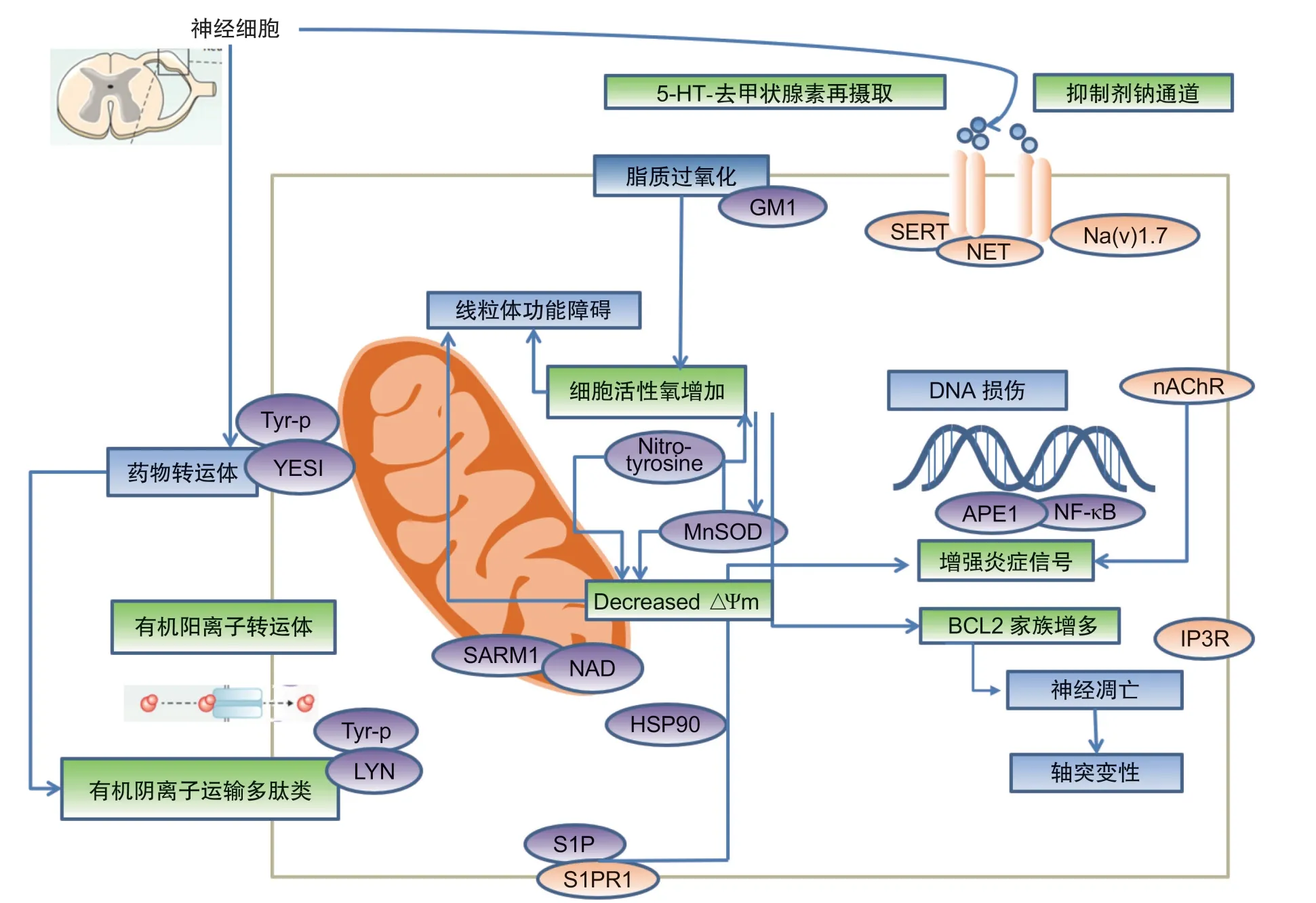
线粒体功能障碍和氧化应激已被证实为化疗药物诱导的神经疼痛的病理生理学的关键参与者。线粒体是一种双膜结合的细胞器,能够参与很多细胞过程。正常活性的线粒体可以维持神经元的基本功能与代谢,线粒体功能异常在CIPN发生发展中发挥举足轻重的作用。紫杉醇作为抗微管装配的抑制剂,已被证实可导致感觉神经元线粒体功能损害,具体表现为减弱线粒体呼吸功能、减少三磷酸腺苷(adenosine triphosphate, ATP)产量等,导致线粒体空泡、肿胀和功能受到损害。紫杉醇并不直接影响线粒体DNA,而是诱导线粒体通透性转变孔 (mitochondrial permeability transition pore, mPTP) 的打开,引起线粒体膜去极化和Ca释放,促进感觉神经元和脊髓中活性氧(reactive oxygen species, ROS)的增加。体外研究表明,紫杉醇(paclitaxel, PTX)治疗可使神经元和非神经元细胞线粒体去极化并释放Ca,在感觉神经元和脊髓中检测到ROS水平的增加。ROS水平的升高引起凋亡过程的激活,细胞结构的破坏和脱髓鞘。在动物模型中,药物作用后7天观察到紫杉醇诱导的神经病变导致C纤维和髓鞘轴突中的非典型线粒体。PTX直接作用于从人类癌细胞中分离出来的线粒体,释放细胞色素C,在细胞凋亡过程中激活caspase。细胞色素C的释放被环孢素A阻断,环孢素A是mPTP的抑制剂,可阻止线粒体通透性转变孔的开放,提示线粒体可能激活mPTP,导致外周神经轴突内线粒体空泡化、肿胀,功能受损。线粒体生理功能的紊乱,进一步破坏线粒体呼吸链功能,产生更多的自由基,影响细胞新陈代谢,造成ROS的大量生成,导致氧化应激。
(2)电压门控钾离子通道:钾通道在神经元的膜电位与兴奋性中发挥重要作用,其结构或功能状态的改变与PIPN的发生密切相关。Kv7通道和K2P1.1通道在初级感觉神经元中广泛表达,以调节其兴奋性。研究表明,瑞替加滨(Kv7通道激活剂)与紫杉醇联合使用降低了神经元兴奋性,既可以减少脊髓星形胶质细胞的活化,也可以减少IENF的变性,减轻动物的机械性超敏性,缓解神经病理性疼痛的发展。K2P1.1通道在DRG神经元中高度表达。紫杉醇注射后,DRG中K2P1.1 mRNA和蛋白随时间依赖性降低,这种减少归因于紫杉醇诱导的DRG中重新甲基转移酶DNMT3a的上调。降低DRG 中K2P1.1下调,减轻了紫杉醇诱发的机械和热痛超敏反应的发展和维持。K2P1.1可能是预防PIPN发生的潜在靶标。
CIPN机制之一是神经元线粒体损伤,可促进体感神经元的退化。化疗产生的氧化应激是线粒体损伤的主要诱因,从而激活炎症和凋亡信号通路,而活性氧的中和是CIPN的潜在预防策略。急性轴突变性是多种化疗药物引起CIPN的另一个主要途径,激活的SARM-1诱导必需代谢辅因子烟酰胺腺嘌呤二核苷酸的快速破坏,从而导致轴突变性。SARM-1的确切位置,一些证据表明它可能定位于神经元线粒体,并可能与其他线粒体蛋白结合诱导凋亡(见图1)。
2. 炎症刺激—细胞因子和趋化因子
细胞因子介导的神经炎症不仅在神经损伤后神经病理性疼痛发病机理中起关键作用,而且在CIPN 中也起着关键作用。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)主要在小伤害感受神经元中表达。CCR2是MCP-1的同源受体,主要在大中型有髓鞘神经元中表达。直接应用MCP-1可以在大、中型DRG中持续诱导细胞内钙的增加。抗MCP-1抗体或CCR2反义寡聚脱氧核苷酸对MCP-1/CCR2信号的局部阻断可显著减弱紫杉醇所致外周神经病变,包括机械性超敏反应和表皮内神经纤维(intraepidermal nerve fibers, IENF)丢失。MCP-1/CCL2是有效的趋化因子,可调节单核细胞/巨噬细胞的迁移和浸润,在PIPN 的小鼠模型的脊髓背角中发现巨噬细胞浸润。有研究表明脊髓中鞘氨醇1磷酸酯受体1 (recombinant sphingosine 1 phosphate receptor 1, S1PR1) 减少会通过激活星形胶质细胞中的S1PR1引起神经病理性疼痛。选择性拮抗剂在不同化学类别中对S1PR1的遗传和药理抑制作用减少,并抵消了创伤性神经损伤小鼠模型中的神经病理性疼痛。拮抗剂在持续药物治疗期间保持抑制神经病理性疼痛的能力,并且这些作用与阿片类药物的受体无关。此外,小鼠星形胶质细胞中S1PR1的敲除导致神经损伤后不存在神经病理性疼痛,表明主要是星形胶质细胞来源的S1PR1参与了神经病理性疼痛。
炎性因子TNF-α和IL-1β可直接刺激和致敏A纤维和C纤维,导致A纤维和C纤维自发放电,参与神经损伤后的痛觉过敏。通过促炎性细胞因子和趋化因子使未受损伤的邻近神经纤维(伤害感受器)或感觉神经元致敏可能在癌症病人化疗所致周围神经病变急性疼痛表现的发展中起关键作用。紫杉醇导致促炎性细胞因子(TNF-α和IL-1β)的增加和抗炎细胞因子(IL-4和IL-10)的减少。这个过程导致免疫细胞的积聚和激活,并导致神经炎症的发展。Xiao等表明IL-10可减轻紫杉醇诱导的CIPN,紫杉醇还可导致小胶质细胞和星形胶质细胞活化,并增加DRG中的巨噬细胞数量以及炎性细胞因子。巨噬细胞浸润导致细胞因子(TNF-α、IL-1β、IL-6和IL-8)炎性趋化因子(CCL-2和CXC家族)、生长因子及炎症介质(缓激肽、前列腺素、5-HT和一氧化氮)的释放。巨噬细胞和小胶质细胞的抑制可防止机械性痛觉过敏和表皮内神经纤维密度的降低。
3. 细胞内信号传导
【剧情回顾】“凌波微步”是逍遥派的独门轻功步法,机缘巧合下被大理世子段誉习得,并多次帮他“逃命”解围。这门绝技以易经六十四卦为基础,按特定顺序踏着卦象方位行进,从头至尾正好行走一个大圈。
试卷覆盖了中职数学的所有知识板块,重视基础知识的全面考查.试题设计立足于中职数学的核心和主干知识,全面考查了函数、数列、三角、不等式的基础知识,直线、圆、圆锥曲线的方程等解析几何的基础和主体内容,空间线面关系、简单几何的体积计算,概率统计等基础知识.试题高度重视教材价值的挖掘与联系,有的题目直接由教材的例题或习题改编而成,有的试题依托教材背景设计.
4.离子通道的激活
临床前研究已经强调了,许多化疗诱导的离子通道表达的变化,可能驱动了其他神经病理性疼痛状态的行为改变。离子通道的结构和功能正常是维持生命过程的基础,离子通道是抗癌药物的毒性靶点。临床上导致周围神经病变发展的神经元和神经胶质功能紊乱(膜兴奋性和神经递质的释放)可能部分是由电压门控型钠离子通道(voltage-gated sodium channels, VGSC) 、电压门控型钾离子通道(voltage-gated potassium channels, KV)、电压门控型钙离子通道(voltage-gated calcium channels, VGCC)和瞬时受体电位通道 (transient receptor potential channels,TRP)改变导致的。
计量资料数据采用SPSS17.0软件进行统计学分析,以平均值±标准差(±s)表示,多组间比较采用One-way ANOVA检验中的Dunnett检验;计数资料采用百分比(%)表示,采用卡方检验,显著性标准为 P<0.05。
(1)电压门控钠离子通道:钠通道表达的变化及其敏感性增加了自发神经元放电,降低了激活阈值。电压门控钠通道,包括Nav1.7和Nav1.8,在与痛觉相关的外周86个感觉神经元中表达,并且在轴突损伤或外周炎症后,可以动态调节周围感觉神经元中某些钠通道的表达和功能特性。Nav1.7是在周围神经系统中明显发现的七个钠通道亚型之一,对河豚毒素敏感 (tetrodotoxin sensitivity, TTX-S),并在大直径和小直径DRG神经元中表达,包括大多数在功能上被确定为伤害感受器的神经元。葛根素是抗河豚毒素(TTX-R) Nav通道的强效阻断剂。研究表明,葛根素对神经病理性疼痛大鼠的DRG神经元的Nav1.8通道具有更强的阻断作用,β1亚基siRNA可以消除对Nav1.8的选择性阻断作用。这些结果表明,葛根素可能优先阻断感觉神经元中Nav1.8的β1亚基,从而有助于其抗紫杉醇诱导的神经病理性疼痛作用。在大鼠模型和慢性紫杉醇诱导的外周神经病变病人中,发现Nav1.7通道在伤害感受性神经元中同样上调。大鼠DRG神经元的全细胞膜片钳记录显示紫杉醇诱导ProTx II(选择性Nav1.7通道阻滞剂)敏感的钠电流增强,ProTx II抑制了PIPN大鼠的DRG神经元的自发动作电位,而鞘内注射ProTx II则显著减弱了PIPN的行为体征。这些研究表明,Nav1.7和Nav1.8可能为紫杉醇引起的神经病理性疼痛提供潜在的新靶标。
(1)无人船采用自动驾驶,借助螺旋桨的推力和两个螺旋桨的速度差来实时调节航速和航向,实现自动按照预先设定的计划的航线进行精准的走线、换线及回归等功能。
线粒体的生理功能受损和分泌的炎性介质可能会影响钙信号通路,并促进神经元和神经胶质细胞的进一步病理功能和结构变化。线粒体和内质网的完整性,作为细胞内Ca的储存,对于Ca稳态至关重要,因为细胞内Ca浓度的变化可能影响膜兴奋性,神经递质的释放以及神经元和神经胶质细胞的基因表达。细胞内Ca浓度的增加可能会导致钙蛋白酶(强蛋白酶)活化,从而导致蛋白水解失控,直接引发轴突变性。化学疗法对蛋白激酶和天胱蛋白酶的激活可能导致细胞内结构的破坏。在紫杉醇神经病变模型中,神经元细胞和非神经元细胞都观察到细胞内钙离子的失调。线粒体和内质网是细胞内钙离子库。紫杉醇也可能刺激内质网释放Ca,这一过程可能由1, 4, 5-三磷酸受体(inositol 1, 4, 5-triphosphate receptor, IP3R)介导,导致大鼠Cav3.2通道表达增加,抑制这些通道可逆转痛觉过敏。
(3)电压门控钙离子通道:电压门控钙通道对于促进神经元和其他可兴奋细胞中动作电位的启动和传播是必需的。线粒体和内质网的完整性,作为细胞内Ca的储存,对于Ca稳态至关重要,因为细胞内Ca浓度的变化可能影响膜兴奋性、神经递质的释放以及神经元和神经胶质细胞的基因表达。细胞内Ca浓度的增加可能会导致钙蛋白酶(强蛋白酶)活化,从而导致蛋白水解失控,直接引发轴突变性。化学疗法对蛋白激酶和天胱蛋白酶的激活可能导致细胞内结构的破坏。在紫杉醇神经病变模型中,神经元细胞和非神经元细胞都观察到细胞内钙离子的失调。线粒体和内质网是细胞内钙离子库。紫杉醇可引起线粒体Ca的释放,该过程可能是通过激活mPTP介导的,从而导致线粒体快速去极化。
(4)瞬时受体电位通道:瞬时受体电位离子通道有7种亚型:TRPC、TRPV、TRPM、TRPA、TRPN、TRPP及TRPML。目前研究显示,与CIPN相关的TRP通道主要是TRPA1、TRPV1和TRPV4。DRG神经元在神经病理性疼痛的病理生物学中具有重要作用。DRG没有血脑屏障,化合物很容易扩散到DRG中。TRPA1、TRPV1和TRPV4通道主要在DRG和三叉神经节神经元中表达。因此,TRPA1、TRPV1和TRPV4与包括DRG在内的感觉神经元的疼痛传递相关。TRPV1是TRP超家族的香草类亚家族的成员。紫杉醇治疗后通过DRG中TRPV1表达的增加诱导热痛觉过敏。此外,在人类和紫杉醇治疗的大鼠DRG神经元中,紫杉醇通过刺激TLR4信号刺激TRPV1激活剂的作用已有报道。TRPV4在紫杉醇所致CIPN小鼠中产生的机械性超敏反应有关。TRPV4也是炎症的传感器。在炎症过程中,p38丝裂原活化蛋白激酶 (p38MAPK) 在神经病理性疼痛的发生和维持中起着重要作用。TRPA1通过激活p38 MAPK参与紫杉醇诱导的小鼠DRG神经元的急性超敏反应。脂多糖(lipopolysaccharide, LPS)是细菌溶解的有毒副产物,并且通过暴露于LPS治疗的小鼠中TRPA1的激活和Toll样受体4 (TLR4) 信号通路的激活来诱导机械性异常性疼痛。TRPV1、TRPA1和TRPV4是氧化应激敏感的Ca渗透通道,过氧化应激(如HO)激活神经元中TRPA1和TRPV4的活性。
5.轴突变性
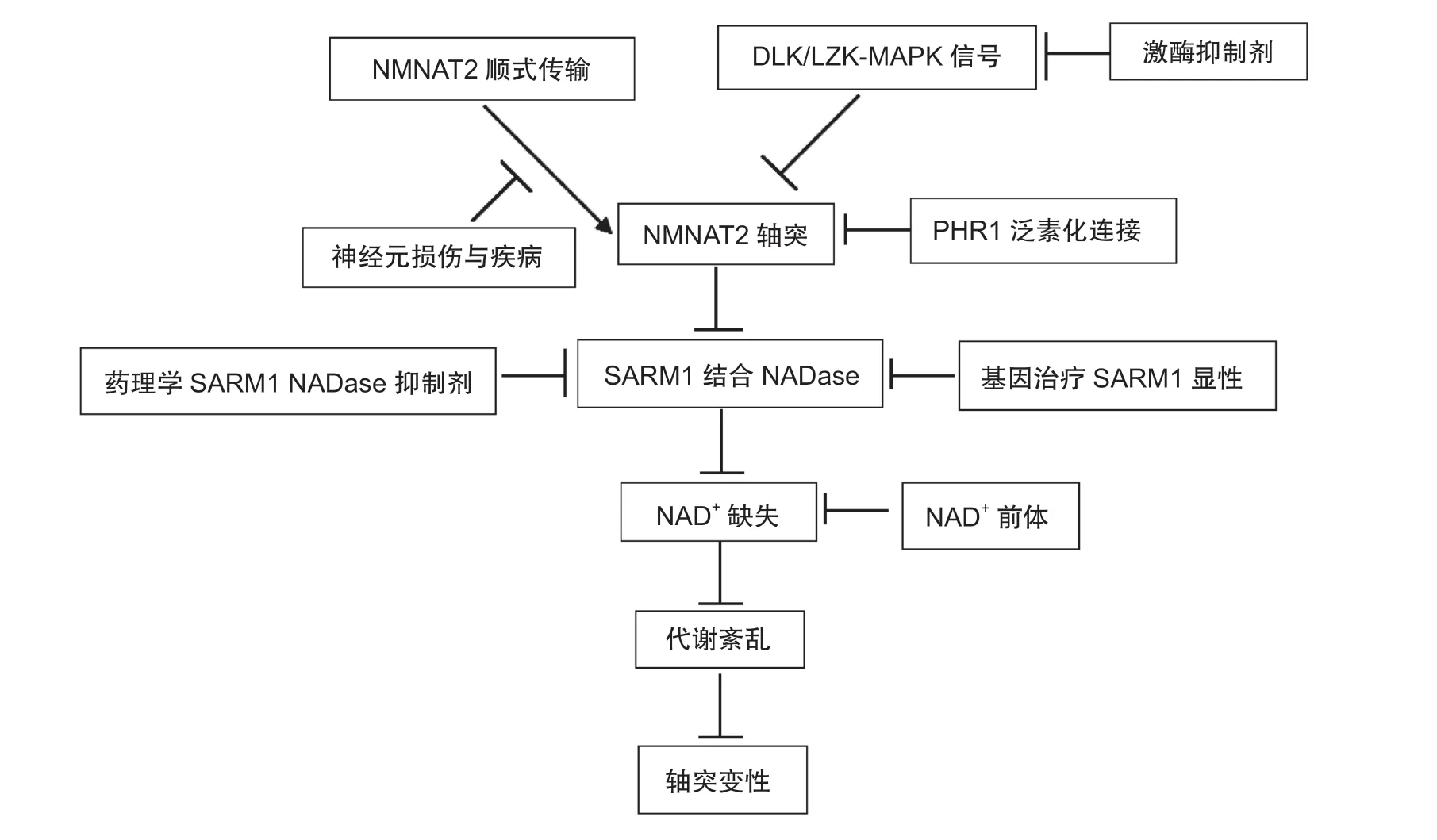
化疗所致周围神经病变的一个主要标志是早期的轴突变性,主要在神经元中表达的无菌α和TIR基序蛋白 (SARM-1) 是神经损伤后以及周围神经病变模型中轴突退化的关键执行者。SARM1激活被认为是通过烟酰胺腺嘌呤二核苷酸 (NAD) 破坏而触发轴突变性,SARM1上游通过限制NMNAT2的水平来促进损伤依赖性的SARM1激活,SARM1诱导NAD破坏而触发轴突变性。在轴突NMNAT2存在的情况下,SARM1的激活被阻断,NMNAT2是一种不稳定的蛋白质,必须通过快速轴突运输从细胞体中不断传递,除了SARM-1途径,还可以通过其他靶向分子保护轴突变性。双亮氨酸拉链激酶 (dual leucine zipper kinase, DLK) 是一种重要的神经元应激激酶,可以激活c-Jun N末端激酶 (c-Jun NH2-ternimal kinase, JNK) 和p38 MAPK,促进小鼠神经损伤后周围轴突的再生,从遗传或药理学角度抑制DLK/LZK可提高轴突NMNAT2的水平,进而抑制SARM1。非典型的SCF E3连接酶复合物Phr1/Fbxo45/Skp1a,最初被认为是突触发育的关键调节因子,也通过加速NMNAT2的周转来促进轴突的退化,抑制这种连接酶可提高NMNAT2及其果蝇直向轴的水平,并导致对果蝇和小鼠损伤轴突的长期保护。在临床前DRG细胞系和啮齿动物模型中,乙氧喹啉通过热休克蛋白90a (Hsp90α) 调节防止紫杉醇诱导的远端轴突变性,而不损害抗肿瘤效果。细胞因子和趋化因子信号也可能在轴突变性中起作用,在啮齿类动物模型中,趋化因子MCP1/CCL-2水平的降低可减少神经退行性变和CIPN行为(见图2)。
二、 总结与展望
CIPN对肿瘤病人的治疗效果和生存质量都造成了不良影响,CIPN的发生及其严重程度往往与化疗药物的种类、药物使用剂量、使用时间等多方面因素有关。因此,本文对PIPN的机制进行整理归纳,分别从线粒体功能障碍和氧化应激、炎症刺激、细胞内信号传导、细胞内信号传导和轴突变性这几个方面进行阐述。随着PIPN的发生机制从分子水平、细胞水平、机体水平等进行研究,在未来将有望为临床治疗提供新的方法和策略,以提高病人的治疗效果和生存质量。
利益冲突声明:作者声明本文无利益冲突。

