CD36的棕榈酰化对动物脂肪沉积的调控作用及其机制
符一鸣 郎立敏 江青艳 王松波
(华南农业大学动物科学学院,广东省动物营养调控重点实验室,优百特脂立方功能性脂肪酸研究中心,广州510642)
畜牧业中,动物脂肪沉积与其产品品质和健康密切相关,而机体脂肪代谢和沉积的首要步骤是脂肪酸的摄取[1]。脂肪酸摄取涉及多种蛋白参与,包括小窝蛋白、脂肪酸转运蛋白[2]、脂肪酸结合蛋白[3]和CD36等。CD36是一种广泛表达的膜蛋白,是促进脂肪酸摄取、转运和脂肪沉积的重要载体[4]。CD36促进脂肪酸的摄取功能受到多种因素的调节,其中CD36的棕榈酰化在调控CD36的脂肪酸摄取功能中发挥着重要作用。因此,本文在介绍棕榈酰化生理功能的基础上,总结了CD36的棕榈酰化对动物脂肪、心脏和肝脏等不同组织器官中脂肪沉积的调控作用及其可能机制,为深入了解棕榈酰化修饰调控动物机体脂肪沉积的作用及其应用提供参考依据。
1 CD36对脂肪沉积的调控作用
CD36在脂肪酸摄取和转运中发挥着重要的作用。CD36属于B类清道夫受体,在各种细胞中广泛表达,包括心肌细胞、脂肪细胞、肝细胞和乳腺上皮细胞等[5]。CD36可促进长链脂肪酸的摄取,并参与细胞中脂质沉积及利用。例如,脂肪组织中敲除CD36,会抑制褐色脂肪组织合成脂质,并使小鼠耐寒性降低[6];肌肉中敲除CD36,会破坏组织的脂肪酸摄取,使血液中甘油三酯的含量增加[7];肠上皮细胞敲除CD36,会导致脂肪酸和胆固醇摄取缺陷[8]。以上结果表明,CD36在脂肪酸摄取和脂肪沉积中发挥重要作用。
CD36促进脂肪酸摄取功能的发挥依赖于其在质膜上的定位,而质膜的定位与棕榈酰化密切相关。CD36的氨基酸序列分析显示,在其N-末端和C-末端含有4个棕榈酰化位点,这些棕榈酰化位点可能调节CD36的质膜定位[9]。这些结果提示,CD36的棕榈酰化修饰可能对脂肪酸摄取和脂肪沉积具有重要调控作用。
2 蛋白质棕榈酰化及其生理功能
2.1 蛋白质棕榈酰化修饰
棕榈酰化是棕榈酸与蛋白质的氨基酸残基相结合的过程。相对于其他翻译后修饰,棕榈酰化是一种普遍的翻译后修饰,也是目前研究较多的一种脂质酰基化反应。
根据棕榈酸结合的氨基酸残基不同,可将棕榈酰化划分为O-棕榈酰化、N-棕榈酰化、ε-N-棕榈酰化及S-棕榈酰化(图1)[10]。O-棕榈酰化是棕榈酸酯与蛋白质的丝氨酸或苏氨酸残基相连;N-棕榈酰化通过酰胺键结合于半胱氨酸残基;ε-N-棕榈酰化结合的蛋白质残基为赖氨酸;S-棕榈酰化是棕榈酸酯结合于半胱氨酸残基上的一种可逆的酶促反应,棕榈酰基转移酶DHHC(Asp-His-His-Cys)催化该过程的发生。而酰基蛋白硫脂酶(acylprotein thioesterase,APT)参与去棕榈酰化的过程,水解半胱氨酸残基与脂肪酸结合的硫酯键[11]。由于S-棕榈酰化的可逆性,使其相对于其他蛋白质翻译后修饰较为独特,并在细胞蛋白质的动态调节中发挥重要作用[12]。
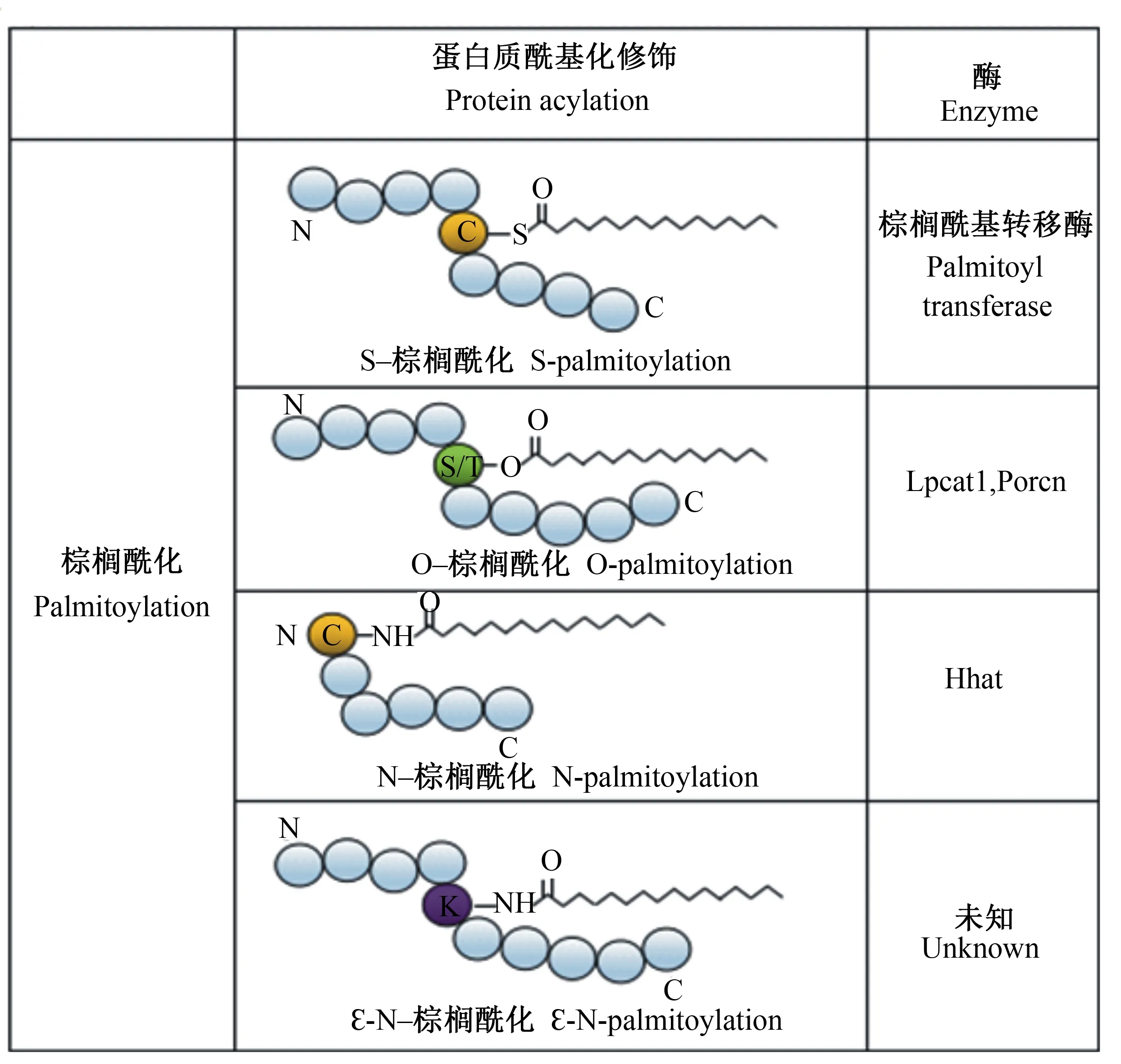
Lpcat1:溶血卵磷脂酰基转移酶1 lysophosphatidylcholine acyltransferase 1;Porcn:豪猪酰基转移酶 porcupine;Hhat:刺猬酰基转移酶 hedgehog acyltransferase。
2.2 蛋白质S-棕榈酰化的生理功能
蛋白质的S-棕榈酰化可以参与调节亚细胞定位、蛋白质转运和维持蛋白质的稳定性等。目前,已有研究表明某些蛋白质向质膜转运时需要发生蛋白质的S-棕榈酰化,而无法进行S-棕榈酰化的蛋白质则会滞留在蛋白质合成途径的早期细胞器中,从而无法靶向质膜[13]。同时,研究发现蛋白质的S-棕榈酰化不仅可以调节蛋白质向质膜转运,同时还可以介导蛋白质在不同细胞器之间的转运[14]。此外,棕榈酰化还能维持蛋白质的稳定性,防止蛋白质发生降解。
2.3 CD36棕榈酰化的营养调控
Tao等[9]研究发现,CD36能够发生S-棕榈酰化,并存在4个棕榈酰化位点——Cys3、Cys7、Cys464和Cys466。饮食来源的分子通过改变组织中蛋白质的棕榈酰化影响代谢,而胰岛素则作为重要的营养信号调控碳水化合物和脂质代谢。高脂饲粮饲喂小鼠,小鼠的体重显著增加,血糖水平显著上升,机体内胰岛素敏感性降低,导致动物体内糖脂代谢紊乱,这些症状和CD36的棕榈酰化水平升高密切相关[15]。反之,通过突变棕榈酰化位点能够抑制CD36的棕榈酰化,提高机体胰岛素的敏感性,从而改善动物的糖脂代谢状况[15]。此外,哺乳动物线粒体中高水平的去棕榈酰化表明了脂质代谢可能与蛋白质棕榈酰化紧密相关,并揭示了这种翻译后修饰在调节线粒体脂质稳态中的作用[16]。在动物疾病模型——非酒精性脂肪肝炎(NASH)小鼠肝脏中CD36的棕榈酰化水平升高,这导致机体脂肪酸摄取和消耗的不平衡[17]。相反,抑制棕榈酰化会限制细胞质中CD36的分布,从而减少对脂质的摄取,恢复机体的脂质稳态[17]。总而言之,CD36发生S-棕榈酰化这一过程对维持机体糖脂代谢稳态具有重要调控作用。
3 CD36的棕榈酰化对脂肪沉积的调控作用
S-棕榈酰化作为翻译后修饰中重要的脂质修饰,能够影响蛋白质的细胞定位。研究报道,CD36在脂肪、心脏和肝脏等不同组织器官的细胞中都发生S-棕榈酰化。CD36的棕榈酰化能影响其质膜的定位和随后的内吞作用,质膜定位和内吞作用又与CD36的脂肪酸摄取密切相关。接下来将阐述CD36的棕榈酰化对上述不同组织脂肪酸摄取和脂肪沉积的调控作用。
3.1 脂肪细胞中CD36的棕榈酰化对脂肪沉积的调控
在脂肪细胞的研究中,CD36是主要的棕榈酰化靶点[18],CD36的棕榈酰化可介导脂肪酸摄取、转运以及脂肪沉积。研究表明,饲喂不同能量水平的饲粮能调控小鼠体内脂肪沉积并影响CD36的棕榈酰化[19]。相比于普通饲粮,饲喂高脂饲粮能增加小鼠体重,并伴随有脂肪组织CD36棕榈酰化水平的升高。同样,棕榈酸能使CD36的棕榈酰化增加,促使脂筏中CD36的融入和脂滴的形成。但是,棕榈酰化位点突变或棕榈酰化抑制剂2-溴棕榈酸酯(2BP)会破坏这种效应。慢病毒转染棕榈酰化位点突变会使CD36的棕榈酰化修饰程度降低,从而导致CD36融入脂筏的效率降低。棕榈酰化抑制剂2BP也可阻断CD36的棕榈酰化,抑制脂滴的形成[19]。
最新研究表明,棕榈酰基转移酶DHHC4在脂肪细胞的高尔基体中棕榈酰化CD36,而DHHC5在脂肪细胞的质膜上维持CD36的棕榈酰化,这2种酶能够促进CD36脂肪酸摄取活性。脂肪细胞内过表达DHHC4和DHHC5可促进CD36的棕榈酰化和脂肪酸的摄取。相反,敲除DHHC4和DHHC5,会破坏CD36的棕榈酰化和其所介导的脂肪酸摄取[20]。
有报道显示,CD36的棕榈酰化和去棕榈酰化循环能调控脂肪沉积[21]。DHHC5的活性在该循环中发挥重要作用,Try91位点磷酸化能使DHHC5失活,从而阻断CD36的棕榈酰化及随后的内吞作用,破坏质膜上脂肪酸与CD36的结合;相反,Try91位点突变能恢复DHHC5的活性,促进CD36在质膜上发生棕榈酰化,以及脂肪酸的摄取和脂肪沉积[22]。下游激酶酪氨酸激酶(tyrosine kinase,LYN)和非受体型酪氨酸激酶(non-receptor tyrosine kinase,SYK)的抑制剂处理细胞,均可促使CD36发生去棕榈酰化,从而阻断CD36的内吞作用和CD36介导的脂肪酸摄取及随后的脂肪沉积[21]。反之,酰基蛋白硫脂酶抑制剂ML348能抑制CD36的去棕榈酰化,从而恢复脂肪酸的摄取和脂肪的沉积[21]。综上所述,在脂肪细胞中,CD36的棕榈酰化对脂肪酸摄取和脂肪沉积具有重要调控作用。
3.2 心肌细胞中CD36的棕榈酰化对脂肪沉积的调控
CD36的棕榈酰化在胰岛素短期调节心肌细胞的脂肪酸摄取中发挥重要作用。CD36的棕榈酰化影响胰岛素所介导的蛋白质细胞膜转运[22]。胰岛素可刺激CD36的棕榈酰化增加,从而使CD36靶向心肌细胞膜,促进长链脂肪酸的摄取[23]。相反,棕榈酰化抑制剂浅蓝霉素(cerulenin)会抑制CD36的棕榈酰化,从而阻断胰岛素的内化,减缓其对脂肪酸摄取的刺激作用。
研究发现,棕榈酰基转移酶DHHC5在心肌细胞中大量存在[24]。DHHC5还作为CD36的棕榈酰基转移酶介导其内吞作用,促进脂肪酸的摄取[21]。药物抑制DHHC5可导致心肌细胞脂肪酸摄取和脂质堆积减少[25]。CD36不仅是长链脂肪酸摄取的主要受体,还是DHHC5棕榈酰化的底物。因此,CD36缺失不仅会破坏脂肪酸的摄取,而且还会抑制棕榈酰化。此外,棕榈酰化可调控CD36在细胞内进行适当分选和转运,因此棕榈酰基转移酶的底物棕榈酰辅酶A也可作为新合成脂质分子的一个重要传感器,破坏这一传感器也会影响CD36对脂肪酸的摄取及其棕榈酰化水平[26]。综上表明,CD36的棕榈酰化在调控心脏内脂肪酸的摄取和脂肪沉积中发挥着重要作用。
3.3 肝细胞中CD36的棕榈酰化对脂肪沉积的调控
肝细胞中CD36的棕榈酰化能增加其对脂质的摄取活性[27]。例如,高脂饲粮会导致小鼠肝脏中CD36的棕榈酰化水平升高,脂滴累积明显增加。此外,棕榈酸也可显著提高肝细胞内CD36的棕榈酰化水平和肝细胞内脂质的累积。但是,棕榈酰化位点突变会显著降低CD36的棕榈酰化水平,从而减少肝脏内脂质累积[19]。
多项研究表明,CD36在脂筏中的正确定位对脂质的转运相当重要[28-29]。棕榈酰化的CD36位于细胞膜脂筏中,并介导脂肪酸的转运和吸附[26]。但是,当CD36的棕榈酰化位点突变,无论在肝组织或细胞中,CD36位于脂筏区的分布明显降低,脂肪酸的转运减少。同时,棕榈酰化抑制剂2BP与棕榈酸共同作用,也会表现出相似的情况[19]。这说明,抑制CD36的棕榈酰化能减少CD36在脂筏区的分布,并影响其所介导的脂肪酸转运。
此外,CD36还可通过调控脂肪酸的β-氧化来影响肝脏脂肪的沉积[30],通过棕榈酸依赖性耗氧率来反映CD36的棕榈酰化对脂肪酸β-氧化的影响。相比于WT-CD36-HepG2细胞,棕榈酰化位点突变的AA-SS-HepG2细胞具有更高的棕榈酸依赖性耗氧量,表明后者的脂肪酸氧化得到了改善[17]。同样,棕榈酰化抑制剂2BP也可使脂肪酸氧化显著增加[17]。因此,肝细胞中抑制CD36的棕榈酰化会促进脂肪酸β-氧化,减少脂肪沉积。总之,CD36的棕榈酰化可通过调控脂肪酸摄取和脂肪酸氧化来调节肝细胞中脂质积累,这可作为肝脏脂质沉积调控的潜在靶点。
4 CD36的棕榈酰化对脂肪沉积的可能机制
CD36的棕榈酰化对脂肪酸摄取和脂肪沉积具有重要调控作用,可能涉及的机制包括CD36的棕榈酰化能够调节其质膜定位、蛋白质稳定性和下游信号通路3个方面。
4.1 调节质膜定位和靶向
CD36的棕榈酰化修饰会调控其向质膜和高尔基体的定位与靶向。研究表明,CD36的2个棕榈酰基转移酶DHHC4和DHHC5参与调控CD36靶向质膜,任意一种棕榈酰基转移酶的失活都会导致CD36无法定位质膜进而抑制脂肪酸的摄取[20]。其可能的调控机制:棕榈酰基转移酶DHHC4在高尔基体中棕榈酰化CD36,使其靶向质膜;而棕榈酰基转移酶DHHC5帮助维持棕榈酰化的CD36在质膜上定位,从而促进膜上的CD36与脂肪酸结合[20](图2)。在脂质诱导胰岛素抵抗方面,药物抑制DHHC4和DHHC5可减少CD36的棕榈酰化及其相关易位,从而减少脂肪酸摄取和脂质的堆积,蛋白质棕榈酰化的机制可能为对抗脂质诱导的心肌病提供新的靶点[25]。
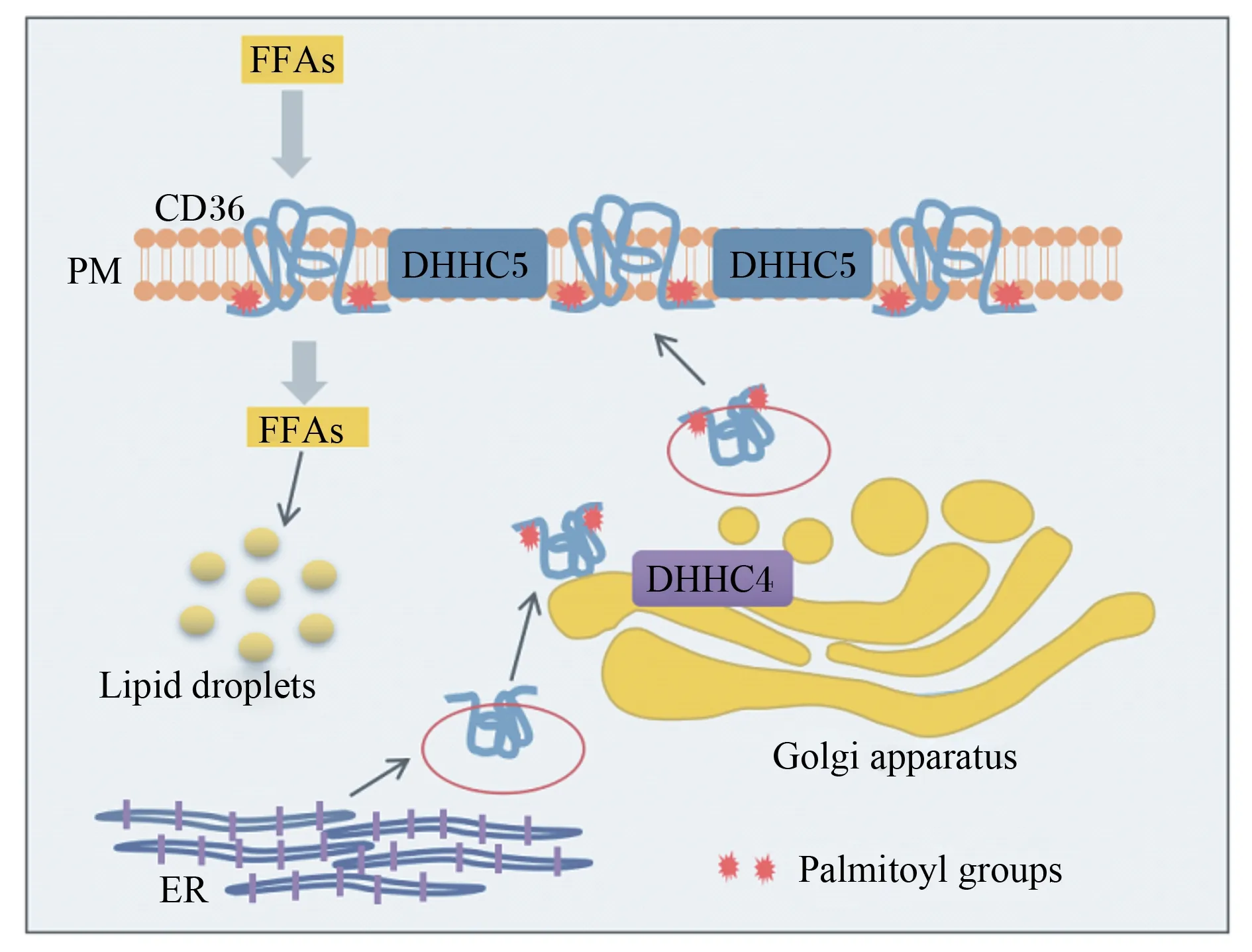
FFAs:游离脂肪酸 free fat acids;PM:质膜 plasma membrane;Lipid droplets:脂滴;ER:内质网 endoplasmic reticulum;Golgi apparatus:高尔基体;Palmitoyl groups:棕榈酰基团。
CD36的棕榈酰化还可以通过提高CD36的疏水性来促进其在质膜上的定位,进而促进细胞对脂肪酸的摄取[28]。研究发现,小鼠肝细胞上CD36的过度棕榈酰化会促进CD36向质膜转运并导致肝细胞过度摄取脂肪酸,从而引发小鼠肝脏脂质沉积增加和非酒精性脂肪肝[31]。
4.2 调节CD36的稳定性
棕榈酰化修饰可以维持CD36的稳定性和细胞对脂肪酸的摄取,棕榈酰化位点的突变会阻断CD36棕榈酰化的发生,从而破坏其稳定性和细胞对脂肪酸的摄取。例如,CD36的棕榈酰化促进其在内质网中加工和成熟,并进一步运输至高尔基体内[29]。CD36的棕榈酰化位点突变时,棕榈酰化受到抑制,其成熟度降低并伴随着稳定性的降低,从而导致进入心脏的脂肪酸减少;此外,胰岛素刺激可提高CD36的棕榈酰化水平,增强其稳定性,导致进入心脏的脂肪酸过度增加[32]。
研究表明,CD36的棕榈酰化还与其他的翻译后修饰之间存在相互作用[33]。棕榈酰化遭破坏时,会增加泛素化和CD36的降解,阻断其所介导的脂肪酸摄取。因此,CD36的棕榈酰化可通过其稳定性的变化来调控脂质沉积。
4.3 调节下游信号通路
CD36的棕榈酰化还通过影响下游信号通路调控脂肪酸摄取和脂肪沉积。脂肪酸与CD36的结合激活下游通道激酶LYN,并进一步磷酸化DHHC5使其失活。反之,CD36的去棕榈酰化会募集其他激酶磷酸化,促使负载脂肪酸的CD36发生内在化,这一系列过程有利于脂肪细胞中脂质的贮存(图3)[21]。
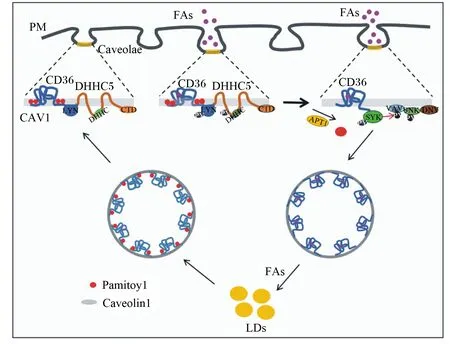
FAs:脂肪酸 fat acids;PM:质膜 plasma membrane;Caveolae:小窝结构;CAV1:小窝蛋白1 caveolin 1;LYN:酪氨酸激酶 tyrosine kinase;APT1:酰基蛋白硫脂酶1 acylprotein thioesterases;PY:磷酸化 phosphorylation;SYK:非受体型酪氨酸激酶 non-receptor tyrosine kinase;LDs:脂滴 lipid droplets。
NASH小鼠模型中,CD36过度棕榈酰化使CD36与酪氨酸激酶——原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase,FYN)和LYN之间的结合能力增强,形成的三元复合物CD36/FYN/LYN会抑制腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的激活,导致肝脏中脂肪酸β-氧化降低,脂质异常堆积。反之,抑制CD36的棕榈酰化能激活AMPK,进而增强脂肪酸氧化,减少肝脏内的脂质堆积[30]。综上所述,CD36的棕榈酰化可通过调节下游信号通路来影响脂质的沉积。
5 小 结
本文在介绍蛋白质棕榈酰化生理功能的基础上,综述了在脂肪、心脏和肝脏等不同细胞中CD36的棕榈酰化对脂肪沉积的调控作用及可能机制,可为深入了解CD36的棕榈酰化修饰调控动物机体脂肪沉积的作用及其在调控动物产品品质和健康中的应用提供参考依据。在饲粮中添加棕榈酸能促使CD36发生棕榈酰化,进而调控脂质沉积有利于提高畜禽胴体品质,达到改善肉质的需求。此外,当前有关棕榈酰化研究的主要挑战是蛋白质棕榈酰化检测技术,目前所研发出的检测方法仍存在一些缺陷,需要进一步改进。当前研究报道,大多偏向于棕榈酰化对炎症和疾病等病理方面的调控,对脂肪沉积与代谢生理相关方面的研究还较少。因此,后续需要研发简单、准确的新型棕榈酰化检测技术,同时有待更加系统和深入地研究蛋白质棕榈酰化对机体脂肪沉积的调控作用及可能机制。

