十一酸睾酮胶丸和枸橼酸氯米芬胶囊联合治疗男性迟发性性腺功能减退症的疗效及其对患者血清性激素的影响
刘志东,缪海婷,李轩
东莞市人民医院检验科1、中医科2,广东 东莞 523000,
男性迟发性性腺功能减退症(late-onset hypogonadism,LOH)是一种伴随年龄增长的生物化学及临床综合征,好发于中老年男性群体,主要表现为血清总睾酮(TT)降低、勃起障碍、性欲减退、关节及骨骼疼痛、出汗、潮热、烦躁、心悸、全身疲乏无力等[1-2]。目前临床关于该病的发病机制尚未明确,其治疗主要以提高TT 水平为主,继而维持机体正常生理需要,以缓解患者多种不适症状。该病既往多应用睾酮替代治疗(TRT),但该方法直接补充的睾酮进入机体会抑制垂体和下丘脑功能,减少促性腺激素和促性腺激素释放激素分泌,长期会导致睾丸萎缩,精子无法生成及成熟,引发男性不育[3]。相关研究显示,在十一酸睾酮基础上应用枸橼酸氯米芬治疗LOH 能有效干扰内源性雌激素对垂体和下丘脑功能的负反馈作用,还能促使促性腺激素和促性腺激素释放激素分泌增多,刺激产生更多雄激素和内源性睾酮结合蛋白,提高精子生长和成熟率[4]。本研究应用十一酸睾酮胶丸联合枸橼酸氯米芬胶囊治疗LOH患者,以探究其临床治疗效果及对患者血清性激素、老年男性症状量表(AMS)评分[7]、国际勃起功能(IIEF-5)[8]评分的影响。
1 资料与方法
1.1 一般资料 选择2020 年5 月至2021 年5 月东莞市人民医院收治的80 例LOH 患者为研究对象。纳入标准:血清总睾酮水平在11.51 nmol/L 以下[5],且应用中年男性雄性激素缺乏测评表(ADAM)[6]筛选,任意3 个问题或问题1、7 回答为“是”者。排除标准:①对研究药物过敏者;②纳入研究前30 d 服用过激素类药物;③合并脑血管疾病、心肌梗死疾病者;④合并泌尿生殖系统感染者;⑤合并排尿异常、前列腺增生、疑似前列腺癌、前列腺癌者。所有患者根据随机数表法分为对照组和观察组,每组40 例。观察组患者年龄30~69岁,平均(45.25±5.75)岁;病程0.5~15 年,平均(2.58±0.15)年。对照组患者年龄32~73 岁,平均(45.69±5.93)岁;病程 0.7~14 年,平均(2.49±0.13)年。两组患者的年龄和病程比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及其家属均知情并签署同意书。
1.2 治疗方法 对照组患者给予十一酸睾酮胶丸(生产厂商:南京欧加农制药有限公司;批准文号:J20100060;规格:40 mg×60粒/瓶)治疗:2次/d,每次2粒,饭后5 min 内服用。观察组患者给予十一酸睾酮胶丸联合枸橼酸氯米芬胶囊(生产厂商:上海衡山药业有限公司;批准文号:H31021107;规格:50 mg×20粒)治疗:十一酸睾酮胶丸服用方法同对照组,枸橼酸氯米芬胶囊1 次/d,1 粒/次,口服。两组患者均连续用药治疗3个月,之后观察组停用枸橼酸氯米芬胶囊,两组十一酸睾酮胶丸用药根据TT 水平及临床疗效及时调整,且在治疗期间嘱咐患者至少保持每周1次性生活。
1.3 观察指标与检测方法 (1)血清性激素水平:两组患者治疗前及治疗3 个月后,于清晨空腹抽取静脉血12 mL,转速3 000 r/min,离心10 min,分离血清待检,应用放射免疫法检测血清卵泡刺激素(FSH)、黄体生成素(LH)、催乳素(PRL)、雌二醇(E2)、孕酮(P)、TT等性激素水平;(2)AMS评分:于两组患者治疗前及治疗3个月后采用AMS量表进行评价。该量表共10项,每项按照0~4 分评分,0 分为无,4 分为极重;无症状:26分及以下,轻度症状:27~37分,中度症状:37~49分,重度症状:50分及以上;(3)勃起功能:于两组患者治疗前及治疗3 个月后,采用IIEF-5 评分进行评价。该量表共五项,均与过去6个月的性生活相关,每项按照0~5 分评分,0 分为无,5 分为很高;轻度勃起功能障碍:12~21 分,中度勃起功能障碍:8~11 分,重度勃起功能障碍:7 分及以下;(4)其他实验室指标:两组患者治疗前及治疗3个月后,于清晨空腹抽取静脉血12 mL,转速3 000 r/min,离心10 min,分离血清待检,应用化学发光法检测分析总前列腺特异性抗原(tPSA)水平,应用比色法检测尿谷草转氨酶(GOT)、谷丙转氨酶(ALT)水平,应用干化学法检测红细胞计数(RBC),应用葡萄糖氧化酶法检测血糖(GLU)水平,应用酶法检测肌酐(Cr)水平;(5)不良反应:记录并比较两组患者治疗过程中的不良反应发生情况。
1.4 统计学方法 应用SPSS19.0 软-件进行数据统计学分析。计量资料以均数±标准差()表示,组间比较采用t检验,计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后的血清性激素水平比较 治疗前,两组患者的血清性激素水平比较差异均无统计学意义(P>0.05);治疗后,两组患者的FSH、LH、E2水平较治疗前显著下降,且观察组较对照组明显更低,TT、P水平则较治疗前明显上升,且观察组显著高于对照组,差异均有统计学意义(P<0.05);但两组患者的PRL水平比较差异无统计学意义(P>0.05),见表1。
表1 两组患者治疗前后的血清性激素水平比较()

表1 两组患者治疗前后的血清性激素水平比较()
注:与本组治疗前比较,aP<0.05。
项目 时间 观察组(n=40)对照组(n=40)t值P值LH(mIU/mL)FSH(mIU/mL)P(nmol/L)E2(pmol/L)PRL(ng/mL)TT(nmol/L)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后7.13±1.42 4.85±1.56a 9.54±2.11 5.88±2.93a 1.25±0.62 1.82±0.74a 160.62±49.75 124.58±41.36a 5.02±0.59 4.93±0.62 8.94±1.36 15.55±1.42a 7.22±1.39 5.92±1.71a 9.58±2.15 7.22±2.95a 1.26±0.60 1.45±0.46a 161.27±49.53 146.59±53.21a 5.11±0.58 4.95±0.54 8.97±1.33 12.35±1.41a 0.287 2.924 0.084 2.038 0.073 2.686 0.059 2.066 0.688 0.154 0.01 10.114 0.775 0.005 0.933 0.045 0.942 0.009 0.954 0.042 0.494 0.878 0.921 0.001
2.2 两组患者治疗前后的AMS 评分比较 治疗前,两组患者的ASM 评分比较差异无统计学意义(P>0.05);治疗后,两组患者的性功能症状、心理症状、体能症状及总AMS评分均较治疗前明显下降,且观察组明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后的AMS评分比较(,分)

表2 两组患者治疗前后的AMS评分比较(,分)
注:与本组治疗前比较,aP<0.05。
组别 例数 心理症状 体能症状 性功能症状 总分观察组对照组t值P值40 40治疗前11.86±2.64 11.92±2.55 0.103 0.918治疗后6.52±1.33a 8.14±1.42a 5.266 0.001治疗前13.17±6.15 13.19±6.32 0.014 0.989治疗后7.49±2.26a 9.27±2.51a 3.333 0.001治疗前14.99±3.84 14.98±3.86 0.012 0.991治疗后7.93±1.25a 9.38±1.36a 4.965 0.001治疗前40.02±8.49 40.09±8.54 0.037 0.971治疗后21.94±5.84a 26.79±5.93a 3.686 0.001
2.3 两组患者治疗前后的IIEF-5评分比较 治疗前,两组患者IIEF-5 评分比较差异无统计学意义(P>0.05);治疗后,两组患者的IIEF-5 评分均较治疗前明显上升,且观察组明显高于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后的IIEF-5评分比较(,分)
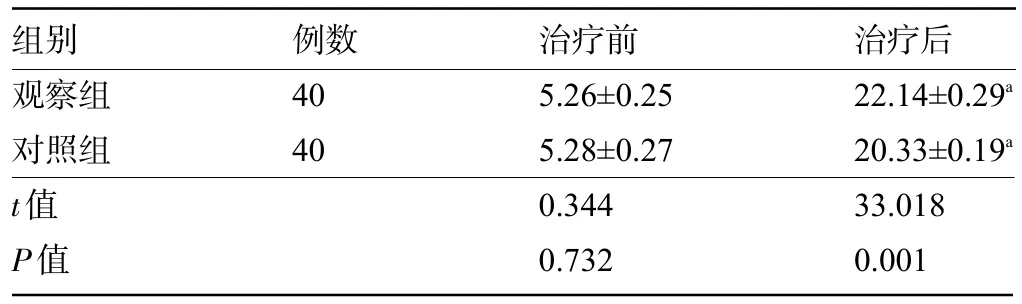
表3 两组患者治疗前后的IIEF-5评分比较(,分)
注:与本组治疗前比较,aP<0.05。
组别观察组对照组t值P值治疗后22.14±0.29a 20.33±0.19a 33.018 0.001例数40 40治疗前5.26±0.25 5.28±0.27 0.344 0.732
2.4 两组患者治疗前后的其他实验室指标比较 治疗前及治疗后,两组患者的GOT、RBC、ALT、Cr、GLU 及tPSA 水平比较差异均无统计学意义(P>0.05),见表4。
表4 两组患者治疗前后的其他实验室指标比较()

表4 两组患者治疗前后的其他实验室指标比较()
注:与本组治疗前比较,aP<0.05。
项目GOT(U/L)ALT(U/L)RBC(×1012/L)GLU(mmol/L)Cr(μmol/L)tPSA(μg/L)时间治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=40)19.65±1.84 20.02±1.86a 16.98±1.65 17.50±1.72a 4.37±0.48 4.52±0.50a 4.49±0.42 4.62±0.73a 86.95±4.88 88.16±6.71a 1.43±0.38 1.55±0.46a对照组(n=40)19.66±1.76 20.13±1.79a 16.88±1.57 17.51±1.66a 4.38±0.46 4.58±0.47a 4.50±0.38 4.65±0.77a 86.97±4.76 88.28±6.81a 1.46±0.37 1.58±0.42a t值0.011 0.117 0.121 0.012 0.041 0.242 0.05 0.075 0.008 0.034 0.154 0.135 P值0.991 0.908 0.904 0.991 0.967 0.81 0.961 0.941 0.994 0.973 0.878 0.893
2.5 两组患者治疗后的不良反应比较 治疗后,观察组患者的总不良反应发生率为10.0%,明显低于对照组的35.0%,差异具有统计学意义(χ2=7.169,P=0.007<0.05),见表5。

表5 两组患者治疗后的不良反应比较(例)
3 讨论
目前,临床关于LOH 的发病机制尚未有统一定论。国内有研究表明,男性体内雄性激素随着年龄递增以每年约2%的水平递减,与体内性激素结合球蛋白递增并与血浆睾酮结合有关,这为治疗LOH补充睾酮提供了有力的理论依据[9]。十一酸睾酮是一种雄性激素制剂,属于睾酮衍生物,应用于治疗LOH 效果显著,但这种靠外源性睾酮补充以提高TT 水平的方法无法根治该疾病,还可能产生不良影响,导致患者不育[10]。枸橼酸氯米芬是一种选择性雌激素受体调节剂,主要通过占据患者腺垂体、下丘脑的雌激素受体而阻滞内源性雌激素发生作用,增加FSH、LH分泌,提高精子生长率和成熟率[11]。
ASM量表、ADAM量表是目前应用于研究LOH的较为常用的量表,前者于1999被提出用于评价LOH,主要包含性功能、心理、体能三方面症状,优点在于细化对患者症状的评分[12];后者于2000年被提出用于筛选LOH,其特异性、敏感性均较好,唯一不足在于无评分系统,不能区分症状的严重程度[13]。因此,本研究在给予LOH患者十一酸睾酮联合枸橼酸氯米芬治疗后,应用ASM量表对患者治疗前后症状进行有效评分,以评估临床治疗效果。结果显示患者性功能症状、心理症状、体能症状及总AMS 评分均较治疗前显著下降,且联合应用治疗患者评分较单一治疗患者评分更低,说明应用该方法治疗后,患者症状得到进一步有效改善,比单一用药疗效更为显著,这可能是因为枸橼酸氯米芬胶囊具有较好的抗性激素作用,联合十一酸睾酮用于治疗可进一步升高LH 和FSH 水平,促进精子生成,增加精子活力和数量。同时,勃起功能障碍是LOH的常见症状之一,男性正常性功能的维持主要依靠睾酮,因此睾酮水平的下降是导致勃起障碍的主要原因。相关研究结果显示,约有12%勃起障碍患者睾酮水平异常[14]。而既往有研究发现,在十一酸睾酮基础上应用枸橼酸氯米芬对于治疗勃起障碍效果显著[15]。但关于其改善LOH 患者性功能的效果尚未可知,因此本研究应用该方法对LOH患者进行治疗,发现治疗后IIEF-5评分均较治疗前明显上升,证实其对于改善LOH患者勃起功能具有重要意义,这可能是因为枸橼酸氯米芬能有效促进内源性睾酮生成,睾酮具有加速免疫球蛋白、蛋白质合成,减缓氨基酸分解,提高肌力,增强免疫,缓解疲劳,保持旺盛精力的作用,同时其水平升高也加大对生理功能的调节,从而改善勃起障碍。
此外,本研究在十一酸睾酮基础上应用枸橼酸氯米芬治疗LOH 患者,其FSH、LH、E2 水平较治疗前显著下降,且联合用药治疗患者水平下降更为显著;TT、P 水平则较治疗前明显上升,且联合用药治疗者上升也更为显著,这与相关报道一致[16]。提示患者经联合用药治疗后性激素水平得到更为明显改善,分析原因可能是因为枸橼酸氯米芬治疗后可以通过占据患者腺垂体、下丘脑的雌激素受体阻滞内源性雌激素发生作用,增加FSH、LH、E2 分泌,从而使得其作用于睾丸间质而生成内源性睾酮,最终提高睾酮水平,进一步改善勃起功能障碍。且联合用药患者较单一用药患者不良反应发生率显著更低,提示联合用药也具有较高安全性。
综上所述,十一酸睾酮胶丸和枸橼酸氯米芬胶囊联合治疗男性LOH的疗效显著,其不仅能明显改善血清性激素水平,降低AMS 评分,还能提高IIEF-5 评分,减少不良反应发生率,有效改善患者临床症状。

