白藜芦醇通过HSF1介导的铁死亡改善糖尿病心肌细胞损伤的机制研究
马振旺,姜德友,胡丙成,袁星星,王 梅,李海龙,蔡绍杰,郭 婧
(1.黑龙江中医药大学,黑龙 江哈尔滨 150040;2.黑龙江省中医药科学院,黑龙 江哈尔滨 150006)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种临床常见的独立于冠心病及高血压的特异性心肌病,是糖尿病患者的重要致死原因之一[1]。研究结果显示,1 型糖尿病和2 型糖尿病患者心脏功能障碍的患病率分别为14.5%和35%,其中糖化血红蛋白水平每增加1%,1 型和2 型糖尿病患者DCM 的风险分别增加30%和8%,DCM 已成为一个严重的公共健康问题[2-4]。
高糖水平在DCM 的发病过程中起着关键作用,长期高血糖可以诱导心肌细胞活性氧的蓄积、凋亡水平的升高和炎症细胞的趋化,是DCM 的主要病理机制[5]。高糖诱导心肌细胞损伤的机制错综复杂,探索高糖诱导心肌损伤的关键靶点及治疗药物对于预防和改善DCM 预后具有重要的意义。白藜芦醇是一种非黄酮类的多酚化合物,已被证实可以有效改善DCM 心功能障碍及心肌纤维化水平[6-10]。然而白藜芦醇抑制心肌细胞损伤的机制尚缺乏深入的研究。本研究拟通过高糖诱导H9c2 构建糖尿病心肌损伤体外模型,通过研究热休克转录因子1(heat shock transcription factor 1,HSF1)介导的铁死亡机制进一步明确白藜芦醇治疗DCM 的机制及靶点。
1 材料与方法
1.1 材料
大鼠H9c2 细胞系购于中国科学院上海生科院细胞资源中心;胎牛血清、DMEM 低糖(5 mol/L)和高糖(30 mol/L)培养基购于美国Gibco 公司(货号分别为10099141C 、11885084 和11965084);白藜芦醇购于上海皓鸿生物医药科技有限公司(CAS:501-36-0 ,纯度≥98%);CCK8 细胞活力检测试剂盒购于南京建成生物工程研究所(货号为G021-1-2);si-HSF1 及阴性对照si-NC 购于上海Gene Pharma 有限公司;LipofectamineTM3000 转染试剂盒购于美国Thermo Fisher 公司(货号:L3000001)。HSF1、Bax、Bcl-2 和β-actin 兔抗鼠单克隆抗体购于美国Cell Signaling Technology 公司(货号分别为12972、5023、3498 和4970),ACSL4、GPX4、SLC7A11 兔抗鼠单抗及Iron 检测试剂盒购于英国Abcam 公司(货号 分 别 为 ab155282、ab125066、ab175186 和ab83366);辣根过氧化物酶标记山羊抗兔IgG 二抗购于上海碧云天生物科技公司(货号为A0208);大鼠乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)检测试剂盒购于武汉伊莱瑞特生物科技股份有限公司(货号分别为E-BCK046-M 和E-BC-K025-S);大鼠超氧化物歧化酶(super oxide dismutase,SOD)ELISA 检测试剂盒购于江苏酶免实业有限公司(货号为MM-0386R2)。
1.2 细胞分组与给药
H9c2 细胞常规培养含10%胎牛血清、10%L-谷氨酰胺和0.5%青霉素/链霉素的低糖DMEM 培养基中,将细胞置于5%CO2、37 ℃的条件下培养,待呈80%贴壁汇合后改用无血清低糖DMEM 继续培养24 h。随后细胞分为空白组、模型组、白藜芦醇组、si-NC 组和si-HSF1 组,其中空白组采用低糖DMEM 培养基,余下4 组采用高糖培养基培养48 h。随后白藜芦醇组给予20 μmol/L 白藜芦醇进行干预,而si-NC 组和si- HSF1 组分别参照试剂盒说明书通过脂质体将si-NC 和si-HSF1 导入细胞中,24 h 后收集细胞用于检测。
1.3 细胞活性检测
24 h 后于各组细胞中加入10 μL 的CCK8 溶液,继续孵育4 h。参照试剂盒说明书,于450 nm 处检测每孔吸光度值。
1.4 Western blot 检测
24 h 后收集各组细胞于冰上裂解,BCA 法测定蛋白浓度。电泳、转膜、脱脂牛奶封闭。加入稀释后的HSF1、Bax、Bcl-2、ACSL4、GPX4、SLC7A11和β-actin 兔抗鼠单抗,4 ℃孵育过夜,加入HRP 标记的二抗,室温下继续孵育40 min。ECL 显影,凝胶成像系统分析,计算目的蛋白条带的相对表达量。
1.5 LDH、SOD、MDA 检测
24 h 后收集各组细胞上清液,参照试剂盒说明书检测各组细胞上清中LDH 的活性;同时,将收集的细胞通过反复冻融进行细胞裂解,3 500 r/min 离心15 min,收集上清,BCA 定量,参照试剂盒说明检测MDA 的含量及SOD 的活性。
1.6 铁离子含量测定
24 h 后收集各组细胞,加入适量细胞裂解液,2 500 r/min 离心10 min,收集上清。参照试剂盒说明书检测各组细胞中铁离子的含量。
1.7 统计学处理
2 结果
2.1 白藜芦醇对H9c2 细胞形态的影响
由图1 所示,空白组细胞形态规整,排列整齐,呈现梭状,细胞边界清楚、大小均等。模型组细胞排列紊乱,呈现短梭状,可见漂浮的死亡细胞,细胞间隙明显增宽。白藜芦醇组细胞形态、排列较模型组明显改善,并与空白组相似,而si-NC 组细胞形态、排列较模型组未见明显改善。si-HSF1 组较模型组细胞排列明显紊乱,细胞变圆并呈现短梭状且大小不等,可见大量细胞碎片及死亡细胞。

图1 倒置相差显微镜下观察各组H9c2 细胞形态(×200 倍)Fig 1 Morphology of H9c2 cell under inverted phase contrast microscope(×200)
2.2 白藜芦醇对H9c2 细胞活性的影响
由表1 可见,与空白组相比,模型组细胞活性显著降低,差异具有统计学意义(P<0.01)。与模型组相比,白藜芦醇组H9c2 细胞活性显著增加,差异具有统计学意义(P<0.01),而si-NC 组H9c2 细胞活性未见明显改变,差异无统计学意义(P>0.05)。si-HSF1 组干预后H9c2 细胞活性显著降低,与模型组比较差异具有统计学意义(P<0.01)。
表1 H9c2 细胞活性比较(n=3,%,±s)Tab 1 Cell viability of H9c2 cell(n=3,%,±s)
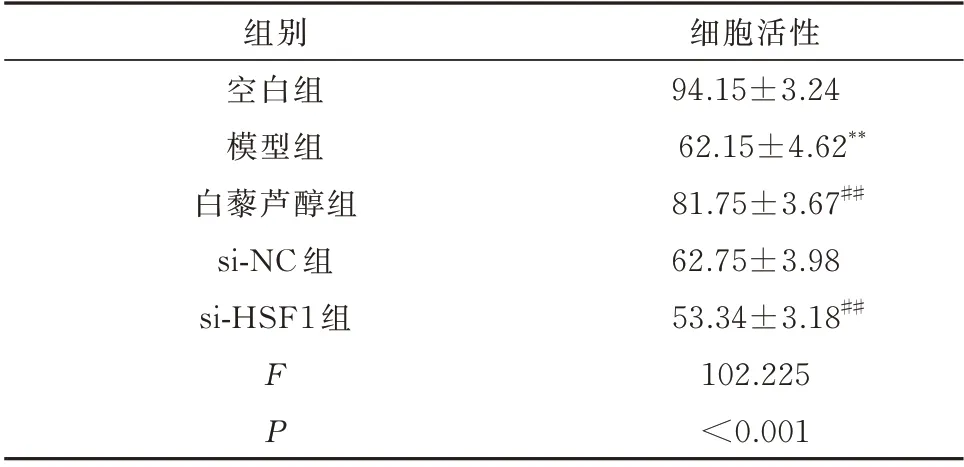
表1 H9c2 细胞活性比较(n=3,%,±s)Tab 1 Cell viability of H9c2 cell(n=3,%,±s)
注:同空白组相比较,**P<0.01;同模型组相比较,##P<0.01。
细胞活性94.15±3.24 62.15±4.62**81.75±3.67##62.75±3.98 53.34±3.18##102.225<0.001组别空白组模型组白藜芦醇组si-NC 组si-HSF1 组FP
2.3 白藜芦醇对H9c2 细胞LDH、SOD、MDA 的影响
与空白组相比,模型组H9c2 细胞中LDH 活性及MDA 的含量显著增加,SOD 的活性显著降低,差异均具有统计学意义(P<0.01)。与模型组相比,白藜芦醇组H9c2 细胞中LDH 活性及MDA 的含量显著降低,SOD 的活性显著增加,差异均具有统计学意义(P<0.01)。而si-NC 组H9c2 细胞LDH、SOD活性及MDA 的含量与模型组相比无明显改变,差异均无统计学意义(P>0.05)。si-HSF1 组干预后H9c2 细胞中LDH 活性及MDA 的含量显著增加,SOD 的活性显著降低,与模型组比较差异具有统计学意义(P<0.01)。见表2。
表2 H9c2 细胞LDH、SOD、MDA 的比较(n=3,±s)Tab 2 Comparison of LDH,SOD,and MDA levels(n=3,±s)
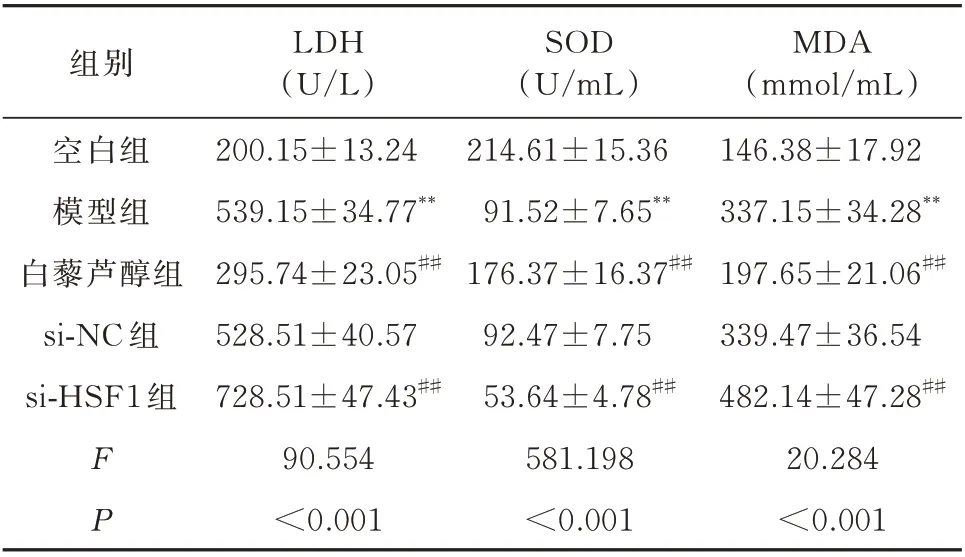
表2 H9c2 细胞LDH、SOD、MDA 的比较(n=3,±s)Tab 2 Comparison of LDH,SOD,and MDA levels(n=3,±s)
注:同空白组相比较,**P<0.01;同模型组相比较,##P<0.01。
组别空白组模型组白藜芦醇组si-NC 组si-HSF1 组MDA(mmol/mL)146.38±17.92 337.15±34.28**197.65±21.06##339.47±36.54 482.14±47.28##20.284<0.001 FP LDH(U/L)200.15±13.24 539.15±34.77**295.74±23.05##528.51±40.57 728.51±47.43##90.554<0.001 SOD(U/mL)214.61±15.36 91.52±7.65**176.37±16.37##92.47±7.75 53.64±4.78##581.198<0.001
2.4 白藜芦醇对H9c2 细胞凋亡蛋白表达的影响
与空白组相比,模型组H9c2 细胞中Bax 蛋白的表达及Bax/Bcl-2 的比值显著增加,HSF1 和Bcl-2蛋白的表达显著降低,差异均具有统计学意义(P<0.01)。与模型组相比,白藜芦醇组H9c2 细胞中Bax 蛋白的表达及Bax/Bcl-2 的比值显著降低,HSF1 和Bcl-2 蛋白的表达显著增加,差异均具有统计学意义(P<0.01)。而si-NC 组H9c2 细胞HSF1、Bax 和Bcl-2 蛋白的表达及Bax/Bcl-2 的比值与模型组相比无明显改变,差异均无统计学意义(P>0.05)。si-HSF1 组干预后H9c2 细胞中Bax 蛋白的表达及Bax/Bcl-2 的比值显著增加,HSF1 和Bcl-2 蛋白的表达显著降低,与模型组比较差异具有统计学意义(P<0.01)。见表3 及图2。
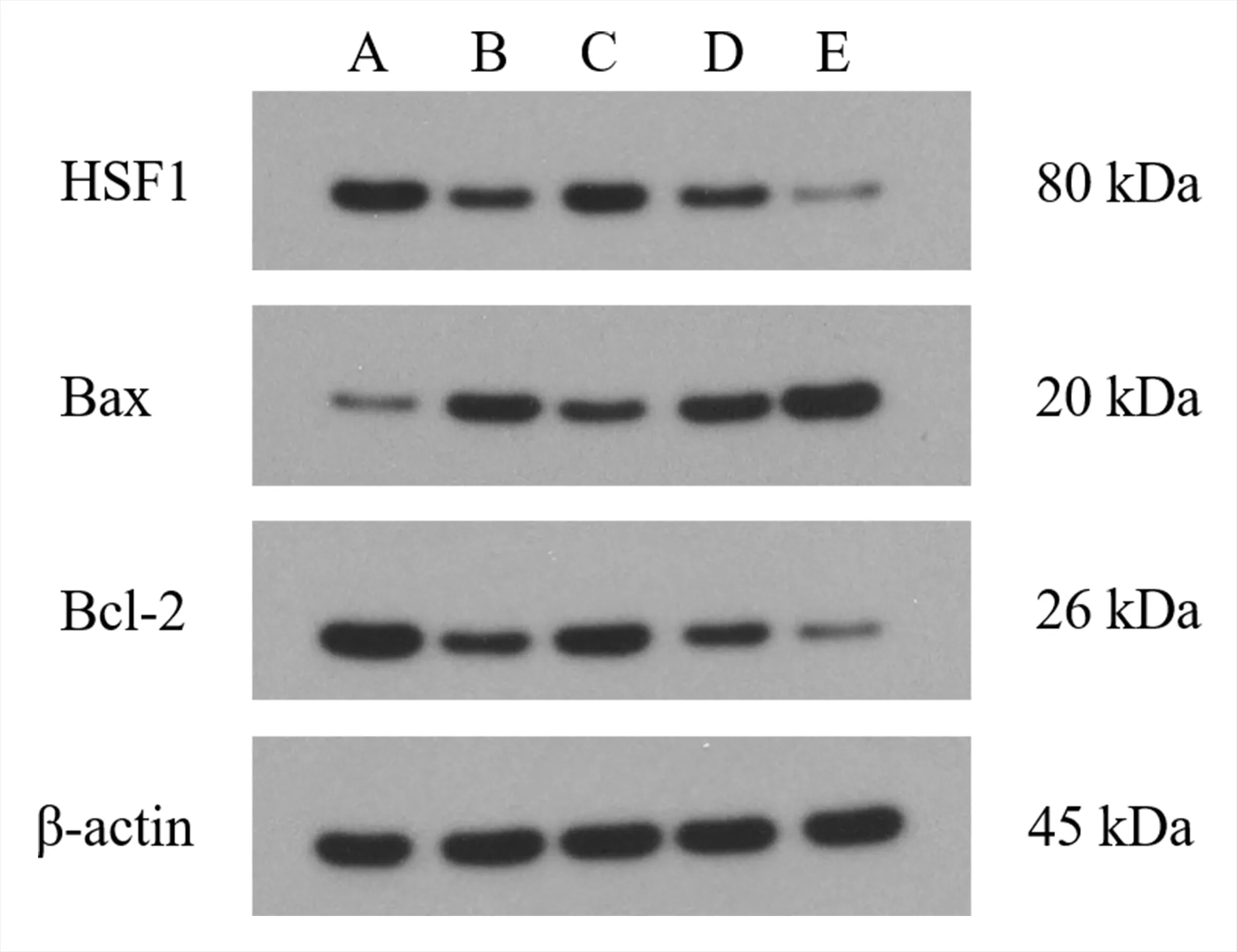
图2 各组H9c2 细胞中HSF1、Bax 和Bcl-2 蛋白表达的比较Fig 2 Protein expression of HSF1,Bax,and Bcl-2
表3 H9c2细胞中HSF1、Bax和Bcl-2蛋白表达的比较(n=3,±s)Tab 3 Protein expression of HSF1,Bax,and Bcl-2(n=3,±s)

表3 H9c2细胞中HSF1、Bax和Bcl-2蛋白表达的比较(n=3,±s)Tab 3 Protein expression of HSF1,Bax,and Bcl-2(n=3,±s)
注:同空白组相比较,**P<0.01;同模型组相比较,##P<0.01。
组别空白组模型组白藜芦醇组si-NC 组si-HSF1 组HSF1/β-actin 1.03±0.14 0.51±0.11**0.92±0.13##Bax/β-actin 0.18±0.02 0.85±0.14**0.41±0.07##Bcl-2/β-actin 1.19±0.15 0.39±0.06**1.00±0.16##Bax/Bcl-2 0.15±0.02 2.16±0.24**0.42±0.11##0.52±0.09 0.21±0.03##0.84±0.11 1.21±0.19##0.40±0.07 0.21±0.03##2.15±0.19 5.89±0.38##346.548<0.001 FP 34.260<0.001 28.526<0.001 154.917<0.001
2.5 白藜芦醇对H9c2 细胞铁离子含量的影响
与空白组相比,模型组H9c2 细胞中Fe2+的含量显著增加,差异具有统计学意义(P<0.01)。与模型组相比,白藜芦醇组H9c2 细胞中Fe2+的含量显著降低,差异具有统计学意义(P<0.01)。而si-NC 组H9c2 细胞中Fe2+的含量与模型组相比无明显改变,差异均无统计学意义(P>0.05)。si-HSF1 组干预后H9c2 细胞中Fe2+的含量显著增加,与模型组比较差异具有统计学意义(P<0.01)。见表4。
表4 各组H9c2 细胞中铁离子含量的比较(n=3,±s)Tab 4 Fe2+content in H929c2 cell(n=3,±s)
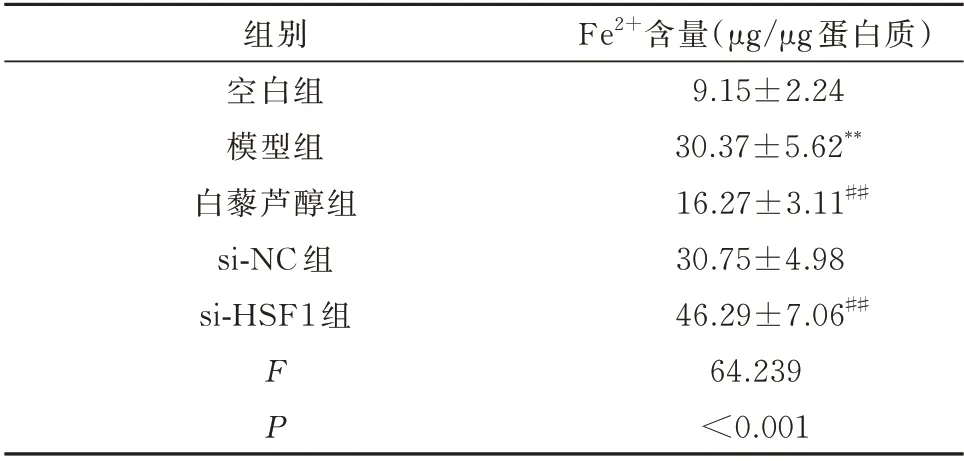
表4 各组H9c2 细胞中铁离子含量的比较(n=3,±s)Tab 4 Fe2+content in H929c2 cell(n=3,±s)
注:同空白组相比较,**P<0.01;同模型组相比较,##P<0.01。
Fe2+含量(μg/μg 蛋白质)9.15±2.24 30.37±5.62**16.27±3.11##30.75±4.98 46.29±7.06##64.239<0.001组别空白组模型组白藜芦醇组si-NC 组si-HSF1 组FP
2.6 白藜芦醇对H9c2 细胞铁死亡相关蛋白表达的影响
与空白组相比,模型组H9c2 细胞中ACSL4 蛋白的表达显著增加,GPX4 和和SLC7A11 蛋白的表达显著降低,差异均具有统计学意义(P<0.01)。与模型组相比,白藜芦醇组H9c2 细胞中ACSL4 蛋白的表达显著降低,GPX4 和SLC7A11 蛋白的表达显著增加,差异均具有统计学意义(P<0.01)。而si-NC 组H9c2 细胞ACSL4、GPX4 和SLC7A11 蛋白的表达与模型组相比无明显改变,差异均无统计学意义(P>0.05)。si-HSF1 组干预后H9c2 细胞中ACSL4 蛋白的表达显著增加,GPX4 和SLC7A11蛋白的表达显著降低,与模型组比较差异具有统计学意义(P<0.01)。见表5 及图3。
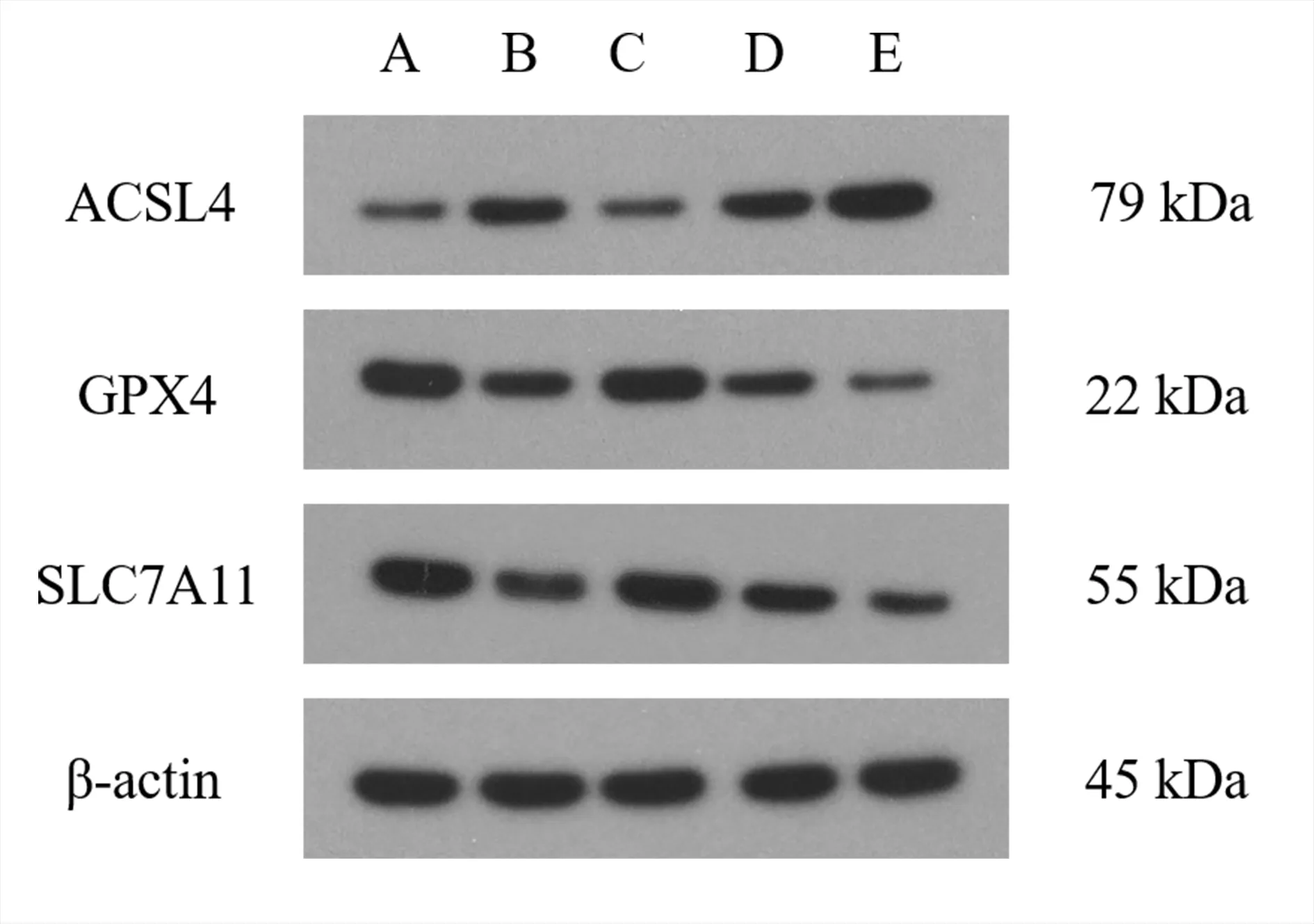
图3 各组H9c2 细胞中ACSL4、GPX4 和SLC7A11 蛋白表达的比较Fig 3 Protein expression of in ACSL4,GPX4,and SLC7A11
表5 各组H9c2 细胞中ACSL4、GPX4 和SLC7A11 蛋白表达的比较(n=3,±s)Tab 5 Protein expression of in ACSL4,GPX4,and SLC7A11(n=3,±s)
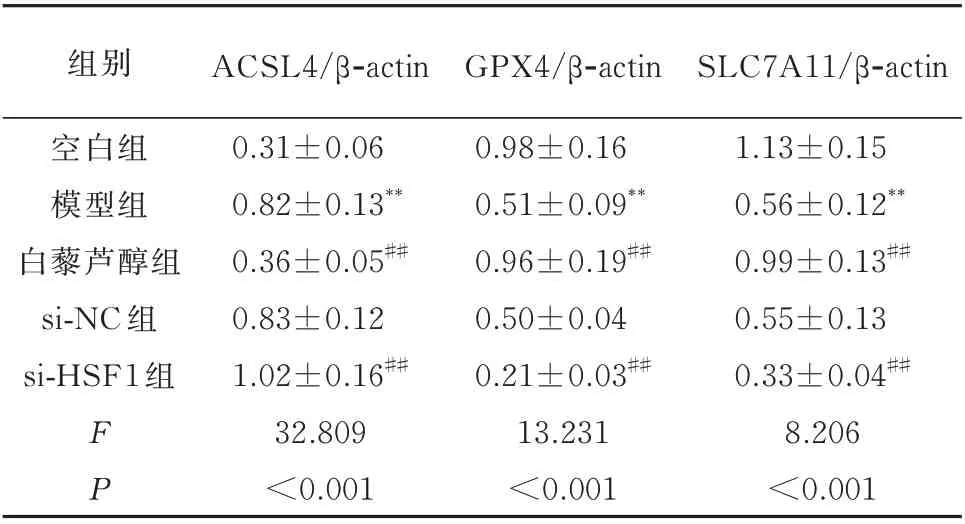
表5 各组H9c2 细胞中ACSL4、GPX4 和SLC7A11 蛋白表达的比较(n=3,±s)Tab 5 Protein expression of in ACSL4,GPX4,and SLC7A11(n=3,±s)
注:同空白组相比较,**P<0.01;同模型组相比较,##P<0.01。
组别空白组模型组白藜芦醇组si-NC 组si-HSF1 组ACSL4/β-actin GPX4/β-actin SLC7A11/β-actin 1.13±0.15 0.56±0.12**0.99±0.13##0.55±0.13 0.33±0.04##8.206<0.001 FP 0.31±0.06 0.82±0.13**0.36±0.05##0.83±0.12 1.02±0.16##32.809<0.001 0.98±0.16 0.51±0.09**0.96±0.19##0.50±0.04 0.21±0.03##13.231<0.001
3 讨论
近年来随着饮食结构和生活习惯的改变,糖尿病的患病率呈现逐年增高的趋势,已成为一个严重的公共卫生问题并且带来巨大的社会及经济负担。调查结果显示,我国成人糖尿病患病率为10.7%,高于全球平均水平;其中总人数高达1.14 亿,约占全球成人糖尿病患者总人数的25%以上,位居世界第一[11]。代谢紊乱可触发心肌细胞的生物学改变,从而引起心肌功能的异常,随后在微循环障碍、心肌小血管和自主神经病变的基础上发展至心力衰竭。葡萄糖清除障碍及糖异生增加导致的高糖血症引起心肌细胞的毒性是DCM 的核心发病机制[12]。一方面,慢性高血糖可以增加细胞内来源于复合物I和复合物Ⅲ的电子传递链的ROS,通过诱导心肌细胞的凋亡从而引起细胞的损伤[13]。另一方面,ROS的激活通过糖基化终末端产物和醛糖还原酶的增加诱导心肌损伤的级联反应,从而引起心肌细胞的凋亡[14]。本研究结果显示白藜芦醇可以显著改善高糖诱导的H9c2 细胞的活性,降低LDH 活性及MDA 的含量,同时增加H9c2 细胞SOD 的活性,表明白藜芦醇可以有效改善高糖诱导的心肌细胞的损伤和氧化应激水平,提高心肌细胞的抗氧化能力。此外,通过Western blot 检测心肌细胞中凋亡蛋白Bax 及Bcl-2 的表达水平,结果表明白藜芦醇可以显著降低H9c2 细胞中Bax 蛋白的表达及Bax/Bcl-2 的比值,增加Bcl-2 蛋白的表达,从而抑制心肌细胞的凋亡水平。
HSF1 是热休克转录因子家族的一员,主要负责热休克蛋白的转录调控,后者除具有降解、修复受损蛋白及维持新生蛋白折叠外,还能通过调控胚胎发育、细胞增殖、凋亡及分化等过程参与细胞生物学过程。刘亭等[15]通过体外实验证实,过表达HSF1 可以通过上调细胞中HSP70 的表达、提高抗氧化应激的能力,从而增强参芎葡萄糖注射液改善心肌细胞氧化应激损伤的作用。除此之外,HSF1还可以促进Akt 的磷酸化水平,通过调控血管新生机制从而改善压力超负荷诱导的心室重构及心力衰竭[16]。本研究结果显示,HSF1 蛋白的表达水平在高糖诱导的糖尿病心肌损伤体外模型中显著降低。干扰HSF1 的表达能显著抑制糖尿病心肌损伤体外模型的细胞活性和增加LDH 活性,进一步证实HSF1 在高糖诱导的H9c2 细胞中的保护作用;同时抑制HSF1 的表达还能够显著增加细胞中MDA 的含量和降低SOD 的活性,增加细胞中Bax 蛋白的表达及Bax/Bcl-2 的比值,降低Bcl-2 蛋白的表达,这表明HSF1 保护心肌损伤的主要是通过促进心肌细胞抗氧化和凋亡实现的。
铁死亡是一种新型的铁依赖的程序性细胞死亡形式,是由脂质过氧化、氧化应激、谷氨酸-胱氨酸转运及铁代谢异常等多种途径产生超过机体脂质ROS 代谢能力的病理过程[17]。铁是人体必须的微量元素之一,机体内的铁以Fe3+/转铁蛋白复合物的形式通过细胞膜上的转铁蛋白受体转运至细胞中,在通过细胞质内还原酶的作用下Fe3+被还原成Fe2+。铁稳态对于维持细胞生理功能具有重要的作用,一旦机体内铁代谢异常(尤其是细胞内Fe2+过载)则会通过Fenton 反应产生大量的ROS 和对细胞具有较强毒性的羟自由基,从而破坏细胞DNA和蛋白质等对细胞及组织造成损伤[18]。与细胞凋亡和自噬不同,病理形态上铁死亡主要表现为线粒体膜密度的增加及线粒体体积的收缩。然而,越来越多的研究证实铁死亡与细胞凋亡、自噬之间存在着密切的联系[19]。一方面细胞凋亡可转成铁死亡,同时铁死亡可增加细胞凋亡的敏感性,另一方面,自噬溶酶体降解-释放的Fe2+进一步诱导氧化应激从而促进铁死亡的发生[20]。
ACSL4、GPX4 和SLC7A11 为铁死亡的标记蛋白,其中ACSL4 通过磷脂酰肌醇或者磷脂酰乙醇等电膜磷脂的合成促进细胞铁死亡。同时ACSL4还可以通过上调5 羟基二十碳四烯酸的表达诱导细胞铁死亡,后者具有较强的脂毒性[21]。作为最经典的抗氧化酶防御途径,GPX4 通过特异性的催化脂质过氧化的并使其失去氧化活性,从而抑制细胞铁死亡水平。李丽等[22]证实GPX4 蛋白在心肌缺血再灌注小鼠模型心肌组织中的表达水平显著降低,通过上调GPX4 蛋白的表达可以显著抑制铁死亡从而改善心肌缺血再灌注损伤。SLC7A11 定位于人体四号染色体上,作为SLC7 家族的一员,SLC7A11是细胞中胱氨酸和谷氨酸重要的转运体。生理条件下,SLC7A11 可将胱氨酸转运至细胞内参与ROS 的清除,而抑制SLC7A11 的表达可损伤细胞的抗氧化能力诱导铁死亡的发生[23]。本研究结果显示高糖诱导的H9c2 细胞中Fe2+的含量显著增加,ACSL4 蛋白的表达显著增加,GPX4 和SLC7A11蛋白的表达显著降低,表明细胞铁死亡水平显著增加。白藜芦醇可以通过下调ACSL4 蛋白的表达及上调GPX4 和SLC7A11 蛋白的表达,从而抑制细胞内Fe2+过载。而抑制HSF1 的表达增加了细胞中ACSL4 的表达和下调了GPX4 和SLC7A11 蛋白的表达水平,这表明HSF1 是白藜芦醇抑制H9c2 细胞的重要靶点。
综上所述,白藜芦醇可以促进高糖诱导的心肌细胞的活性、抑制氧化应激及细胞凋亡水平,对高糖诱导的心肌细胞具有保护作用,具体机制是通过上调HSF1 的表达进而抑制细胞铁死亡水平实现的。
作者贡献度说明:
实验由马振旺设计,姜德友指导,蔡绍杰、郭婧和李海龙完成实验造模、药物干预;袁星星负责指标检测;王梅和胡丙成对实验数据进行审核及统计分析。论文由马振旺撰写,姜德友审稿。

