腺相关病毒衣壳蛋白修饰的研究进展
陈倩影,马萃娇,吕亚丰,曹春雨
三峡大学医学院 肿瘤微环境与免疫治疗湖北省重点实验室,湖北宜昌 443002
基因治疗是以治疗或治愈某种疾病为目的,引入、去除或改变遗传密码内容,基于递送编码治疗性蛋白质或RNA作为基因编辑策略,在基因水平上治疗疾病的方法[1]。选择高效、安全的递送载体是实现基因治疗的首要问题。目前,基因治疗主要采用的递送载体系统有病毒载体[腺病毒载体、慢病毒载体[2]、腺相关病毒(adeno-associated virus,AAV)载体]、纳米颗粒和脂质体等。其中AAV载体具有基因容量较大、基因组不整合、无致病性等显著优势,近年来已成为基因治疗研究的主要递送载体[3-4]。2012年以来,美国食品药物管理局(FDA)批准基于多种AAV载体开发的基因治疗药物,如Glybera、Luxturna®和Zolgensma®分别用于遗传性脂蛋白脂肪酶缺乏症、Leber先天性黑蒙病和脊髓性肌萎缩症的临床治疗[5]。鉴于衣壳蛋白靶向性修饰在AAV载体研究中的核心作用,本文就AAV及其衣壳蛋白靶向性修饰的新近研究进展做一综述,并讨论AAV衣壳改造在基因治疗中的前景及应用。
1 AAV生物学特性
1.1 AAV 结构 AAV 属于细小病毒科,是单链DNA病毒,基因组包含两端的反向末端重复序列(inverted terminal repeats,ITRs)、转录调控区启动子(P5、P19、P40)和两个分别编码Rep和Cap蛋白的开放阅读框,全长4.7 kb(图1)。ITRs是AAV基因组中必需的顺式作用元件,其由180个碱基组成,是DNA复制、包装和整合位点的起始位点并在单链DNA复制过程中起“引物”的作用[6]。Rep基因编码病毒DNA复制和组装需四种蛋白质——Rep40、Rep52、Rep68和Rep78。Cap基因编码来自两个交替剪接mRNA的三个病毒衣壳蛋白——VP1、VP2和VP3,同时编码组装激活蛋白[7]。AAV衣壳VP1、VP2和VP3蛋白分子组装成直径约25 nm的二十面体粒子,其VP1、VP2和VP3蛋白分子的比例为1∶1∶10。
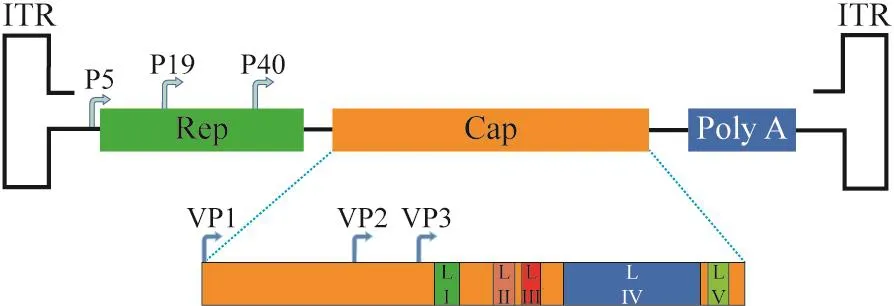
图1 AAV的基因组结构示意图Fig.1 Schematic of AAV genome structure
1.2 AAV 血清型及其细胞受体 AAV 病毒基因组中,ITR和Rep基因序列相对保守,而Cap基因序列则差异性较大,由此产生具有不同衣壳蛋白的AAV病毒。由于AAV病毒衣壳蛋白的氨基酸组成直接决定其组织亲嗜性和感染细胞的能力,研究者以此为标准把近年来鉴定的来自人类或非人灵长类的AAV病毒分为13个血清型,即 AAV1 ~ AAV13[8]。具有代表性的是 AAV1 ~AAV9,比对 AAV1 ~ AAV9 的衣壳蛋白序列发现,这9个AAV血清型的衣壳蛋白氨基酸序列一致性为58% ~ 99%,其中AAV1与AAV9衣壳蛋白氨基酸序列一致性达99%、与AAV2/3/6/7/8衣壳蛋白氨基酸序列一致性达82%以上[9]。这表明AAV衣壳氨基酸组成及结构是决定其组织亲嗜性的关键,而现有研究已证明细胞表面多糖与AAV衣壳蛋白的结合是影响AAV感染细胞能力的重要因素。AAV成员转导细胞的能力已被证明是由于其衣壳与不同细胞表面聚糖结合。细胞膜表面硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycan,HSPG)是第一个被鉴定的AAV病毒细胞受体,其通过识别结合AAV2/3/6血清型衣壳突出部蛋白碱性区域(包含第585位和第588位精氨酸),使病毒附着于细胞表面,由此启动AAV进入细胞的过程(图2)[10]。此后,唾液酸和N末端半乳糖基化多糖也被证明是AAV病毒进入细胞的表面多糖受体[11-12]。目前,AAV病毒的细胞表面受体主要是三大类多糖,即HSPG受体(AAV2、AAV3和AAV6)、唾液酸受体(AAV1、AAV4、AAV5和AAV6)和半乳糖基化受体(AAV9)[13]。除多糖受体以外,2016年Pillay等[14]报道了一种介导AAV细胞转导的蛋白质受体AAVR(又称为KIAA0319L)。AAVR是Ⅰ型跨膜蛋白,通过胞外Ig样结构域(多囊肾病结构域)直接与邻近二十面体三重轴的AAV2衣壳刺突蛋白相互作用,由此介导AAV2的入胞作用。

图2 AAV血清型受体分类Fig.2 Classification of AAV serotype receptors
1.3 AAV 的组织嗜性和细胞转导效率 不同AAV血清型对人体组织的嗜性和转导效率显著不同,尽管多数AAV都能在肝中富集,但AAV8具有脂肪组织嗜性[15]、AAV9具有心脏、肝、骨骼肌组织嗜性并能够穿越血-脑脊液屏障富集于脑组织[16]。一方面,AAV的组织嗜性和细胞转导效率主要依赖于衣壳蛋白结构,尤其是VP3与宿主细胞表面受体的相互作用;另一方面,当AAV进入宿主细胞后,AAV递送基因在细胞内的稳定表达依赖于AAV从细胞内体中释放并进入细胞核,而这一过程与宿主细胞内相关信号分子和衣壳蛋白VP1的相互作用有关[17]。
2 AAV衣壳靶向性修饰
如何通过改造AAV衣壳蛋白获得具有组织或细胞靶向性的高效基因递送载体是基因治疗研究领域的核心问题。近年来,基于合理设计、定向进化和化学方法修饰等基因工程策略的AAV衣壳修饰已广泛用于AAV基因靶向递送研究。
2.1 合理设计 合理设计,即通过基因工程技术改造衣壳蛋白编码序列,从而赋予AAV靶向性或提高其基因转导效率。已有大量研究证实,将组织和细胞靶向性短肽或蛋白质编码序列插入衣壳蛋白编码序列,经基因转录、翻译后形成新的重组AAV衣壳蛋白,可获得具有特定组织或细胞靶向性的重组AAV载体[18-19]。AAV衣壳蛋白VP1、VP2和VP3由同一个启动子P40驱动转录,然后分别在各自起始密码子引导下翻译,并最终以1∶1∶10的比例组装形成病毒衣壳,短肽或蛋白质的插入可直接改变衣壳蛋白结构,有可能影响病毒衣壳组装。因此,插入位点通常在VP2起始密码子后或VP3编码区的非保守区域(可变区Ⅳ/Ⅴ/Ⅷ在衣壳蛋白表面形成Loop结构并能够容纳外源性多肽的插入),从而使得修饰肽段或蛋白暴露在衣壳蛋白表面并位于蛋白亲水区,有利于修饰肽或蛋白介导rAAV的靶向细胞转导[20]。如肌肉细胞表面高表达胰岛素受体,Jackson等[21]将胰岛素受体结合肽S519编码序列插入AAV9衣壳蛋白G543(可变区Ⅳ)和A589(可变区Ⅷ)位点,产生表面携带S519的rAAV9,成功实现了rAAV9的小鼠肌肉组织靶向基因递送。
AAV衣壳蛋白具有泛素化、糖基化、乙酰化、磷酸化、SUMO化等多种翻译后修饰功能,这些单个或多个氨基酸的翻译后修饰在AAV的细胞转导、细胞内脱衣壳和细胞核转运过程中发挥重要作用[22]。AAV1/2/5/7/9和rh10的VP1、VP3蛋白N端具有乙酰化修饰,并影响AAV进入细胞核前的降解和脱壳过程[23]。Frederick等[24]对AAV5衣壳蛋白分别进行S2G、S2P、S194P、S194G、S2G+S194G和S2P+S194P点突变。由于将乙酰化位点丝氨酸突变为甘氨酸和脯氨酸,使得AAV5的VP1、VP3蛋白N端不发生乙酰化(S-P)或乙酰化水平显著下降(S-G),由此可观察N端乙酰化对AAV5衣壳蛋白组装和转导能力的影响。结果表明,VP1、VP3蛋白N端乙酰化不影响衣壳蛋白组装,但S194G突变使得AAV5对小鼠视网膜外核层细胞和脉络膜细胞转导效率显著增加。2021年,Crosson等[25]对AAV2衣壳蛋白进行V387R、W502H、E530K、L583R点突变使衣壳蛋白疏水性增加,结果发现AAV2的视网膜细胞转导效率显著下降。但如果同时进行AAV2衣壳蛋白R585A、R588A点突变(AAV2的HSPG受体结合位点),则显著提高了AAV2对小鼠和非人灵长类动物恒河猴视网膜细胞的转导效率。因此,突变AAV衣壳蛋白的特定翻译后修饰位点能够通过改变其表面电荷性质、亲/疏水结构等途径显著影响AAV的转导效率、靶向性和递送基因表达水平。
2.2 定向进化 定向进化,即通过诱导蛋白质编码基因突变,产生具有定制特性的蛋白质。经典的AAV定向进化策略包括DNA shuffling、随机多肽序列插入和噬菌体展示,由此制备AAV衣壳蛋白编码序列的随机重排序列文库,包装AAV,然后通过多轮体内或体外的细胞和组织感染、富集、筛选步骤,获得具有定制特性的AAV衣壳[26]。Liu等[27]以AAV1/2/3B/4/6/7/8/9衣壳编码序列为基础构建DNA shuffling文库,以AAV2衣壳编码序列为基础构建多肽展示文库,然后等比例混合两种文库,感染Tie2-GFP转基因小鼠(由于该小鼠的内皮细胞特异性表达GFP,可直接进行流式细胞术分选),通过提取小鼠心脏内皮细胞进行PCR扩增筛选衣壳蛋白编码序列、建立AAV文库、感染小鼠内皮细胞,并将这一过程多轮重复,最后获得能够靶向转导小鼠心脏内皮细胞的AAV 突变体。2020年,De Alencastro等[28]以“Barcode”标记AAV文库、通过高通量测序跟踪定向AAV衣壳的进化和转导,结果发现这一策略的缺点主要在于:1)随机效应;2)具有不同衣壳蛋白组成的AAV在转导同一细胞时具有竞争效应;3)AAV文库制备中采用的辅助病毒在此过程中将选择性促进文库中易复制AAV的生成。由于该策略是筛选AAV基因组DNA而非mRNA,这种多轮筛选策略反而对AAV转导能力形成负性选择。为优化定向进化策略,2021年Tabebordbar等[29]报道了一种名为 DELIVER(directed evolution of AAV capsids leveraging in vivo expression of transgene RNA)的AAV载体衣壳定向进化方法,该方法基于合理性设计来制备多样性衣壳蛋白文库,以该AAV文库感染小鼠、递送编码其自身衣壳蛋白基因并以该衣壳蛋白的mRNA为筛选对象,由此筛选具有组织特异性和高效转导能力的rAAV衣壳蛋白序列。该研究具体步骤:在AAV9衣壳蛋白Ⅷ疏水区第588位和589位氨基酸位点中插入随机组成的七肽(以使插入的肽段暴露于衣壳蛋白表面),构建多样性衣壳蛋白文库。将上述插入随机组成七肽的衣壳蛋白构建于通用启动子(CMV)驱动的质粒载体,构成多样性衣壳蛋白编码基因递送文库。将二者结合,经293T细胞系包装、建立递送编码其自身衣壳蛋白基因的多样性衣壳蛋白文库后,使用C57BL/6J小鼠进行体内基因递送,提取肌肉组织,通过检测衣壳蛋白DNA和mRNA筛选出靶向并有效转导肌肉组织的AAV。进一步,将筛选获得的AAV衣壳蛋白编码序列构建于两种小鼠肌肉组织特异性启动子(CK8、MHCK7)驱动的带有ITR序列的质粒载体作为递送基因,将其与前述多样性衣壳蛋白编码基因递送文库结合制备rAAV,对C57BL/6J小鼠进行体内基因递送。再次通过相同的衣壳蛋白DNA和mRNA筛选步骤,与前述结果比对,该研究成功获得靶向并有效转导肌肉组织的AAV衣壳蛋白编码序列(插入该衣壳蛋白的七肽中,前三个氨基酸为RGD)。该研究同时发现,多样性衣壳蛋白编码基因rAAV文库感染小鼠的组织中,同一种衣壳蛋白编码的DNA和mRNA水平并不一致,而转导基因的mRNA水平是鉴定有效的特异性组织或细胞基因转导的主要指标。这一结果表明,基于AAV衣壳蛋白DNA而非mRNA筛选获得的AAV很可能不具备有效的特异性组织或细胞转导能力。
2.3 化学修饰 外源性多肽或蛋白质插入通常受到AAV衣壳蛋白插入位点和容量的限制,也常导致AAV衣壳蛋白无法正确组装,因此限制了合理设计策略在AAV衣壳靶向性修饰中的应用。为解决上述问题,研究者新近开发了基于化学修饰的AAV衣壳靶向性修饰策略,该策略同样基于合理设计,但可通过对AAV衣壳蛋白进行化学修饰,使其能结合靶细胞特异性受体的配体分子或抗体,从而使AAV具备细胞靶向性,由此实现配-受体或抗体介导的AAV靶向转导。
亮氨酸拉链结构域之间可特异性、高亲和力地相互作用形成卷曲螺旋对,Thadani等[30]利用这一特性,将C端融合肠激酶切割基序的亮氨酸拉链卷曲螺旋结合基序插入AAV9衣壳蛋白G453位点之后,制备亮氨酸拉链卷曲螺旋结合基序修饰衣壳的AAV9病毒。具备该衣壳蛋白的AAV9经肠激酶处理后,表面展示线性化的亮氨酸拉链卷曲螺旋结合基序,该AAV9可与互补亮氨酸拉链卷曲螺旋结合基序融合的靶细胞配体分子特异性结合,实现配-受体介导的靶向细胞转导。
DNA-蛋白质相互作用也可用于AAV靶向性修饰。如蛋白标签HUH能与特定序列单链DNA(5’-CCA GTT TCT CGA AGA GAA ACC GGT AAG TGC ACC CTC CCT GAT GA - AmMO-3’)形成共价键结合。Zdechlik等[31]将分子量21 kU的HUH-tag引入AAV-DJ衣壳的可变区IV,制备衣壳表面携带HUH的AAV-DJ。由于此AAV-DJ可通过其HUH标签与单链DNA共价修饰的任何抗体结合,从而成为了一种“通用型”靶向AAV。
上述两种方案尽管提供了制备“通用型”靶向修饰AAV的方法,但仍需要对衣壳蛋白进行基因重组,有可能导致AAV组装问题。去唾液酸糖蛋白受体 (asialoglycoprotein receptor,ASGP-R)在肝细胞表面高表达,可特异性识别、结合N-乙酰半乳糖胺。Mével等[32]直接对AAV2衣壳蛋白赖氨酸残基的氨基基团进行N-乙酰半乳糖胺修饰,使AAV2获得ASGP-R介导的靶向肝细胞转导能力。
3 结语和展望
目前多个临床试验证明AAV作为治疗性基因递送载体具有显著的优势和良好的应用前景[33]。但AAV载体的临床应用仍然存在以下问题亟待解决:1) AAV衣壳的固有免疫原性可激活宿主免疫反应,影响基因治疗的安全性,导致无法重复给药,从而影响基因治疗的有效性[34-35];2)AAV载体缺乏靶向性,阻碍体内基因治疗递送和细胞转导效率;3)AAV载体具有潜在的宿主基因组整合能力[36]。同时,对于AAV转导宿主细胞的生物学全过程尚未完全阐明,特别是需要进一步鉴定介导AAV黏附、进入不同宿主细胞的受体分子,研究AAV衣壳蛋白激发宿主免疫反应的过程。“机器学习”无需物理建模可直接基于实验数据进行训练、获得工程蛋白质的全部潜在多样性序列组成。2021年,Bryant等[37]通过机器学习模拟单个氨基酸随机突变,设计了多达5万多个的有功能的野生型AAV2衣壳蛋白变体。同年,Hie等[38]运用新的“机器学习”算法处理宿主体内流感病毒血凝素、HIV-1包膜糖蛋白和新型冠状病毒的高通量测序数据,鉴定了能够保护病毒逃逸免疫系统识别,同时保留其感染性的突变。这些新近研究提示,利用已发现的天然AAV衣壳蛋白编码序列、衣壳蛋白翻译后修饰和衣壳蛋白免疫原性位点的信息,通过“机器学习”有望预测AAV衣壳蛋白的免疫逃逸突变,以此有效优化衣壳序列以改善AAV转导效率并降低其免疫原性。同样的,将病毒组装前后的AAV衣壳文库编码序列数据用于“机器学习”算法有望预测病毒衣壳组装,从而对衣壳蛋白文库设计进行改进[39]。
综上所述,AAV衣壳是激发宿主免疫反应的主要免疫原,同时决定AAV组织嗜性和细胞转导的靶向性,因此衣壳蛋白修饰是当前AAV载体研究的重点。多种AAV衣壳蛋白修饰的研究策略结合“机器学习”,有望筛选出能够重复给药并具备靶向性和高转导能力的AAV载体,进一步促进基因治疗的临床应用。

