电催化还原CO2生成多种产物催化剂研究进展
郑元波,张前,石坚,李佳霖,梅苏宁,余秦伟,杨建明,吕剑
(西安近代化学研究所,氟氮化工资源高效开发与利用国家重点实验室,陕西 西安 710065)
工业革命以来,煤炭、石油、天然气等化石燃料成为人类最主要的能源物质。化石燃料所产生的能源推动了社会生产力的快速发展,使得人类的科技水平、生活水平快速提升。然而,化石燃料的过度开采不仅破坏了大自然的生态平衡,同时释放过量的CO导致温室效应、海平面上升、海水酸化、局部地区气候异常,给人类的生存带来了极大的威胁和挑战。
将大气中的CO转化为高热值的可利用再生能源能有效解决能源短缺及CO含量过高的问题,近年来,电化学还原CO技术引起研究人员的广泛关注,这种技术依靠可再生能源来获取电能,将CO转化为容易储存的化学品以及工业原料,减轻了人类对传统化石燃料的依赖;并且促进了CO的回收,遏制了CO的排放,能有效缓解过量CO排放导致的温室效应问题。
电催化还原CO反应是通过电化学的方式将CO还原为化学品及燃料(如CO、甲酸、甲烷、乙烯、乙醇、丙醇等)的过程,一般由工作电极、对电极以及参比电极三电极体系构成;还包括离子交换膜,用于分离阴阳两极室,避免电催化还原CO产物再氧化。依据体系电解液,电催化还原CO可以分为水溶液体系、有机电解液体系、离子液体体系三类。但由于有机电解液对环境的危害较大以及离子液体的价格昂贵,从而电催化还原CO的研究重心大多数都放在水溶液体系。在此体系中,通常选用廉价的无机盐溶液(NaHCO、KHCO及NaSO等)作为电解质,能够提供活化的质子,打破C==O键,免除了H原料。
1 电催化还原CO2基本原理
近年来,电催化还原CO快速发展,越发成熟,已被认为是一种有很大发展前途以及符合可持续发展理念的CO转化技术。图1 为电催化还原CO双腔反应器,阳极(对电极)和阴极(工作电极)分别位于两腔室中,阳极发生析氧反应,阴极为CO还原反应;两腔室用质子交换膜(隔膜)分离,为了防止阳极产生的氧气进入阴极腔室内氧化CO还原产物以及阴极CO还原产物进入阳极腔室内。普通阳极还原系统需要外界的电能来促进电子在外电路的传输,为了减少甚至消除外界施加的电能,一般通过可再生能源转化为电催化还原CO系统所需的电能;光阳极和生物阳极是改进后的阳极,光阳极利用光能转化为电能,生物阳极通过捕获废弃物种的化学能转化为电能。
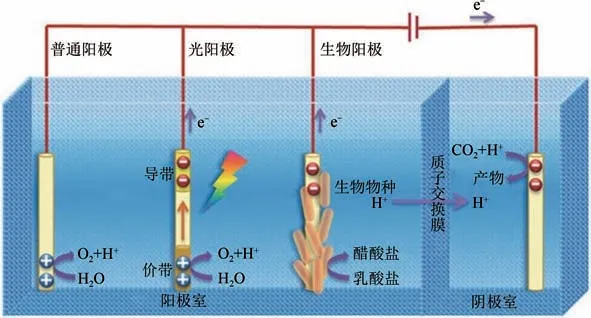
图1 电催化还原CO2示意图[8]
电催化还原CO是一个复杂的过程,通常发生涉及2~18 个不同电子转移的反应,根据电子转移数的不同,生成的产物一般有CO、CHOH、HCHO、CH、HCOOH、CH、CHOH、CHCOOH、丙醇等。表1为不同还原产物对应的化学方程式及其还原电位[相对于标准氢电极(SHE),pH=0、101.325kPa、25℃的水溶液]。此外,析氢反应作为两电子反应过程,是电催化还原CO的竞争反应。

表1 不同还原产物的化学方程式及标准电势
2 电催化还原CO2反应途径
电催化还原CO的第一步是激活CO分子。因为负的氧化还原电位和稳定的分子结构,使CO分子得到一个电子变成活化的二氧化碳自由基中间体非常困难。但引入催化剂后,通过表面原子的相互作用,催化剂对CO分子通过化学键化学吸附,使得活化CO得到CO反应中间体相对容易很多。催化剂表面吸附的CO存在3 种可能的配位方式:①如图2(a)所示,CO分子的氧原子有孤立电子对,可以与表面路易斯酸中心相互作用;②如图2(b)所示,CO分子的碳原子可以从路易斯碱中心获得电子,形成类似碳酸盐的物质;③如图2(c)所示,CO分子的碳原子和氧原子同时作为电子受体和给体,形成混合配位。CO分子吸附中间体不再具有线性对称性,随着CO分子弯曲,未占有电子能级最低轨道(LUMO)能级降低,从而CO分子吸附中间体具有较低的接受电子的势垒。第二步是电子或质子迁移,打破碳氧键和形成碳氢键。最后一步是产物重排,从电极表面脱附,扩散到电解液。
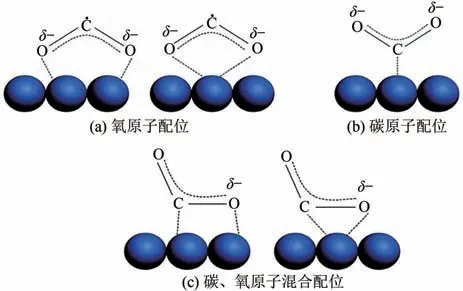
图2 催化剂吸附CO2可能存在的结构形式[13]
3 电催化还原CO2不同产物形成途径及活性催化剂
研究者们从实验和理论两方面探索了电催化还原CO生成C、C、C产物的形成途径,大多数是基于Tafel 斜率或密度泛函理论DFT 计算结果的假设。电催化还原CO是一个比较复杂的过程,目前对于电催化还原CO的催化剂仍是一个挑战,还没有开发出具有足够催化活性和稳定性的催化剂,距离大规模产业化仍然有比较大的差距。电催化还原CO的催化材料可以分为金属材料和非金属材料两类,其中金属催化剂最为普遍,尤其是过渡金属催化剂。
3.1 C1产物
C产物一般是二、四、六电子转移的反应,相对来说较为简单,反应机理研究也相对成熟,报道出来的反应路径机理被广泛认可。Jens 教授课题组通过DFT 计算对电催化还原CO进行较为完整的研究,提出了C产物形成过程机理,并且结合原位表征手段,检测催化剂原子结构变化、吸附分子反应成催化中间体变化等,明确了催化反应机理。
3.1.1 甲酸盐和甲酸
电催化还原CO生成甲酸是通过关键中间体COOH 加氢得到,目前得到关键中间体COOH的线路中,图3(a)、(b)最为成熟并且被广泛认可。第一种形成路径是一种中间体通过一个氧原子或两个氧原子与金属结合形成,如图3(a)、(b)顶部路线所示。图3(a)先是催化剂与氢离子作用得到吸附态的氢,随后CO分子插入金属-氢键与吸附态的氢反应形成中间体COOH。图3(b)顶部路线是先得到吸附态的CO,随后与溶液中的氢离子质子化形成中间体COOH。另一种途径是通过二氧化碳自由基与临近的质子通过碳与金属结合形成关键中间体,如图3(b)中部路线所示。研究表明,电解液中若存在HCO,则能够提高甲酸盐的产率,图3(b)底部路线,是通过HCO提供的质子,与碳、金属结合形成的关键中间体作用,得到甲酸盐产物。图3(c)是Bocarsly 等提出的一种表面结合碳酸盐的路线,CO分子与表面羟基之间反应,形成表面结合的碳酸盐中间体,随后经过两个电子和一个质子的转移形成产物。CO分子较为稳定,在生成甲酸过程中,活化CO分子,形成关键中间体COOH是整个反应的速控步骤。
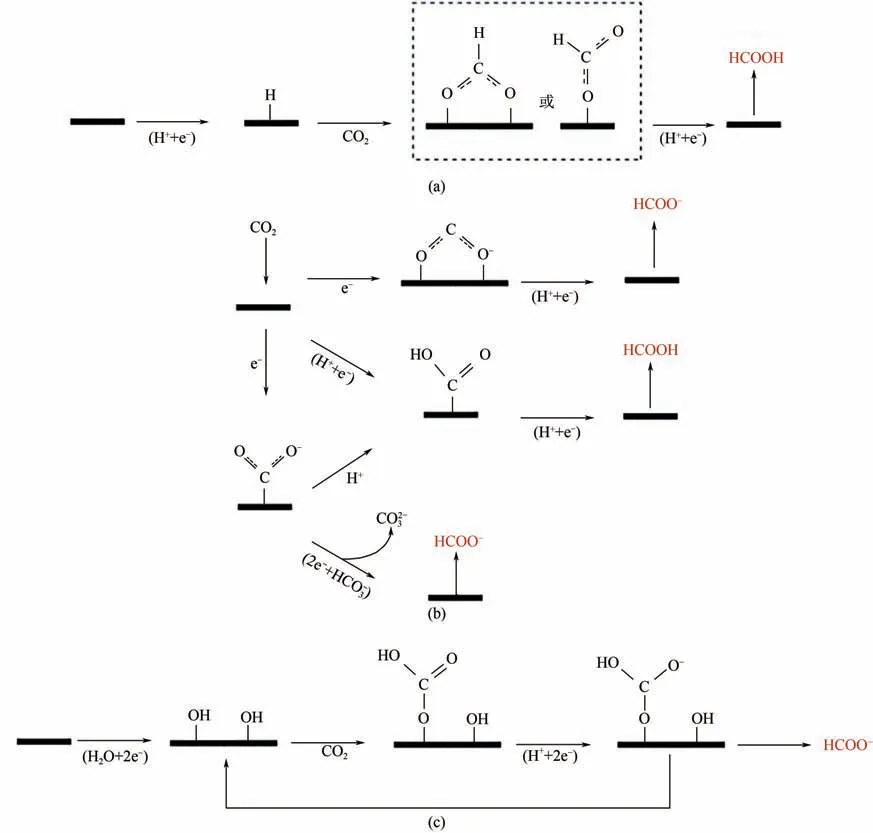
图3 电催化还原CO2生成甲酸盐和甲酸示意图[18]
在反应过程中对关键中间体COOH 有较好选择性的金属催化剂有铅(Pb)、锡(Sn)、铟(In)、铋(Bi)等,产物以甲酸和甲酸盐为主。在电催化还原CO所有产物中,甲酸产物最为简单,反应机理相对成熟,被广泛研究报道。谭勇文课题组利用电化学脱合金的方法制备了高导电性的Bi 金属核和非晶态Sn 掺杂BiO壳的新型Sn 掺杂的Bi/BiO纳米线催化剂,原位拉曼光谱和理论计算表明,Sn的引入能够稳定生成甲酸的关键中间体COOH,抑制竞争性H和CO的产生,在宽的电位范围内,都能表现出对甲酸产物很好的选择性。朱起龙课题组首次组装了一种自支撑的大尺寸三维多孔铋系导电网络,Bi-ene具有丰富的边缘位缺陷,在宽的外加电位下表现出对甲酸盐的高电流密度及稳定性,电流密度高达560mA/cm,连续运行500h 以上,活性无明显衰减,并且原位红外及理论计算进一步揭示了粗糙平面边缘和平面内孔隙边缘的丰富缺陷有利于COOH中间体的稳定。李彦光课题组利用简单的溶液方法制备了表面碎片化的氧化铋双壁纳米管,表面丰富的缺陷铋位点,对生成甲酸有优异的活性、选择性和稳定性,最显著的是,在-0.61V下,其电流密度可达约288mA/cm,并结合DFT 计算,丰富的缺陷铋位点能够稳定COOH中间体,从而表现出优异的活性和选择性。另外Li等利用溶剂热法制备了尺寸均匀的PdBi 合金纳米晶催化剂,PdBi 纳米晶催化剂对中间体COOH有很强的吸附作用,对甲酸盐的选择性超过了90%,对CO 副反应起到很好的抑制作用。张华民团队通过表面修饰法制备了Bi修饰Zn的Bi-Zn双金属纳米结构催化剂,由于金属-金属双功能界面和晶界提供了高密度的活性中心,在-0.8V时,甲酸的法拉第效率达到94%,且通过线性扫描伏安(LSV)测试得出,具有较高的催化活性。夏宝玉团队对In作了研究,提出了一种氨基功能化的铟有机骨架,固定化的氨基增强了CO的吸收和活化,稳定了活性中间体,在-1.1V外加电压下,电流密度为108mA/cm,有效地将CO还原为甲酸。
3.1.2 一氧化碳
电催化还原CO生成CO 是一个双电子转移过程,如图4 所示,先是CO分子与质子反应活化得到COOH,随后质子可攻击COOH 的氧原子(OH)生成吸附的CO,进而脱附生成CO。Monteiro等通过还原产物CO 证明电解质中的正电荷粒子是稳定关键中间体的主要因素,对电解液中金属离子的影响作用的微观原理下了定论,阳离子能与吸附物配位,配位物与CO的静电作用更能稳定CO,促进CO分子活化和催化剂表面电子转移。生成CO反应过程中,除活化CO分子是一个限制反应的重要因素外,COOH 相较于CO 具有更弱的吸附能力,且受到尺度关系的限制,COOH 中间体加氢形成CO中间体的过程也是一个重要速控步骤。
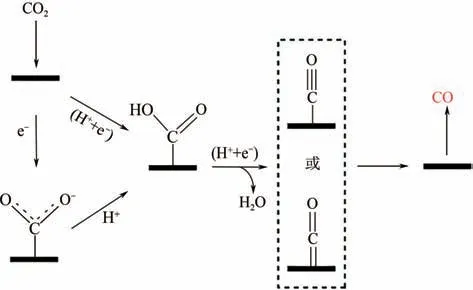
图4 电催化还原CO2生成CO示意图[18]
反应过程中,催化剂能够选择性生成COOH,并且对CO 吸附稳定性较弱,此类催化剂中有金(Au)、银(Ag)、锌(Zn)等金属催化剂,有利于产物CO 的生成。Au 位于CO 演化动力火山图顶部附近,在CO转化为CO 方面具有较高的固有活性,被广泛研究。Sun 等利用种子介导生长的方法合成了超薄的2nm Au 纳米线,-0.35V 电位下,法拉第效率达到94%,并且保持6h,活性无任何变化,并且DFT 计算表明,Au 纳米线的优异催化性能归因于其活性边缘位点的高质量密度和CO 在这些位点上的弱结合,这些超薄金纳米材料是目前报道的最有效的电化学还原CO为CO 的纳米催化剂。杨军团队利用两步骤还原法精确合成了紧密堆积结构的金纳米团簇,通过透射电镜表征,团簇大小为1.5nm,通过电化学工作站测试的LSV 曲线及法拉第效率曲线,得到合成的纳米团簇具有较高的活性,且在-0.57V 电位下,法拉第效率高达96%,高选择性生成CO。Gao 等制备了Au-CeO结构,原位扫描隧道显微镜和同步辐射光谱研究表明,Au-CeO界面在增强CO吸附和活化方面起主导作用,DFT 计算表明,Au-CeO界面是CO活化和还原为CO的活性位点,Au和CeO之间的协同作用促进了关键羧基中间体(COOH)的稳定性,从而促进了进一步反应生成CO。除Au 外,Ag 也是被广泛探索的将CO转化为CO 的高本征选择性电化学金属催化剂,盐酸溶液两步脱合金法制备的纳米多孔银具有大的表面积和弯曲的内表面,在-0.6V 电位下,对CO 选择性高达92%。除上述金属催化剂外,非金属催化剂也有报道,吴长征团队报道了氮掺杂的石墨烯基催化剂,形成的孤立过渡金属类环烷基是主要的活性位点,有利于CO 的生成。Kumar 等报道了利用聚苯胺碳化合成碳纳米纤维,能够将CO还原为CO,其优异的性能归功于纳米纤维的纳米结构和关键中间体与碳纳米纤维表面的高结合能,这一发现可能导致新一代的无金属和非贵金属催化剂,其效率远高于现有的贵金属催化剂。
3.1.3 甲醛、甲醇和甲烷
吸附态的CO 是生成甲醛、甲醇和甲烷的中间体,具体的途径如图5 所示。图5(a)在得到吸附态的CO 后,先进行加氢反应得到CHO,再一步加氢,得到CHO(脱附生成甲醛),三次加氢得到吸附态的甲氧基(OCH),最后一步加氢还原脱附生成甲醇或甲烷产物。图5(b)是另外一种生成CH的可能途径,因为从动力学来看,C—O 键的解离和形成C—H 键生成CH的能量势垒远高于生成甲醇的能量势垒,该步骤先经过两步加氢还原反应从CO 得到吸附态的碳,再一步一步还原为CH、CH、CH,最后还原生成为CH。在该反应过程中,CO 加氢形成CHO 具有最高的结合能变,是反应的速率控制步骤,原因在于CO比CHO中间体在电极表面具有更强的结合能力。除DFT 计算及原位表征外,生成甲醇、甲烷产物,同位素标记也是确定反应中间体及反应机理的重要手段。

图5 电催化还原CO2生成甲醛、甲醇和甲烷示意图[18]
生成这些产物的催化剂对CO 有较强的吸附能力,在得到吸附态的CO 时,不容易脱去生成的CO,而是进一步加氢还原,得到甲醛、甲醇或甲烷。研究表明,Cu 在催化反应过程中可以吸附和转化中间体CO,在不同的条件下可以产生多种不同的电催化还原CO产物,产物以甲烷为主。除金属铜外,金属氧化物CuO 和金属Mo是良好的催化生成甲醇催化剂。Manthiram 等发现,在玻璃碳载体上分散良好的Cu 微球的甲烷化电流密度是高纯铜箔电极的4倍,形成CH的平均法拉第效率为80%。黄昱团队用电偶取代法合成了具有丰富Cu-Ag 界面的双金属Cu-Ag 纳米线,首先合成Cu 纳米线,然后通过从Cu 到Ag 的电流置换来实现Cu-Ag的原位合成,构建了具有丰富Cu-Ag界面的纳米线,原子级的Cu-Ag 界面是提高甲烷的选择性和降低过电位的有效方法。Ye 等制备出Cu掺杂的MoSe催化剂,生成CH具有较低的过电位,表现出优异的性能,并且利用DFT 对结构优化和电子结构性质进行了计算,研究结果有助于全面理解CO还原和CH选择性对电子性能的影响,为进一步在原子水平上设计CO还原反应催化剂提供了重要指导。韩布兴课题组首次报道了在缺陷CuO上构建原子分散的Sn催化剂,电还原CO得到甲醇的法拉第效率可达88.6%,是目前报道的最大法拉第效率,电流密度达68mA/cm,是迄今为止报道的活性最大的生成甲醇催化剂,Sn原子位置、相邻氧空位和CuO载体配合良好,导致CO吸附容量更大,界面电荷转移电阻更低,并且实验结果和DFT 计算表明,该催化剂通过降低COOH 解离生成CO 的能垒,有利于CO的活化,得到的关键中间体CO与Cu结合进一步还原,导致对甲醇的高选择性。郑南峰团队设计了一个二维层次Pd/SnO结构,部分由SnO纳米颗粒包覆的超薄Pd 纳米片,可以实现多电子转移,选择性还原CO成CHOH,这种结构设计不仅增强了CO在SnO上的吸附,而且由于Pd-O-Sn界面的构建,减弱了CO在Pd上的结合强度,这对提高Pd 催化剂的电催化选择性和稳定性至关重要。
3.2 C2产物
C产物的形成是一个复杂的过程,可能包含多种途径,这些仍是科研工作者探讨和争论的焦点,通过理论计算、原位表征、同位素标记及氢原子追踪等方法确定了最合理的反应中间体及机理,图6、图7是较为成熟和被大多数科研工作者认可的途径。

图6 电催化还原CO2生成乙醛、乙烯和乙醇示意图[18]
3.2.1 乙醛、乙烯和乙醇
吸附态CO 的形成是进一步还原为C产物的起点,经过关键的C—C 耦合作用,生成C产物。如图6(a),先是四电子还原脱水生成CH,随后可能是两个CH耦合;或者CO 插入,经过电子还原脱水生成乙烯,这也是生成乙醇的途径。CO 插入CH,经过还原可以生成乙醛和OCHCH中间体,OCHCH中间体进一步还原生成乙醇。图6(b)是另外一种途径,是通过CO共二聚与电子转移形成CO关键中间体,随后质子化成CO-COH,随后通过还原生成乙烯、乙醛和乙醇产物。
3.2.2 乙酸盐和乙酸乙酸盐或乙酸的形成归因于被吸附的CO-对还原产物CH的亲核攻击,CH的形成是通过吸附态的CO 还原而来,如图7 所示。CO 先加氢得到CHO,再加氢得到CHO,再加氢还原脱水得到CH,最后再与被吸附的CO-反应,生成乙酸盐或乙酸。
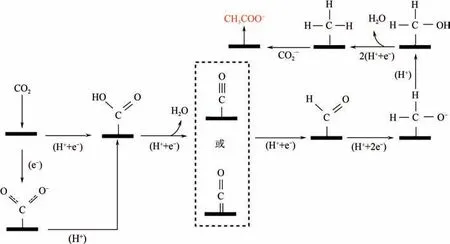
图7 电催化还原CO2生成乙酸盐和乙酸示意图[18]
C产物过程不仅经过CO分子的活化,还有关键中间体CO 的形成,与C—C 耦合过程共同构成了该反应的速控步骤,C—C 耦合过程是生成C产物的关键。CO 是先决中间体,只有CO 的稳定生成,才会进行下一步的C—C耦合,最终生成乙烯、乙醇等产物。
由于C产物的复杂性,被报道的催化剂以Cu基为主,金属Ag也有少量报道。Wu等制备了不同Ag壳层厚度的Cu@Ag核壳纳米粒子,通过在Ag壳层上生成CO,进而在Cu 核上实现C—C 耦合,对C产物的法拉第效率高达67.6%,适当厚度的Ag层能有效地产生并提高Cu 核上的局部CO 浓度,有助于提高对C产物的选择性,并且电化学测试和CO 吸附容量分析证实,Cu@Ag 催化剂在Cu/Ag界面上具有更强的CO 结合强度、更多的活性位点和更快的电荷转移。Schuhmann等合成了以Cu基金属有机框架材料(MOF)为自牺牲模板的新型纳米结构CuOC电催化剂,利用聚四氟乙烯修饰纳米电极,进行了局部活性测定,结果表明,该催化剂抑制了竞争性析氢反应,且对C产物的法拉第效率高达54%。Koper 等通过DFT 计算模拟结果发现Ag 有助于电催化反应生成乙醇。Yang 课题组提出了氯掺杂的多孔Cu 电催化剂,不仅C产物法拉第效率达到53.8%,而且很大程度提高了Cu基催化剂的寿命,在240h 都能表现出优异的催化稳定性,实验结果表明,在电化学CO还原过程中,氯诱导活性位点丰富的结构是C+高选择性的关键。Zhu 等通过电沉积铜络合物原位还原制备了3D树枝状铜-氧化亚铜复合材料,这种结构充分暴露了活性位点,并且中间产物停留时间长,有助于多碳产物的生成,结果表明,C产物的法拉第效率高达80%,电流密度为11.5mA/cm,乙酸和乙醇的过电位仅分别为0.53V 和0.48V,具有优异的催化性能。Wang 等合理调整氮掺杂纳米金刚石和铜纳米颗粒的组装,在外加电位仅为-0.5V 情况下,法拉第效率达到63%,且催化剂表现出前所未有的持续催化性能,达120h,电流稳定,活性仅下降19%,同时,DFT 计算表明,CO 在铜/纳米金刚石界面的结合增强,抑制CO的解吸,促进C的生成。除金属或金属氧化物催化剂外,非金属催化剂也被少量报道用于电催化还原CO生成C产物。
3.3 C3产物
迄今为止,电催化还原CO生成长碳链产物(如C产物)仍然是一个挑战,生成C产物的仅有正丙醇、2-丙醇和丙酮。图8为生成正丙醇的可能途径,是通过吸附的C中间体与C中间体进行分子间的C—C耦合,再通过质子/电子转移,还原生成正丙醇。
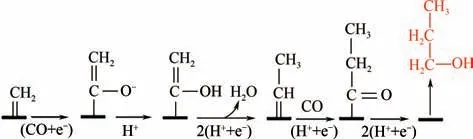
图8 电催化还原CO2生成正丙醇示意图[18]
目前,生成C产物的催化剂有石墨烯/氧化锌/氧化亚铜,法拉第效率最大达到30%。Munir 等利用电沉积法制备了Cu-ZnO 催化剂,Cu-Zn 界面能快速促进C—C—C 耦合,高活性生成C产物;利用X 射线光电子能谱、拉曼光谱等进行元素分析,并通过活性测试提出了新的反应途径,如图9所示。CO分子得到3e和3H形成CHO,然后CHO 与C物质耦合形成吸附的C中间体,C中间体可通过左侧途径脱水加氢还原为正丙醇,也可通过右侧途径生成丙酮。生成2-丙醇的途径,先是C中间体加氢使得吸附碳原子脱附,生成以氧原子为吸附中心的吸附C中间体,最后脱去边缘羟基还原生成2-丙醇。
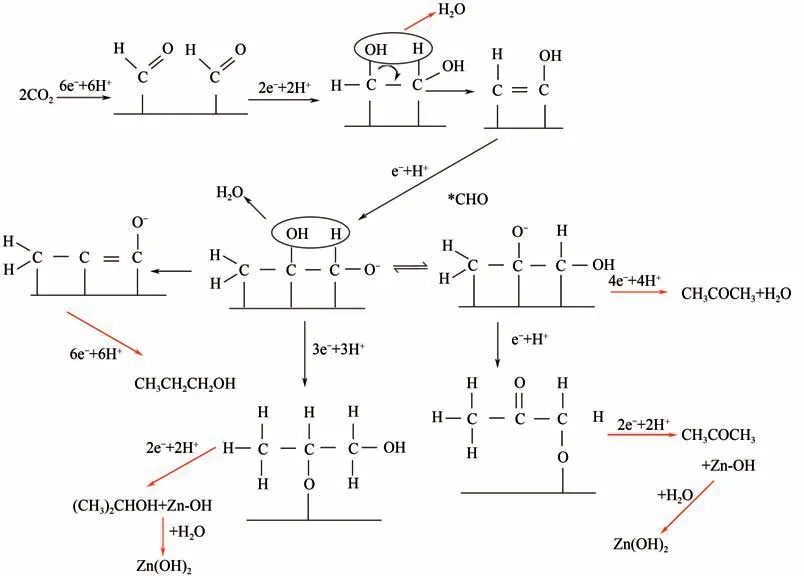
图9 Cu-ZnO电极还原CO2生成正丙醇、丙酮和2-丙醇示意图[55]
C产物更为复杂,反应经过多个决速步骤,需通过DFT 计算、原位表征(原位拉曼、原位红外等)、同位素标记等手段,并结合电化学测试确定可能的反应中间体及机理;反应过程CO分子活化、CO的形成、C—C耦合、C中间体与C中间体的耦合等都是速控步骤,所以生成C产物的电流密度及法拉第效率较低,催化剂的活性和选择性较低。
4 电催化还原CO2研究概况
目前电催化还原CO催化剂的稳定性和催化活性没能得到有效解决,并且稳定性和催化活性较好的催化剂价格昂贵,很难大规模产业化应用。电催化还原CO有以下两个较为突出的问题急需解决。
(1)生成C产物的低反应电流密度、析氢反应的竞争以及催化生成甲醇和甲烷选择性问题。国内外对电催化还原CO生成甲酸及甲酸盐产物催化剂研究较为成熟,制备出了活性及选择性较高的锡(Sn)、铋(Bi)等催化剂,在较低的外加电位下,活性较高,且对甲酸盐的选择性达到90%以上。对于C其他产物,都是通过吸附CO中间体转化而来,通过图10电催化活性金属对CO及氢原子的吸附能,能够得出金(Au)、银(Ag)、锌(Zn)对CO的吸附能力较弱,CO容易从催化剂表面脱附,产物以CO 为主,目前研究制备出的金(Au)、银(Ag)等催化剂,对CO 的选择性超90%,并且在CO 生成外加电压下,电流密度较高。而Pb、Ti、In 等对CO 有较强的吸附能力,反应过程中会进一步加氢还原,得到甲醛、甲醇或甲烷。该过程相对复杂,目前被报道的催化剂选择性较低,仅能达60%~80%。
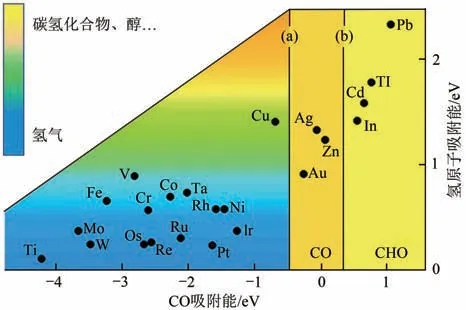
图10 金属电催化活性吸附能力图[57]
综合国内外报道的生成C产物催化剂,目前所能达到的法拉第效率如图11 所示。在众多还原产物中,CO、HCOOH 等C产物的研究较为成熟,在低过电位下的法拉第电流效率得到了很好的成果,但是反应的电流密度很低,很难达到预期效果。如增大电催化电流,在高的电流密度下,电极表面的CO会迅速消耗而得不到及时补充,这时竞争反应析氢反应的效率会显著提高,使得产物大部分为氢气,即降低析氢副反应效率,提高催化剂活性是研究重点。此外,对于甲醇和甲烷产物,形成过程相对复杂,反应过程法拉第效率较低,因此提高催化剂选择性,即提高电催化生成甲醇和甲烷的法拉第效率也是研究难点。
(2)还原生成C及C产物的效率低及反应机理不明确问题。催化剂的选择性以及催化剂促进C—C 耦合问题,都使得C及C产物形成效率处于较低的水平。Cu 催化剂是生成多碳产物的活性中心,因其反应过程的复杂性,C产物催化选择性仅达50%,而C产物选择性更是低于30%,如图11所示。提高生成多碳产物催化剂的选择性,增大法拉第效率是研究重点,探明反应机理,促进C—C耦合都是急需突破的问题。
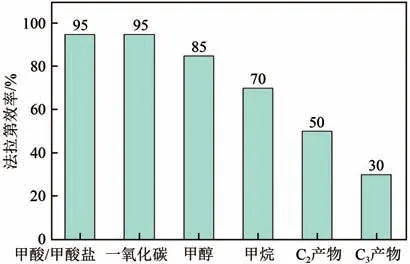
图11 电催化还原CO2生成不同产物法拉第效率
5 电催化还原CO2催化剂改性方法
电催化还原CO生成C、C、C产物形成途径中,除固有的单金属催化剂外,为了提高催化剂催化活性、转化率及选择性,近几年对于催化剂的改性被广泛报道。不难发现,对于催化剂的改性主要有纳米结构材料、负载型催化剂、杂原子掺杂、合金化、引入缺陷几种方法。
反应物和反应中间体的吸附行为对催化剂的选择性起着至关重要的作用,不同的改性方法会导致电子转移途径或速率发生改变,从而会导致产物的多样性。目前,大多数吸附构型的调控都是通过特殊结构设计,优化催化剂的电子结构,降低反应中间体的形成势垒来实现,上述的不同改性方法导致电子转移途径改变,从而导致产物的多样性,所以合适的改性方法能够避免副产物的过度产生,高选择性地制备目标产物。
并且基于上述提到的电催化还原CO存在的问题,对于催化剂的改性来提高电催化还原CO的催化活性也是当前研究的重中之重。目前有两种通用的方法来提高电催化剂的催化活性:①增加活性位点的数量。通过改进催化剂结构,暴露更多的活性位点;②提高每个活性位点的固有活性。为了达到催化剂最大催化活性,可以同时在这两方面对催化剂改性,因为这两种方法可以协同作用,不会相互排斥。制备纳米结构或负载型催化剂材料可以大大增加活性位点的数量,而杂原子掺杂、合金化、缺陷的引入可以进一步提高每个活性位点的固有属性。
5.1 纳米结构
纳米结构的催化剂具有更多的活性位点,如边缘、台阶、角落等位置,此外具有大的活性比表面积,因此能表现出良好的催化活性。首先,不同尺寸的纳米结构电催化剂具有不同的催化活性和产物选择性,这被称为催化粒径效应。图12 为不同铜纳米尺寸还原过程的活性及选择性,随着粒径减小,电流密度逐渐增大,即催化活性逐渐增加;粒径较小,因其具有均匀的表面,有利于H、CO的脱附,选择性生成H和CO,而随着粒径增加,有利于中间体加氢反应发生,即选择性生成甲烷、乙烯等碳氢产物。

图12 不同粒径的铜纳米粒子还原过程电流密度及法拉第效率[59]
究其原因,较小的Cu纳米粒子直接影响角落、边缘和表面的原子比例,增加了低配位的活性位点及电子传输速率,从而会引起催化剂的催化活性和选择性,有利于CO 等的生成。大颗粒的结构具有粗糙的表面和孔/通道,这有利于电解过程中的电子传递和能量传递,还能使还原的中间体在孔/通道结构内进一步还原,生成碳氢产物,这种效应同样在Au、Ag、Zn 等纳米材料中存在。其次,对于电催化还原CO催化剂的改性可以通过制备不同形态的纳米结构材料,这一方法是通过调整晶面、原子配位数对催化剂进行改性。同样以Cu为例,探究Cu纳米晶体选择性-形貌的关系,3种晶形的铜被广泛研究。立方铜主要暴露(100)晶面,倾向于将CO还原为乙烯;主要暴露(111)晶面的八面体铜,主要将CO还原为CO 和CH;而暴露(100)和(111)晶面的六方体铜有利于乙醇的生成,因为其存在大量的边缘,这些边缘可以调节吸附态氧原子的结合能,有利于将CO还原生成乙醇的过程。不同纳米尺寸和晶型的晶体结构电子转移途径会发生改变,从而影响关键中间体的吸附,如小于5nm 的Cu 有利于CO 生成,大于25nm 的Cu 纳米粒子更有利于生成甲烷、乙烯等产物,表现出不同的活性和选择性。
5.2 负载型催化
催化剂的载体对于催化剂性能影响也至关重要,载体一般起到增加材料的比表面积、导电性和稳定性以及防止材料的聚集、保持材料性能的作用。目前被广泛研究的载体有碳纳米管、SiO、AlO、分子筛、TiO等,这些载体不仅能够防止催化剂在催化过程中聚集,而且与催化剂存在化学偶联的作用,能够改变催化剂表面电子结构,影响电子转移途径,使催化剂的催化活性增强,并且提高了催化选择性。以TiO载体为例,Ma 等制备了Ag 负载在TiO载体上的负载型催化剂,具体过程如图13所示。
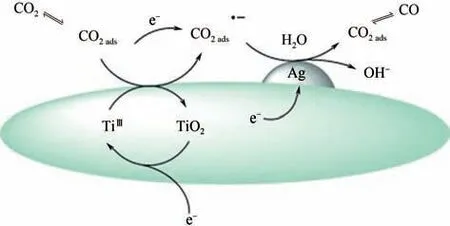
图13 Ag/TiO2催化剂上CO2还原为CO途径示意图[65]
CO首先被吸附在TiO上,在较低的电位下,吸附的CO从电极上获得一个电子(TiO氧化还原电子)形成活化的CO中间体,随后CO从电极获得一个电子(Ag 颗粒或载体TiO电子)生成Ag 吸附的CO,最终脱附生成目标产物CO;TiO是Ag纳米颗粒的优越载体,不仅有助于Ag 纳米粒子的分散,而且还稳定了还原性中间体,并作为氧化还原电子载体促进CO还原。Cu负载在NC薄层,NC层不会导致Cu 的电子结构变化,但是能够选择性的通过N-CO相互作用对CO进行富集和活化,提高Cu的催化活性。Ye等以MoSe为载体制备出Cu掺杂的MoSe催化剂,生成CH具有较低的过电位,表现出优异的性能,MoSe具有很好的活化CO作用,这是由于MoSe容易向CO转移电荷造成的。负载型催化剂已成为一种普遍改性催化剂的方法,除被广泛报道的载体外,新型载体SiO-TiO、MgO-SiO也逐渐进入研究者们的视野中,Cu 负载的这两种新型载体都有很好的催化效果。负载型催化剂除增加材料的比表面积、稳定性等外,最主要的作用可能会提供电子,用于活化CO或者参与反应,促进中间体的生成和脱附,有利于催化剂的催化活性和提高选择性。
5.3 杂原子掺杂
杂原子掺杂能够改性催化剂的表面电子结构,或者掺杂的原子对某一关键中间体选择性较好,从而提高电催化还原CO的催化活性。杂原子掺杂有金属原子掺杂和非金属原子掺杂两种掺杂方式。实验和理论计算表明,金属原子掺杂的催化剂能降低反应中间体的形成势垒,是因为其特定的电子结构和低配位。金属原子掺杂主要是用于制备非均相单原子催化剂,并以碳基为载体,该结构是通过孤立分布的金属与碳原子配位,降低反应中间体的形成势垒,促进电子转移,提高电催化还原CO的催化活性。除碳基载体外,谭勇文课题组制备的高导电性的Bi 金属核和非晶态Sn 掺杂BiO壳的新型Sn 掺杂的Bi/BiO纳米线催化剂,促进电子转移,活性较高,并且表现出对甲酸产物很好的选择性。非金属原子掺杂也已被广泛研究,B、N、F、P、S等非金属原子已被成功的掺杂在石墨烯、碳纳米管等碳纳米材料中,该结构能够诱导缺陷形成,因为碳原子和掺杂原子之间的电负性差异,破坏了原始的网络结构。缺陷能够提供更多的活性位点,并且会改变电子转移途径,进一步提高了催化活性。Xu等在MoS单分子层中引入Se原子导致Mo原子周围的电子结构改变,使CO 产物的电导率和选择性大大提高,远远优于MoS单分子层。杂原子掺杂会对催化剂的电子结构产生影响,提高活性位点电子密度,促进电子传输速率,并且降低中间体的形成势垒,极大提高了催化剂活性和选择性。
5.4 合金化
合金材料因为不仅能提供反应中间体的多个结合活性位点,而且有随机可变的组分,所以合金材料是电催化还原CO极具吸引力的材料,图14为单金属和不同合金的催化选择性结果。
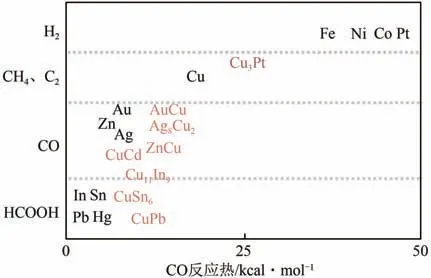
图14 金属和合金催化选择产物[71]
与单独的元素相比,合金材料能够显示出出色的活性和选择性,可以通过调控不同元素的合金,利用金属的不同催化作用及金属界面的电子转移途径,制备出高活性及高选择性的合金催化剂。Lim 等制备了不同Ag 壳层厚度的Cu@Ag 核壳纳米粒子,利用Cu 和Ag 对不同中间体的吸附作用,通过在Ag壳层上生成CO,进而在Cu核上实现C—C耦合,提高了C产物的法拉第效率。合金的形成可能改变了与d中心理论相关的常规电子结构以及金属活性位点的几何和整体效应,有助于打破这些关键中间体的固有关系,从而改变选择性。He 等研究了In与第二种金属(Fe、Co、Ni、Cu、Zn等)的二元合金。因为In与H或CO的结合较弱,而第二种金属与CO 结合能力较强,因此可以改变两种金属的比例来选择性地生成产物。与单一金属相比,铟合金不仅抑制了副反应氢气产物的生成,而且提高了对CO 的选择性,展现出良好的催化活性。合金化也会引起应变效应,改变金属的价带结构,从而改善催化剂的催化活性和选择性。例如,在Cu表面原子中合金化少量Ag引起的压缩应变效应极大地影响了Cu(100)的选择性,更倾向于产生多碳氧化合物。合金化的金属界面通常具有高的电子密度,并参与反应形成关键的吸附中间体,高活性和选择性地制备目标产物。
5.5 引入缺陷
催化剂引入缺陷可以调节表面电子结构,并且缺陷部位通常被认为是电催化反应的活性位点,从而改善催化剂电催化性能。电催化还原CO催化剂引入缺陷的方法通常有浸出、等离子体处理、杂原子掺杂和电化学还原等。例如,通过从Au-Fe合金表面浸出Fe 原子,引入了许多缺陷,能降低关键中间体COOH 的形成势垒,有效地增强了催化剂的活性和稳定性。等离子体处理可以增加催化剂表面粗糙度并在处理后的基体上产生缺陷,即使在室温下也能迅速改变表面的化学状态。例如,经过等离子体处理的Ag 箔和Cu 箔表现出比原始的Ag 箔和Cu 箔更好的电催化还原CO活性。周勇团队通过简单的探针超声剥离相应的大块晶体,然后在HO刻蚀下,引入了空位缺陷,提高了CO吸附和C—C 耦合能力,结果表明,催化剂表面粗糙度对催化剂的催化性能起部分决定作用,而铜的存在则是降低起始电位和提高乙烯选择性的关键。缺陷的引入使得相邻原子的化学状态发生改变,电子密度受到影响,并且缺陷位点作为活性中心,电子传输相对容易,从而发生高活性催化反应。
6 结语
当今世界正面临的能源短缺及过量CO导致的温室效应问题,电催化还原CO生成容易储存的化学品以及工业原料是一种有效方法。但目前电催化还原CO面临几个难题:①CO电催化反应产物生成的关键中间体及具体形成途径仍需要不断探索,技术面临很大挑战;②生成产物种类较多,得到具体某一产物较为困难,产物分离还需要大量配套工艺,对催化剂要求苛刻;③对于将来工业化来说,还有很长一段路要走,最关键的是催化剂还存在活性低、稳定性差、选择性差、价格昂贵等问题。实现大规模产业化能有效解决能源及环境问题,其中最重要的是研究出活性好、价格低廉、制备便捷的催化剂。可通过增加活性位点数量和提高每个活性位点的固有活性两方面改善催化剂。未来对于催化剂的研究可侧重于以下几点:①根据纳米结构高比表面积的特点,着重研究各种纳米结构催化剂;②探究出导电性好、比表面积大、与催化剂适配的支撑基板;③改变催化剂表面电子结构,影响电子转移途径,降低反应中间体的形成势垒,高活性和选择性制备目标产物。

