“乙醇脱水反应制乙烯实验”综述报告
荣俊锋,焦发存,张晔,武成利,王一双,李伏虎,刘铭
(安徽理工大学化学工程学院,安徽 淮南 232001)
乙烯产量是衡量一个国家石油化工工业发展水平的重要标志。乙醇脱水制乙烯是一种不同于传统石油烃类裂解的方法,该反应是一个吸热、分子数增不变的可逆反应。提高反应温度,降低反应压力,都能提高反应转化率。通过“乙醇脱水反应制乙烯实验”的学习,让同学们了解该反应的反应机理,以及气固相管式催化反应器的构造、原理和使用方法;学会动态控制仪表的使用,学习气体在线分析的方法和定性、定量分析。
1 实验目的
(1)学习气固相管式催化反应器的构造、原理和使用方法。
(2)掌握乙醇脱水反应制乙烯实验的反应机理。
(3)学习动态控制仪表的使用,学习气体在线分析的方法和定性、定量分析。
(4)学习气相色谱的原理和构造,掌握色谱的正常使用和分析条件选择。
2 实验原理
乙醇脱水生成乙烯和乙醚,是一个吸热、分子数增不变的可逆反应。提高反应温度,降低反应压力,都能提高反应转化率。ZSM-5 分子筛,因其具有亲油疏水性,在催化脱水性能方面更具优势。图1 为ZSM-5 分子筛催化脱水的反应机理。
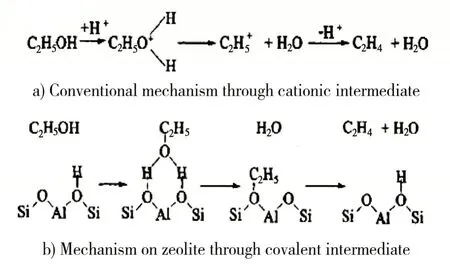
图1 ZSM-5分子筛催化脱水的反应机理
可以看出,乙醇吸附在分子筛上,乙醇羟基上的氧原子和氢原子分别和分子筛上的氢原子和氧原子形成氢键,然后脱去一分子水形成乙醇盐中间体,最后生成乙烯分子,同时分子筛的B酸质子恢复原位。
本实验采用ZSM-5分子筛为催化剂,在固定床反应器中进行乙醇脱水反应研究,反应产物随反应温度的不同,可以生成乙烯和乙醚。温度越高,越容易生成乙烯;温度越低,越容易生成乙醚。实验中,通过改变反应温度和反应进料速度,得到不同反应条件下的实验数据。通过对气体和液体产物进行分析,可以得到反应的最佳工艺条件和动力学方程。一级反应速度方程式:

式中:v0—乙醇的加料速度(毫克分子/分);y—乙醇转化率(%)。
在实验中,由于两个反应生成的产物乙醚和水留在了液体冷凝液中,而气体产物乙烯是挥发气体,进入尾气管排出。
3 实验步骤
(1)在反应器底部放入少量岩棉,然后放入10~20 cm 高的瓷环,准确量取瓷环高度并记录,瓷环应预先在稀盐酸中浸泡,并经水洗、高温烧结,以除去催化活性。
(2)用量筒量取20 mL 催化剂,然后用天平称量出催化剂重量(约30 g),并记录。
(3)将称量好的催化剂,缓慢、全部加入到反应器中,并轻微振动,然后记录催化剂高度,确定催化剂在反应器内装填高度。
(4)在催化剂上方继续加入瓷环,一直到反应管顶部,然后将反应器顶部密封。将反应管放入到加热炉中,连接乙醇和水的进口,拧紧卡套。
(5)按照实验要求,将反应器加热温度设定为150℃~350℃,预热器温度设定为120℃~160℃。
(6)在温度达到并稳定在设定值后,开始加入乙醇,加料速度分别为0.6 mL/min,0.9 mL/min,1.2 mL/min。
(7)反应进行10~20 min 后,正式开始实验。先打开玻璃分离器下的阀门,放出分离器内的液体,然后关闭阀门,同时记录湿式流量计读数,开始实验。应每隔10 min 记录反应温度、炉内温度、预热温度、液体流量、湿式流量计流量等实验条件。
(8)每个流量下反应约30 min 左右,可以由每组学生自己确定。然后放出分离器内的液体,并同时计量湿式流量计读数。用天平对液体产物准确称重,用色谱分析二次含量。
(9)改变乙醇的加料速度为0.9 mL/min,1.2 mL/min,重复上述实验步骤,则得到不同乙醇的加料速度时原料转化率、产物乙烯收率、副产物乙醚生成速率等,并根据动力学模型,得到反应速率常数。
4 实验数据(表1~表11)

表1 乙醇进料速度0.6 mL/min时原始数据表

表2 乙醇进料速度0.9 mL/min时原始数据表

表3 乙醇进料速度1.2 mL/min时原始数据表

表4 标准溶液
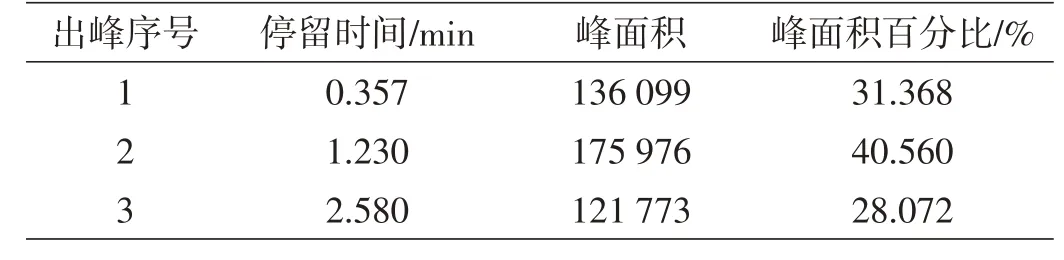
表5 标准溶液数据
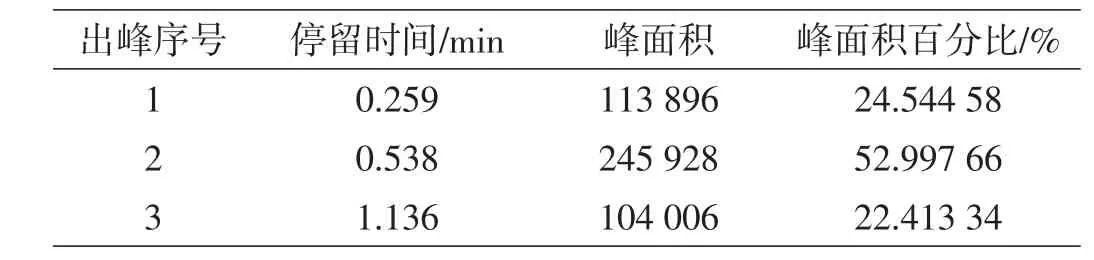
表6 进料0.6 mL/min产品1数据
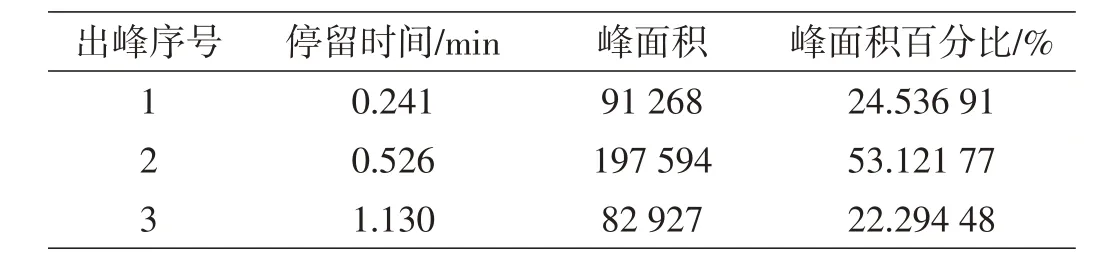
表7 进料0.6 mL/min产品2数据
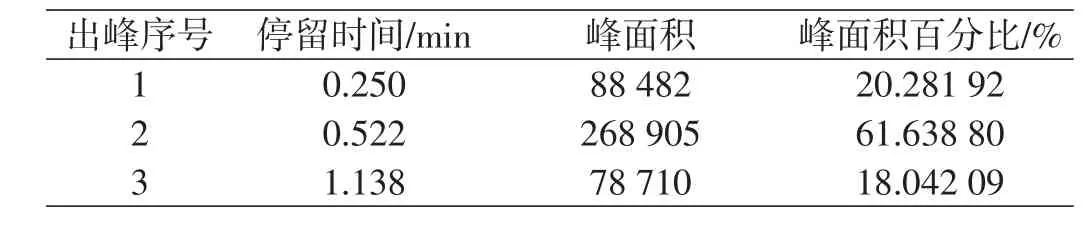
表8 进料0.9 mL/min产品1数据
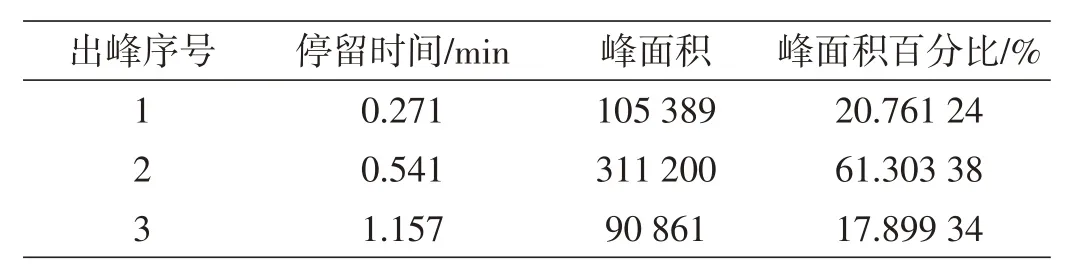
表9 进料0.9 mL/min产品2数据
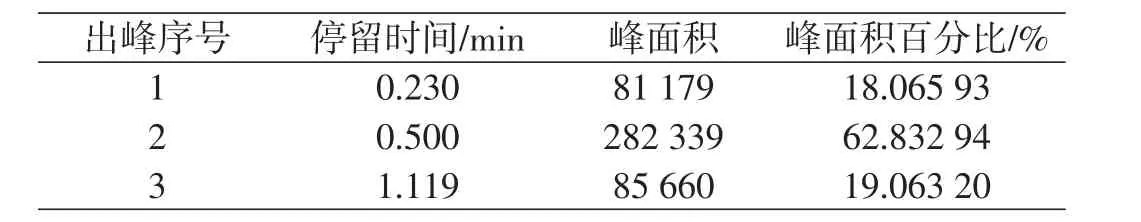
表10 进料1.2 mL/min产品1数据

表11 进料1.2 mL/min产品2数据
5 实验数据处理
在实验中,应每隔一定时间记录反应器和预热器加热温度、催化剂床层温度。如有必要,也可以轻轻拉动反应器内的测温热电偶,测定催化剂床层的温度分布。实验中,每次完成一个流量下的实验时,应记录实验前后产物湿式流量计的体积,同时称量反应时间内得到的液体产物的质量,并用气相色谱进行分析。至少分析两次所得液体产物的组成,采用面积归一化法校正因子校正所得的含量,对液体进行物料恒算。根据记录的数据,计算出原料乙醇的转化率、产物乙烯收率和选择性、副产物乙醚收率和选择性。
(1)质量相对校正因子的计算
在标准溶液中:
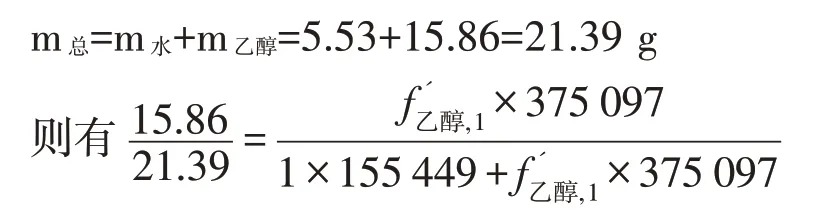

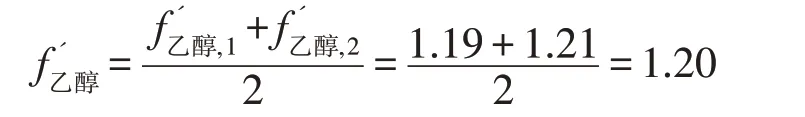

表12 质量相对校正因子表
(2)各样品中组分的计算
以进料量为0.9 mL/min时的产品数据计算水为例:

数据汇总见表13。
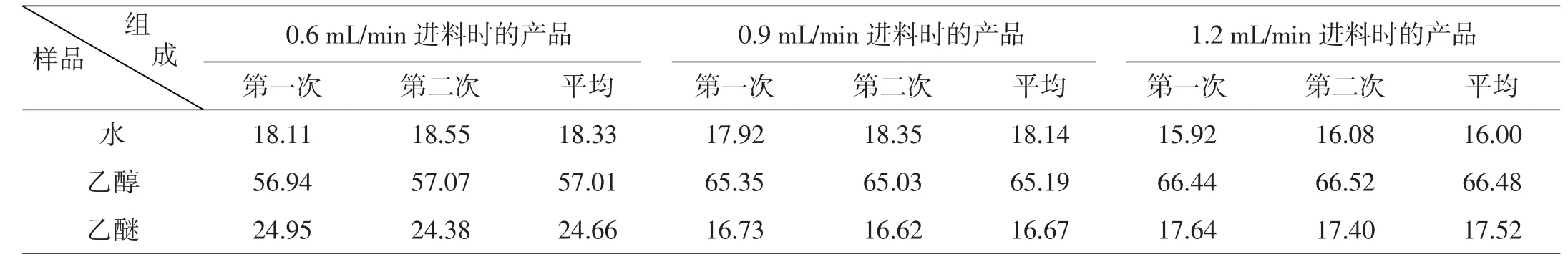
表13 产品组成
(3)产品质量和气体流量的计算及原料质量衡算
以进料量为0.9 mL/min时的产品数据计算为例:
产品质量m3=m″3-m′3=74.53-53.70=20.83 g
乙烯气体体积V3=4 393.554-4 392.802=0.752 L
乙烯物质的量:

乙烯气体质量:m3,乙烯=n3,乙烯×M乙烯=0.888 g
原料总质量:m=m3+m3,乙烯=21.718 g
同理,各产品质量数据如表14。
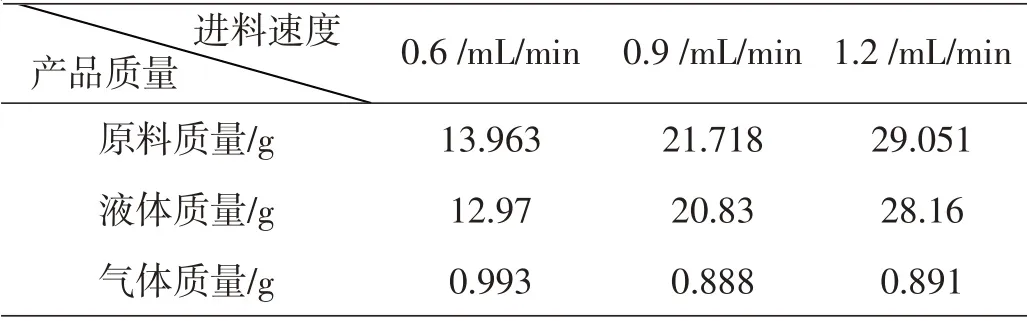
表14 产品质量数据表
(4)各组分物质的量计算
以进料量为0.9mL/min时的产品数据计算为例:水的物质的量:

乙醇的物质的量:
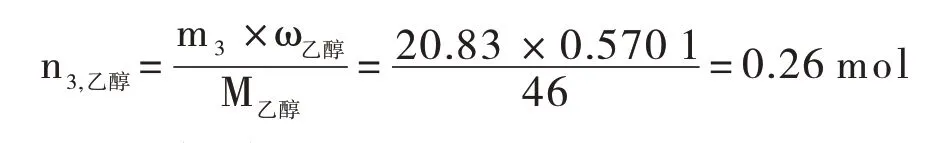
乙醚的物质的量:

产物中各组分的物质的量见表15。
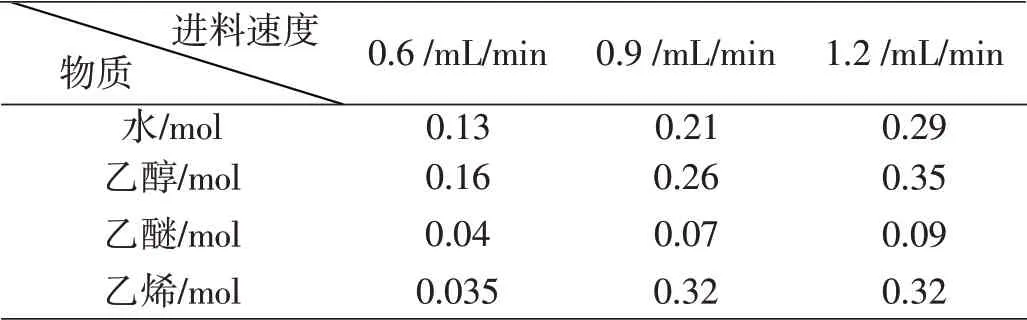
表15 不同进料速度下产物中各组分的物质的量
(5)各流速下转化率、乙烯收率、选择性
以进料量为0.9 mL/min时的产品数据计算为例:
原料乙醇物质的量:

乙醇转化率:

乙烯收率:
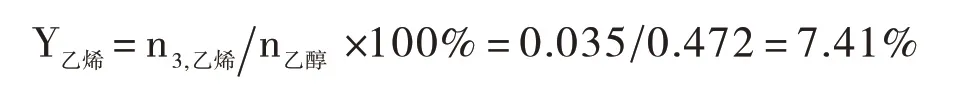
各流量结果如表16。
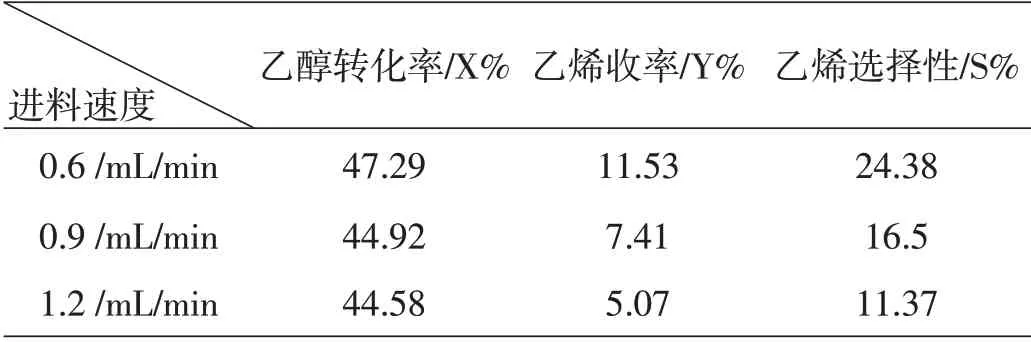
表16 各流量下的转化率和收率
(6)进料速度与反应结果(图2)

图2 进料速度与转化率等的关系图
式中:ν0—乙醇的加料速度(毫克分子/分);y-乙醇转化率(%)。
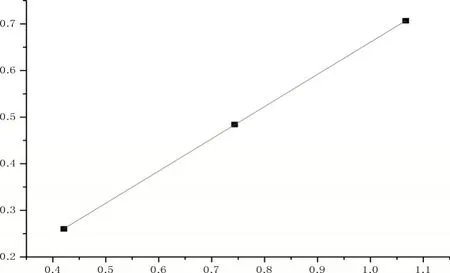
图3 一级反应速度方程式图
其中a=-0.032 3 ≈0,b=0.732 1,R2=0.983 2
(7)结果分析与讨论
由图3 可知,随着进料速度的增大,反应的乙醇转化率、乙烯收率、乙烯选择性都减小。为方便分析,将反应器简化为管式反应器(PFR),且忽略温度和生成气体体积对空时的影响。反应器中主要进行以下反应:
主反应:C2H5OH →C2H4+H2O
副反应:2C2H5OH →C2H5OC2H5+H2O
将两个反应看成基元反应,则有:r1=k1cA,
因此有:-RA=k1cA

可知当Q0增大时,τ减小,即xA减小。所以当增加进料速度时,乙醇转化率减小,与实验结果相符。
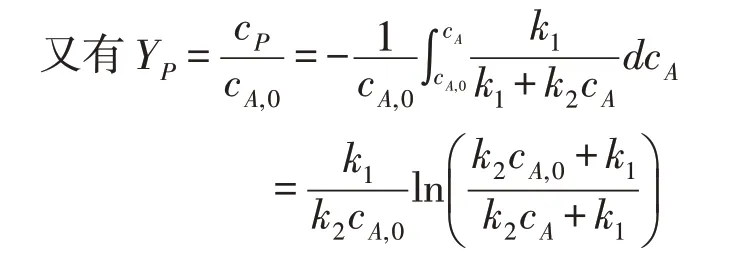
可知当Q0增大时,因为xA减小,所以cA增大,进而YP减小。所以当增加进料速度时,乙烯的收率减小,与实验结果相符。
可知,当cA增大时,S减小,与实验结果相符。
6 思考题
(1)乙醇反应转化率的提高和哪些因素有关?
乙醇的转化率和温度、压力、工艺过程、停留时间、催化剂的选择有关。温度、压力影响反应平衡和动力性质;工艺过程从根本上改变反应;空速影响反应时间;催化剂的孔结构、结晶度、比表面积以及表面酸量及活性位和分子扩散影响反应。
(2)改变气相色谱的柱箱温度对分离效果有什么影响?怎样确定最适宜的分析条件?
降低柱温可以提高色谱柱的选择性,提高柱温可以加快传质,缩短分离时间,提高柱效。实际工作中,试样的沸点是选择柱温的主要依据。
(3)怎样对液体产物进行定性、定量分析?
根据色谱图中各组分色谱峰的出峰时间,可进行定性分析;根据峰面积或峰高,可进行定量分析。
(4)对整个反应过程进行物料恒算时应该注意哪些问题?
应该注意流股以及流股的温度、组成、流量。
7 结束语
本实验要求学生掌握气固相管式催化反应器的构造、原理及使用方法,学会催化剂评价的方法及获得适宜工艺条件的研究方法[1-12]。整个实验需要老师悉心指导才能完成。下一步要思考如何提升学生的综合素养。

