iPSCs 在家畜育种中的作用研究进展
徐彦文,周婧萱,师科荣
(山东农业大学动物科技学院,山东省动物生物工程与疾病防治重点实验室,山东泰安 271018)
对于大动物而言,其生殖周期长(世代间隔长)和产仔数少(繁殖率低),这为优质大动物群体的扩繁、优良品种的培育带来了不同程度的困难。近年科学家们提出“干细胞育种”的理念。胚胎干细胞 (Embryonic Stem Cells,ESCs) 是一种具有多能性的干细胞,可分化成多种细胞、组织和器官,甚至具备发育成为完整个体的潜能,利用ESCs 进行胚胎的体外制备、优质个体的选育和扩繁是提高大动物育种进程的重要有效途径。但胚胎干细胞系的建立和获取是非常困难的,目前仅获得了鼠、人、猴的胚胎干细胞系,严重制约了其在大动物上的研究和应用。
2006 年提出的诱导多能干细胞(Induced Pluripotent Stem Cells,iPSCs)为多能性干细胞的获得打开了一扇新的大门。Takahashi 等首先从24个候选因子中挑出4个因子 Oct4、Sox2、Klf4 和 c-Myc,再将这4个基因通过反转录病毒载体向小鼠成纤维细胞共同转导表达,经过诱导体细胞获得了类似ESCs 的特征,这类经诱导的多能干细胞被称为iPSCs,由于这一杰出贡献Yamanaka 与Gurdon 共同获得2012 年诺贝尔生理学或医学奖。经典的iPSC 技术简单概括为将Oct4、Sox2、Klf4、c-Myc 四因子在已经分化的体细胞中过表达,细胞发生重编程、去分化慢慢转变成为具有多能性的干细胞iPSCs。iPSCs 的成功获得可以避开胚胎干细胞建系困难、胚胎来源有限、胚胎移植后发生的免疫排斥等一系列严重制约多能性干细胞发展的瓶颈问题。本文首先对ESCs 和iPSCs 进行比较分析,阐述了iPSCs 在大动物育种中的研究进展和应用策略,深入探讨干细胞育种在大动物生产实践的重要价值。
1 iPSCs 可以弥补ESCs 来源受限的不足
小鼠ESCs 的建立最早可以追溯到Evans 等从小鼠囊胚的内细胞团(Inner Cell Mass,ICM)中首次成功分离到 ESCs,建立了第1个未分化的小鼠ESCs 系。ESCs 易于基因操作,经遗传改造、显微操作及冷冻复苏后仍然可以保持多能性,因此,ESCs 在大动物育种中有非常广的应用前景。从1981 年以来ESCs 研究从小鼠逐渐扩展到人和其他动物,但仅成功获得了小鼠、人和猴的ESCs 系。
干细胞的多能性在大动物育种中的应用一直是科学家探索的热点,但经过30 年的探索大动物ESCs 尚未成功建立和验证。对于家畜动物,科学家们在猪ESCs和牛ESCs建系上做了大量尝试,但都限于“类”ESCs 系的建立。于是,科学家们开始探索通过其它方式获得多能干细胞,2006 年提出的iPSC 技术为多能性干细胞的获得提供可能。iPSCs 是以ESCs 作为参考对象进行建立和研究的,因而,iPSCs 和ESCs具有相似的特征或特性,即细胞形态相似、基因表达和表观遗传修饰模式相似、可以维持多能性而不分化,同时可以诱导分化形成畸胎瘤、形成嵌合体后代。
不同研究团队研究获得的iPSCs 出现不同,主要原因可能是iPS 技术本身是一个随机性较强的概率事件。体细胞被重编程诱导的过程中,虽然所有初始细胞都处于同样诱导条件和环境下,只有极少数细胞完全重编程。另一方面,不同的iPSCs 系之间也可能存在巨大差异,这种差异在很大程度上源于初始细胞的遗传差异、诱导因子及培养条件的不同。
不管iPSCs 和ESCs 的相似程度高或低以及ESCs能否作为评判iPSCs 多能性的标准,不可否认的是iPSCs 的诞生是生命科学研究中的又一个里程碑式的发现。iPSCs 作为目前唯一不依赖胚胎或卵母细胞,利用体细胞进行重编程的方式就可以获得具有多能性细胞的方法,这一发现突破了建系困难的技术瓶颈,将给家畜等大动物育种带来前所未有的机遇和挑战。
2 家畜iPSCs 的研究进展
近年来科学家相继开拓性研究了小鼠、人、猪、绵羊、山羊、马、牛等物种的iPSCs。经过多年的发展,iPSCs 的诱导方式、诱导效率、细胞安全性取得了很大进步,其应用价值和前景也受到广泛关注。
值得一提的是,早期研究获得大动物iPSCs 大多呈primed 态。随着诱导分子和培养环境的不断摸索,人们进一步获得了naive 态iPSCs。二者的多能性存在区别,naive 态iPSCs 能够形成嵌合体后代,而primed 态iPSCs 没有形成嵌合体后代的能力。
2.1 猪iPSCs 研究进展 猪在畜牧业中占据重要地位,加之其在器官移植应用研究中的优势,一直以来就是大动物ESCs 建系研究的重点。世界上报道的首例猪iPSCs 系是在2009 年,Wu 等利用成纤维细胞和原代骨髓细胞为供体细胞,采用强力霉素(Dox)诱导的慢病毒表达系统,转入人源化6 因子(Oct3、Oct4、Sox2、Klf4、c-Myc、Nanog 和Lin28)进行诱导,之后Ezashi 等获得了人源化5 因子慢病毒转染诱导建立的iPSCs。直到2010 年West 等使用人源化6 因子诱导建立的iPSCs 得到严格的全能性验证,获得了成活嵌合体。随后West 等又将获取的雌性嵌合体猪与正常的雄性野生型猪繁衍,二次获得了生殖嵌合猪这为转基因猪的生产奠定了理论和技术基础,但其结果的低重复性是广泛推广的一个障碍。Kues 等利用CAG驱动的Sleeping Beauty 转座子质粒共表达鼠源4 因子,这种新的转运载体可游离在宿主细胞基因组之外,整合进入宿主细胞基因组的频率很低,可避免病毒重新激活的不安全因素,为生产更加安全的iPSCs 带来希望。Du 等利用非整合质粒episome 瞬时表达载体诱导系统、且在2i/LIF 的培养体系中获得了类似于naive 态iPSCs,通过胚胎注射和胚胎聚合技术能够体外形成嵌合比例高的囊胚,但之后的发育能力受阻。
1997 年诞生的多莉羊不仅证明了终末分化的细胞核仍具有全能性,也说明体细胞核移植在家畜动物中取得了历史性突破。Fan 等通过将由iPSCs 分化而来的细胞核作为SCNT 的供体细胞核,分别于2011 年和2012 年成功培育出了多头体细胞克隆猪,这也是世界上首次获得活体iPSCs 来源的克隆猪。还有iPSCs 源克隆猪的报道,其细胞核大多数源于可诱导的慢病毒载体生产的iPSCs,这也证明了沉默iPSCs 中外源转录因子有利于提高克隆猪的生产效率。
目前关于iPSCs 研究报道有限,值得期待的是iPSCs 能够通过四倍体囊胚补偿实验获得克隆动物,这是严格意义上证明iPSCs 具有多能性的“金标准”。
2.2 马iPSCs 研究进展 2011 年,Nagy 等首次报道利用piggy Bac 转座子介导4 因子将马成纤维细胞重编程为iPSCs,然而其多能性的维持依赖于Dox 的诱导。成功建立iPSCs 须满足外源过表达基因沉默且多能性基因内源激活的条件。2014 年Sharma 等利用马角化细胞诱导重编程获得primed 态iPSCs。人iPSCs 多数情况下成纤维细胞作为诱导重编程的首选源头细胞,但是其他类型细胞(如角化细胞)更易于重编程,并能更高效生成iPSCs,因此Sharma 等实验获得的iPSCs 是角化细胞作为源头细胞的成功尝试。此外,马iPSCs 也被首次报道在适当的培养条件下能产生具有胆碱能运动神经元特征的细胞,可产生动作电位。同年,Whitwoth 等利用母马真皮成纤维细胞获得了naive态iPSCs。
2.3 牛iPSCs 研究进展 在所有家畜中,牛ESCs 的研究尤为重要,牛不仅为人类提供大量的优质乳蛋白/肉类蛋白,更重要的原因是牛的繁殖周期长,并且在自然受孕时一般单胎,所以牛的育种进展缓慢是科学家一直致力攻克的研究热点。
2011 年Han 等分别利用人源和牛源转录因子,首次建立了牛iPSCs,其形态与小鼠的ESCs 相似。牛源6 因子(Oct4、Sox2、Klf4、c-Myc、Lin28、Nanog)体系的诱导效率高于人源体系的诱导效率。Wang 等利用电转染单将Oct4 转入牛生精上皮细胞诱导获得表达SSEA4 的iPSCs,并证明邻苯二甲酸酯类化合物可诱导iPSCs 发生凋亡。Talluri 等将转座子导入牛成纤维细胞并获得具有分化为三胚层潜能的iPSCs。Kawaguchi 等用牛羊膜细胞获得naive 态iPSCs,并获得牛嵌合体。Naive 态iPSCs 的获取是干细胞育种在牛育种中的一个突破。值得一提的是,该naive 态iPSCs 的获得源于妊娠50d 的母牛羊膜细胞,如果未来用母牛产后的羊膜细胞作为研究对象来建立iPSCs,会更加符合现代干细胞育种的核心理念。Sumer 等用逆转录病毒转染产生iPSCs,并检测到POU5F1、SOX2、KLF4、c-MYC 和NANOG 的异位表达,且证明了NANOG 的异位表达是牛胎成纤维细胞产生和维持iPSCs 的必要条件。这与Kawaguchi 等的研究结果有所差异,其获得的iPSCs 没有NANOG 的异位表达,但可能是bADCs 表达内源性NANOG。因此,NANOG对于iPSCs 的生成与维持的作用值得再推敲。对于牛胚胎干细胞相关分子标志及对牛体细胞重编程机制的深入研究与理解,将为iPSCs 的获得和建立提供新思路。
2.4 羊iPSCs 研究进展 中外科学家都曾尝试进行绵羊诱导多能干细胞的建立。2011 年,我国两个团队几乎同时公布成功建立iPSCs,Bao 等利用 DOX(Doxcycline)诱导的慢病毒表达系统异位表达人源8 因子(Oct4、Sox2、c-Myc、Klf4、Lin28、Nanog、SV40 LT和 hTERT8),将绵羊耳尖成纤维细胞重编程为iPSCs;同年,Li 等在异位表达鼠源6 因子的情况下将绵羊胎儿成纤维细胞重编程为iPSCs。但这两个研究小组获得iPSCs 的多能性维持均依赖于DOX 的诱导,这表明iPSCs 可能并不是完全重编程的多能性细胞。逆转录病毒异位表达异源4 因子也可以将羊成纤维细胞重编程,形成的iPSCs 可内源表达多能基因和,但不能持续维持、未获得嵌合绵羊。Sartori 等利用经典Yamanaka 4 因子将绵羊胎儿成纤维细胞重编程为iPSCs,分别注射入合子、8 细胞胚胎、囊胚中可获得成活的嵌合体后代羊,且嵌合小羊可内源表达嵌合多能因子Oct4。
科研团队也对山羊iPSCs 进行了不同程度的探索与研究。2011 年,Ren 等首次报道了4 因子慢病毒表达系统诱导的山羊iPSCs,继而改进方法用鼠源6 因子(外加Lin28 和Nanog)、2个人源因子(hTERT8 和SV40 LT)诱导获得iPSCs,但未能成功获得向三胚层分化的畸胎瘤。2013 年Song 等再次用慢病毒载体表达人源4 因子将山羊胎儿成纤维细胞诱导为iPSCs,该细胞系能内源表达多能性基因,也能体内/外分化为三胚层。2015 年,Chu 等研究发现利用4个人源因子(POU5F1、SOX2、KLF4 和c-MYC)和山羊源蛋白精氨酸甲基转移酶5(PRMT5)可有效提高iPSCs 的诱导生成效率,说明表观遗传修饰因子对诱导效率具有调控功能,但是没有形成嵌合。同年,Sandmaier 等使用与山羊更接近的牛源因子进行诱导重编程,可形成不完全的畸胎瘤。
3 iPSCs 在家畜动物育种中的应用途径和策略
大动物的iPSCs 大多都开展了研究尝试,有的成功获得了具有嵌合能力的后代个体。iPSCs 与ESCs 在功能上非常相似,因此在大动物ESCs 系获得受限的条件下,未来iPSCs 可以作为一种替代性技术和途径用于大动物育种(图1)。另一方面,对所建立 iPSCs 的分析可以反过来促进对ESCs 的研究,加速突破构建家畜ESCs 系的瓶颈。
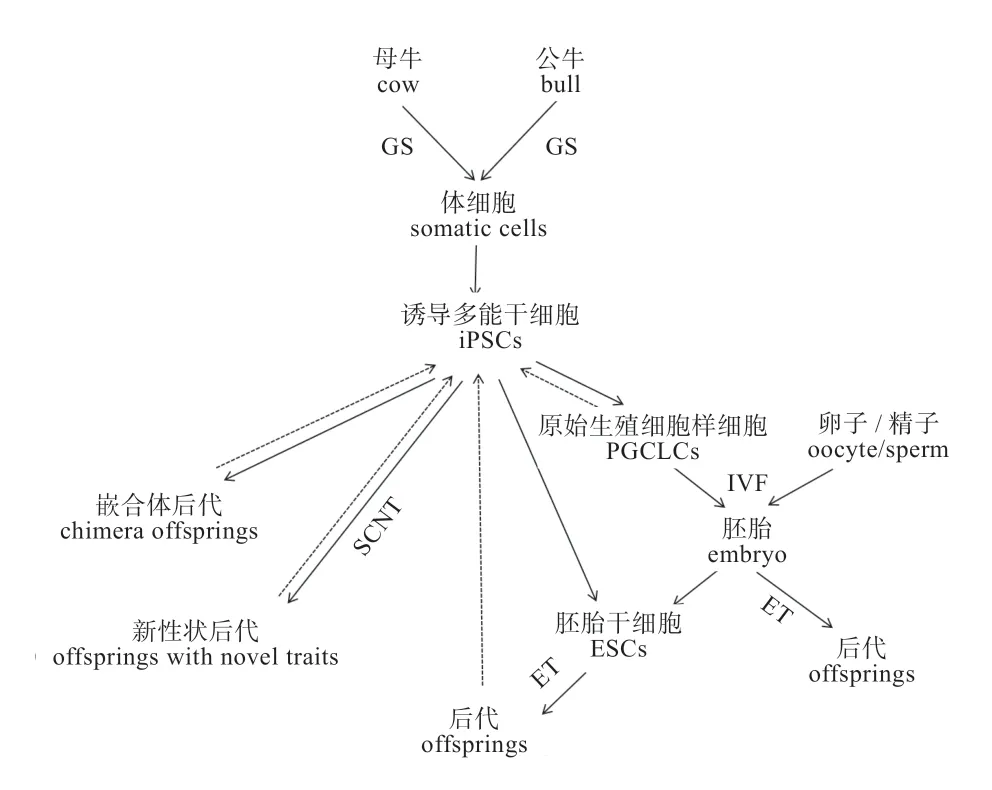
图1 iPSCs 在家畜动物(牛)育种中的潜在应用途径
3.1 iPSCs 提供了建立大动物ESCs 系的一种新途径在大动物iPSCs 系建立之前,科学家一直未能成功建立大动物ESCs 系。并且由于对大动物ESCs 的形态、分子标志一直存在争议,因而建立的ESCs 系被称为类ESCs。大动物iPSCs 系的成功建立为研究大动物ESCs体外培养所需化学分子的探索提供了研究平台,并且,通过对iPSCs 系的分析研究有助于进一步明确维持其多能性的生物学信号通路、揭示鉴定iPSCs 的表面分子标志。这些信息都将大力促进大动物ESCs 系的成功建立。而ESCs 在家畜育种中的应用价值一直被国内外科学家高度关注。
3.2 iPSCs 用于生产克隆动物或模式动物 iPSCs 是通过体外诱导培养体细胞获得,源头细胞来源广,较易获得多能性干细胞系,这可以弥补大动物ESCs 建系困难的天然缺陷。且iPSCs 只要建系成功便可以无限增殖和传代,在体外长期冷冻保存。因而,将iPS 技术与克隆技术、基因编辑技术和胚胎技术相结合,对于濒危动物遗传资源的拯救与保护、建立保种技术体系、构建模式动物都具有重大的理论意义和实践意义。
1)诱导分化体外制备生殖细胞:iPSC 建系是一种新的保种手段,可以作为种质资源素材,通过液氮冷冻长期保存。目前我国和日本团队均已成功从ESCs 和iPSCs 中体外培养获得具有小鼠类卵母细胞系(Pluripotent Stem Cells Differentiated into PGC-like Cells,PGCLCs),并且证明可产生后代小鼠。有研究表明,人iPSCs 可以在体外分化为原始生殖细胞(Primordial Germ Cell,PGCs),这为体外诱导iPSCs分化产生精子或卵子提供重要启示。同理,将大动物iPSCs 体外诱导成动物生殖细胞,通过体外受精对胚胎进行性别控制,人为地培育出符合人类生产生活需求特质/特性的后代,如通过性别控制提高雌性后代的出生率、缩短动物品种遗传改良及繁殖的周期,服务于动物育种与扩繁,有力地推动我国种畜良种推广工作,提高畜牧业经济效益。
2)保存珍稀动物的遗传资源:利用iPSCs 作为供体,结合克隆技术生产稀有物种的克隆动物,同时可以迅速扩大濒危动物的有效群体数量。
3)突破远缘杂交障碍、创造新物种、获得新性状:用传统交配方法无法获得的新性状、新物种,用异种来源的iPSCs,结合核移植或嵌合体制备方法可获得具有新性状的克隆动物或异种动物的嵌合体。
4)提高家畜的繁殖效率和育种进程:iPSCs 从理论上讲可以无限传代、增殖而不丢失其基因型和表现型。因而,iPS 技术与胚胎嵌合技术可生产具有遗传同质型的模式动物,iPS 也可与核移植技术相结合可生产克隆动物,大大缩短良种家畜的世代间隔。因而,iPSCs 促进良种动物生产潜力的充分发挥,也可以加速遗传改良进程。
5)提供构建模式动物的遗传素材:iPSCs 结合核移植技术可以制备遗传基础完全相同的克隆个体,并可进行遗传育种评价,如群体遗传参数估计、种质鉴定和筛选、个体遗传评估,还可作为人类疾病模型研究病理机制。
3.3 iPSCs 用于生产基因编辑动物 用iPSCs 生产转基因动物、基因编辑动物的优势在于打破物种界限,突破亲缘关系。其中iPSCs 最受关注的特征是其种系嵌合的能力,将iPSCs 注入到宿主囊胚内,iPSCs 可以整合到宿主胚胎中参与个体发育,且具备嵌合到生殖嵴的能力,从而有可能将性状遗传给下一代。利用同源重组技术对iPSCs 进行遗传改造,通过克隆技术生产遗传修饰动物,可以改良动物重要经济性状、甚至获得非常规性状,如生产人类药用蛋白、工业用酶等。
另一方面,iPSCs 细胞诱导重编程过程本身涉及外源基因的表达,虽然多能性建立后外源基因沉默,但是可能在重编程过程中激活某些优良性状基因的表达,产生新的优异性状。通过对优秀性状基因的筛选和鉴定,同时可筛选获得能够促进重编程效率的基因,从而获得更加理想的iPSCs 系。
4 展 望
目前,大动物iPSCs 系都已建立,但未见有获得四倍体囊胚补偿的后代,因而探索各物种稳定可控的iPSC 系诱导建立方法依旧任道而重远。人iPS 技术的研究与应用依然如火如荼地向前推进,有趣的是iPSCs的创始人Yamanaka 于2020 年就iPSCs 在细胞治疗中的应用前景与挑战发表了观点,这些论点都将为大动物iPSCs 的建立及其在干细胞育种中的应用提供更多的理论指导和创新理念。iPSCs 系最初的建立虽然是以ESCs 做为参考对象,但iPSCs 未来的研究和应用不完全局限在ESCs 下,仅从iPSCs 的建系不依赖于胚胎、不依赖于卵母细胞这一个方面就为其在畜牧业育种的潜在应用价值带来了更多可能性。因此,获得具有严格意义上多能性iPSCs 系必将为大动物育种增添光彩。

