哺乳动物卵母细胞成熟及早期胚胎发育中组蛋白修饰研究进展
崔浩亮,贾青,2,3,高明,史佩华,高锦春,陶晨雨*
(1.河北农业大学动物科技学院,河北保定 071000;2.国家北方山区农业工程技术研究中心,河北保定 071000;3.河北省山区农业工程技术研究中心,河北保定 071000)
组蛋白是组成真核生物染色体的结构蛋白,组蛋白修饰是指组蛋白氨基酸位点发生乙酰化、磷酸化、巴豆酰化、甲基化、琥珀酰化等修饰过程。组蛋白修饰主要表现为染色体结构发生变化,在基因激活、卵母细胞成熟以及细胞重编程等方面起着非常重要的作用。组蛋白甲基化和乙酰化是2 种非常重要的表观遗传修饰标记,组蛋白甲基化主要发生在赖氨酸(K)和精氨酸(R)残基,组蛋白乙酰化修饰主要是发生在组蛋白H3 和H4,重要位点包括组蛋白H4K5、K8、K12、K16 与H3K9、K14 等。有研究表明,在哺乳动物卵母细胞成熟及早期胚胎发育过程中存在多种组蛋白修饰,且在细胞发育的不同阶段发生动态变化。本文就哺乳动物卵母细胞成熟及早期胚胎发育过程中甲基化修饰与乙酰化修饰情况及影响因素进行综述,为哺乳动物发育研究提供理论依据。
1 哺乳动物卵母细胞成熟过程中的动态组蛋白修饰
组蛋白甲基化和乙酰化修饰参与卵母细胞成熟过程,在人类卵母细胞成熟过程中,检测到从生发泡(GV)期到第2 次成熟分裂(MII)期存在相对稳定的甲基化和乙酰化修饰。然而在猪卵母细胞成熟过程中,存在十分活跃的蛋白修饰变化情况。组蛋白H4K5、H4K8、H4K12、H4K16、H3K9 和H3K14位点在GV期表现乙酰化,随后生发泡破裂(GVBD)期乙酰化丢失。H4K5 和H4K16 位点乙酰化丢失会持续到第1 次成熟分裂(MI)期,随后在第一后期与末期(AT I)中发生短暂乙酰化,这可能与卵母细胞的第二次减数分裂的发生有关。相比于活跃的乙酰化水平,甲基化水平趋向稳定,H3K23 三甲基化和H3K27 单甲基化、二甲基化、三甲基化在卵子成熟过程中稳定存在,同时H3K27 位点的乙酰化也表现稳定水平。与猪的研究结果相似,小鼠卵母细胞也存在丰富的组蛋白甲基化和乙酰化修饰水平,组蛋白H3K9、H3K14、H3K18和H4K5、H4K8、H4K12、H4K16 在GV 期均表现乙酰化,随着卵母细胞逐渐成熟,大部分位点会发生去乙酰化且维持到MII 期。同时H4K12 会在第一极体(PB1)排出时发生短暂乙酰化,这与H4K5 和H4K16 位点的研究结果相似。相反甲基化修饰总体水平更加稳定,H3K79 二甲基化、三甲基化稳定存在于GV 期、GVBD期和MII 期,且H3K79 三甲基化定位在着丝粒周围区域,这可能会影响减数分裂正常的着丝粒构象。同时也存在一些活跃的甲基化位点,Sarmento 等研究发现H3R17、H4R3 在卵母细胞成熟过程中表现稳定甲基化状态,直到MII 期发生甲基化丢失。在牛卵母细胞发育过程中,组蛋白甲基化与之前猪的研究结果相似,即H3K4、H3K9 二甲基化稳定存在。在牛卵母细胞发育过程中组蛋白发生乙酰化丢失的速度低于猪和小鼠,GVBD 时期H4 乙酰化减弱,MII 期H4K5、H4K12 和H4K16 发生乙酰化丢失,同时H4K8 表现弱乙酰化,这种情况在小鼠体内也有出现。然而在羊卵母细胞成熟过程中,H3K9、H4K12 从GV 期到MII期表现乙酰化,H4K5 直到MII 期发生乙酰化丢失,这与猪和小鼠的研究结果相反。H3K9 在GV 期和MII 期表现三甲基化。哺乳动物卵母细胞成熟过程中组蛋白甲基化和乙酰化变化见表1-2。以上研究表明,已经探明的组蛋白修饰位点显示卵母细胞成熟过程中整体呈现乙酰化-去乙酰-乙酰化形式动态变化趋势,而且一些位点在AT I 期存在明显变化,这表明组蛋白乙酰化变化与减数分裂时期显著相关。而大部分组蛋白甲基化修饰在整个减数分裂期间表现稳定化趋势。同时在不同物种间组蛋白修饰也表现不同状态,牛、羊卵母细胞成熟过程中乙酰化丢失速率低于猪和小鼠,显示卵母细胞成熟过程中组蛋白修饰变化具有物种特异性,组蛋白甲基化相比乙酰化整体更加稳定,同时在一个位点可以多个甲基化同时存在,甲基化数量不同决定着不同功能。

表1 卵母细胞成熟过程中组蛋白乙酰化修饰变
2 哺乳动物早期胚胎的动态组蛋白修饰
受精后的早期胚胎发育与前期减数分裂过程紧密相连,组蛋白甲基化和乙酰化修饰持续存在且趋向动态变化。早期胚胎组蛋白甲基化和乙酰化状态见表3。在猪早期胚胎细胞的细胞核内可以检测到H3K27 甲基化修饰,且单甲基化、二甲基化和三甲基化信号会一直维持到囊胚期,此外H3K27 乙酰化强度会逐渐减弱,在八细胞期(8-cell)最弱,随后乙酰化逐渐恢复。H3K23 位点趋向稳定的甲基化和乙酰化丢失状态,只有在囊胚期恢复乙酰化以及在一细胞期(1-cell)表现弱三甲基化。小鼠早期胚胎在一细胞期与二细胞期(2-cell)阶段H3K9/K14 和H4K5 发生乙酰化。组蛋白H3K9、H3K4 甲基化状态从卵母细胞一直延续到早期胚胎阶段,相反H3K79 位点在卵母细胞受精后甲基化逐渐丢失,在四细胞期(4-cell)甲基化略有上升并维持在较低水平,值得注意的是H3K79 二甲基化在胚胎细胞有丝分裂(M 期)期间会短暂升高,其他时期都表现去甲基化状态。同时H3R17 和H4R3 位点在受精过程中发生甲基化丢失,H3R17 在受精阶段表现微弱甲基化且在细胞质中呈现点状分布,H4R3 在雌原核中表现甲基化丢失,但随着胚胎的发育甲基化逐渐恢复。然而在牛体外受精过程中,早期胚胎呈现稳定的甲基化和乙酰化状态。在羊受精卵中H3K9 修饰状态与小鼠类似,受精完成后只在雌原核中表现H3K9三甲基化,相反雄原核不表现。上述研究结果表明组蛋白修饰在早期胚胎发育过程中起到十分重要的作用,同时这阶段组蛋白修饰变化更加丰富且位点的定位不仅限于细胞核。
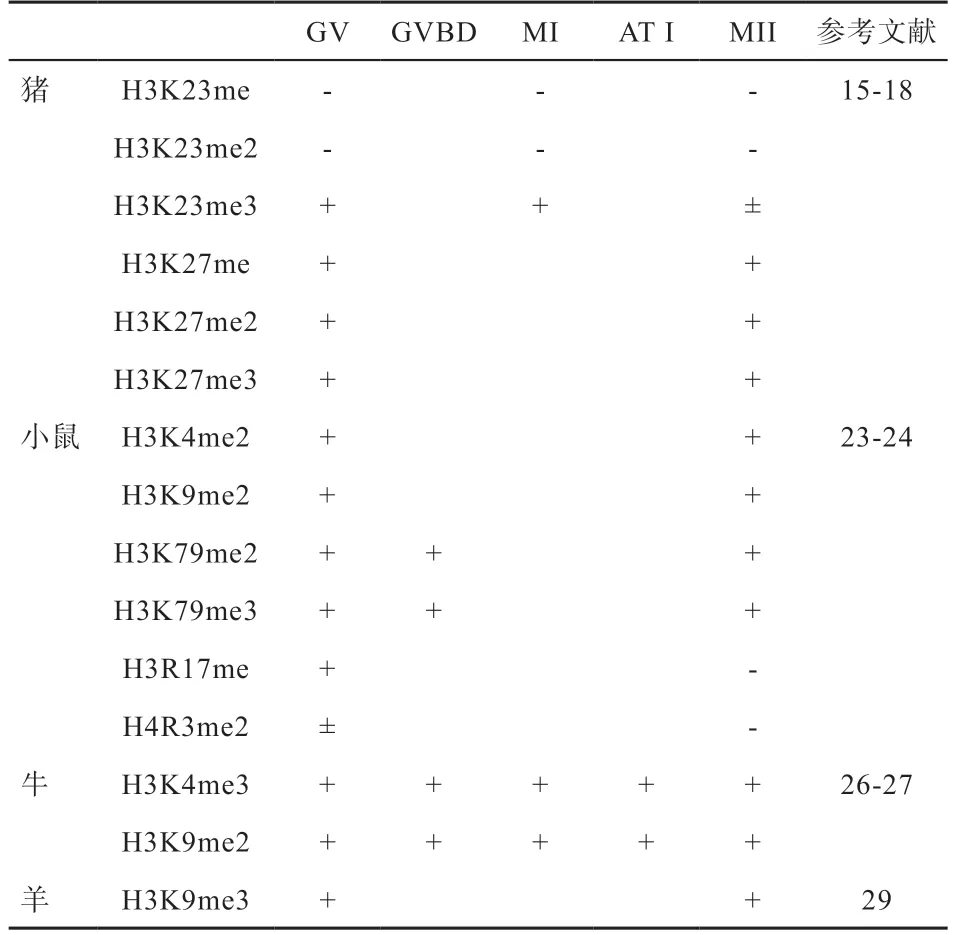
表2 卵母细胞成熟过程中组蛋白甲基化修饰变化

表3 早期胚胎细胞组蛋白甲基化修饰与乙酰化修饰
3 组蛋白修饰对哺乳动物卵母细胞及早期胚胎发育过程的影响
3.1 组蛋白修饰酶在哺乳动物卵母细胞及早期胚胎中表达 卵母细胞成熟及早期胚胎发育是一个连续过程,此过程中正常的组蛋白甲基化和乙酰化修饰确保了胚胎后续发育。组蛋白甲基化修饰主要由组蛋白甲基化转移酶(HMT)催化完成,乙酰化则主要是由组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)共同调控。为研究卵母细胞成熟及早期胚胎发育过程中组蛋白修饰变化的影响因素,本文主要探讨组蛋白甲基化转移酶、组蛋白去乙酰化酶以及组蛋白乙酰转移酶在这一阶段的表达水平变化。HATs 和HDACs 的表达水平对小鼠卵母细胞减数分裂以及孤雌激活(PA)起到至关重要的调控作用,Zhang 等通过研究HAT 基因和和HDAC 基因和,发现和表达在GV 期、MII 期和PA 中呈现先降低后升高状态,而且5个基因呈现相反表达水平。赖氨酸特异性去甲基化酶4A(KDM4A)可以特异性去除H3K4 三甲基化标记的启动子甲基化,KDM4A 缺失会导致卵母细胞异常的H3K9 三甲基化累积,使合子基因组激活过程中基因转录激活降低。在猪卵母细胞GV 期生发泡中检测到HDAC 主要定位在染色质缺失区,在GVBD 期主要分布在染色质外围,MII 期HDAC 消失,表明HDAC 的活性与卵母细胞减数分裂周期存在相关性。Sin3a 是包含HDAC1/2 的复合物,Jimenez 等研究发现Sin3a mRNA 在卵母细胞成熟过程中被招募,抑制其招募不仅会抑制2-cell 期后的发育,而且会降低重编程基因表达的保真度。小鼠卵母细胞发育到15 日龄,和基因表达量显著提高。期间H3K9、H3K18和H4K12 乙酰化程度也相应提高。这些结果说明HDAC 在调控组蛋白乙酰化过程中起到重要作用。胚胎细胞初始阶段的生命活动主要依靠母源物质维持,在胚胎基因激活前后,和的mRNA 一直存在。和在胚胎基因激活前后相对丰都存在显著差异,SUV39H1/2 介导组蛋白H3K9 三甲基化阻碍细胞重编程过程,DCAF13通过使SUV39H1 泛素化,导致H3K9 三甲基化丢失从而影响早期胚胎细胞重编程,但令人注意的是这期间HAT mRNA 相对丰度没有变化。和是H3K27 的甲基化调控因子。卵母细胞及早期胚胎发育过程中在H3K27 位点存在甲基化,H3K27 三甲基化在2-cell 和4-cell 期胚胎细胞中水平很低或检测不到。从4-cell 开始,和转录水平显著提高,EZH2 则相反。SETD2 是一种H3K36 甲基转移酶,基因缺失会引发卵母细胞基因组表观修饰发生广泛变化,包括H3K36 三甲基化丢失、DNA 甲基组错误,从而导致卵母细胞成熟缺陷以及胚胎细胞停滞发育。总的来说,在卵母细胞以及早期胚胎发育过程中多种组蛋白修饰酶通过调控组蛋白修饰来维持正常的细胞功能及细胞状态。此外一些外源物质也可以起到类似效果,VC 可以促进猪卵母细胞减数成熟以及提高体外成熟率,Yu 等研究发现VC 处理提高以及表达水平,抑制表达水平。
3.2 组蛋白修饰酶对细胞内组蛋白修饰变化的影响 随着蛋白修饰组学的发展,越来越多的蛋白修饰酶被人们发现,但它们的具体功能还得不到验证。丁酸钠是一种天然的组蛋白乙酰化酶抑制剂,用丁酸钠处理卵母细胞和早期胚胎细胞使H3K9 乙酰化发生改变,同时会抑制卵母细胞发育,然而少量丁酸钠促进早期胚胎发育。曲古抑素A 处理卵母细胞会诱导染色体组蛋白高乙酰化,其通过抑制HDAC6 导致减数分裂停滞、-微管蛋白以及H4K16 乙酰化增加、H3T3、H3S10 磷酸化降低,同时会抑制甲基化基因以及细胞周期基因的表达。用曲古抑素A 处理小鼠卵母细胞和早期胚胎细胞,发现H3K9/K14 和H4K5 乙酰化水平升高,猪卵母细胞GVBD 延迟。组蛋白H4K12 乙酰化在小鼠卵母细胞成熟过程中水平显著降低甚至检测不到,用放线菌酮处理MII 期卵母细胞导致H4K12 重新乙酰化,表明HDAC 在卵母细胞减数分裂过程中起到调控乙酰化作用,HAT 在MII 期丧失调控功能。TRX 是一类着丝粒异染色质结合蛋白,具有染色质重构活性。用曲古抑素A 抑制小鼠卵母细胞的HDAC 表达,通过破坏TRX与着丝粒的结合致使MII 期染色体排列异常,影响卵母细胞的正常发育。CFP1 是小鼠卵母细胞H3K4 三甲基化的主要调节因子,通过卵母细胞特异性的基因敲除、CFP1 功能抑制或H3K4 去甲基化都会抑制减数分裂以及MI 停滞现象。MC1568 是一种无毒性的去乙酰化抑制剂,用MC1568 处理SCNT 胚胎可以提高1-cell 与2-cell 阶段的乙酰化,从而促进猪SCNT 胚胎的体外发育。H3K79 可以被组蛋白赖氨酸甲基转移酶Dot1 家族特异性甲基化,缺乏Dot1L 蛋白会使小鼠卵母细胞减数分裂MI 期受到抑制。上述研究表明,抑制组蛋白修饰酶表达使组蛋白修饰发生错误从而导致基因错误表达以及细胞周期紊乱。虽然已经发现了多种可以调控组蛋白乙酰化和甲基化的酶。很多报道探究了这些酶对一个或多个位点的组蛋白修饰的影响,但目前还无法得出这些酶调控组蛋白修饰的确切结论。
4 结 语
组蛋白修饰在基因激活、细胞重编程过程中具有重要调控作用,而卵母细胞成熟及早期胚胎正常发育需要正确的组蛋白甲基化和乙酰化修饰模式,这需要相应的组蛋白修饰酶表达来调控减数分裂、胚胎发育以及细胞分化等生物过程。随着组蛋白修饰在许多疾病中的作用机制的深入研究,组蛋白修饰的功能及其调控机制研究受到广泛关注。然而,关于组蛋白修饰的研究主要集中于人和小鼠,在家畜方向的研究报道较少。猪、牛、羊可以作为人类疾病的动物模型,以其作为研究对象有利阐明组蛋白修饰在疾病中的调控模式,以便寻找疾病相关的抑制剂和靶标标志物,从而找到治疗疾病的新方向。目前关于组蛋白修饰在生殖领域的研究较少,综合现有研究报道表明组蛋白修饰动态变化影响减数分裂以及早期胚胎发育过程,具体影响机制有待进一步研究。此外,组蛋白修饰的研究技术也在不断发展,随着对组蛋白修饰各方面研究的进一步增加有望挖掘更多修饰变化规律,从而为提高动物的繁殖能力以及提高优质动物的使用年限提供理论基础。

