淫羊藿苷对ox-LDL 诱导的RAW264.7 细胞凋亡及炎症的影响
李藤藤徐东升李 琪吴 迪张 洋任立群*李相军*
(1.吉林大学药学院实验药理与毒理学教研室,长春 130021; 2.吉林大学第一医院肿瘤科,长春 130000)
随着生活条件的改善和饮食结构的变化,我国心血管疾病的发生率和死亡率迅速增长,据推算,我国现患心血管疾病人数2.9 亿,其死亡高于肿瘤和其他疾病,占居民疾病死亡的40%以上,居于首位[1]。 动脉粥样硬化(atherosclerosis,AS)是一种心血管疾病,是由内源性促炎和抗炎失衡所引起的炎症反应[2-3],涉及脂质沉积、内皮损伤、泡沫细胞堆积和不稳定斑块的破裂等病理过程[4],不稳定斑块容易发生破裂并促进血栓形成。 巨噬细胞是斑块中最重要的免疫细胞,其数量和功能对斑块的大小和稳定性有直接的影响,并通过分泌多种炎症因子,进一步介导免疫细胞浸润不稳定斑块,引发斑块内细胞的凋亡和坏死,进而加速不稳定斑块的破裂[5-7]。 因此,抑制巨噬细胞凋亡及减少促炎因子的分泌对延缓AS 进展有重要意义。
淫羊藿苷(icariin,ICA)是从传统补益中药淫羊藿中提取的一种黄酮类化合物,是淫羊藿最为代表性的成分[8],具有抗骨质疏松、抗炎、抗肿瘤和免疫调节等药理作用[9]。 目前,本课题组已发现,ICA 通过阻断p38 MAPK 和ERK1/2 信号通路抑制VSMC增殖[10]。 本研究旨在通过体外构建泡沫巨噬细胞模型,探讨ICA 对泡沫巨噬细胞凋亡以及炎症因子分泌的影响,为抗AS 治疗提供新思路。
1 材料和方法
1.1 细胞
RAW264.7 细胞株(吉林大学生命科学学院实验室赠送,由吉林大学药学院实验药理与毒理学教研室冻存)。
1.2 主要试剂与仪器
DMEM 高糖培养液(Hyclone 公司,美国);胎牛血清(四季青,浙江天杭生物科技股份有限公司);青霉素-链霉素双抗溶液(美国Gibco 公司);淫羊藿苷(四川维克奇生物技术有限公司,纯度98.0%);氧化低密度脂蛋白(ox-LDL,广州奕源生物科技有限);CCK-8 试剂盒(上海碧云天生物技术有限公司);Hoechst33258 染色试剂盒(南京凯基科技有限公司);油红O(北京索莱宝科技有限公司);总蛋白提取试剂盒(北京普利莱基因技术有限公司);IL-1β、IL-6 和TNF-α ELISA 试剂盒(上海酶联)。 TGL-16M 台式高速冷冻离心机(长沙湘智离心机有限公司);Nikon ECLIPSE 80i 正置显微镜(尼康仪器(上海)有限公司);美国伯乐Bio-Rad 垂直电泳转印系统(上海巴玖实业有限公司);MD 全波长光吸收酶标仪SpectraMax 190(美谷分子仪器(上海)有限公司);4200 全自动化学发光成像分析系统(上海天能);倒置荧光显微镜和生物显微镜(Nikon 仪器(上海)有限公司);CO2恒温培养箱(美国BD 公司);JJ260 型精密电子天平。
1.3 方法
1.3.1 细胞培养和实验分组
RAW264.7 细胞用含10%胎牛血清的DMEM高糖培养基于37℃、5% CO2培养箱中培养,第2 天换液继续培养。 当细胞生长密度至70%~80%时进行传代培养,2 ~4 代细胞用于实验。 将培养的RAW264.7 细胞分为空白组(CON 组)、模型组(MOD 组,50 μg/mL ox-LDL)、ICA 低、中、高剂量组(ICA 10、20、40 μmol/L 组+50 μg/mL ox-LDL)。低、中、高浓度的ICA 预处理RAW264.7 细胞30 min 后,模型组和ICA 低、中、高剂量组中加入50 μg/mL 的ox-LDL 培养24 h,空白组不作处理,加入等量的培养液代替。
1.3.2 CCK-8 法检测细胞活力
使用无血清的DMEM 培养液制备浓度分别为10、20、40 μmol/L 的ICA 工作液。 按照每孔每毫升1.5×104个细胞数将处于对数生长期的RAW264.7细胞接种到96 孔板中,每孔100 μL,按照1.3.1 培养条件及实验分组处理,每组设置6 个复孔。 培养24 h 后,向各孔中加入10 μL CCK-8,37℃孵育4 h后,吸去各孔中的培养液,37℃摇床5 min,酶标仪490 nm 波长处检测各孔的吸光度,细胞活力=实验组A 值/对照组A 值×100%
1.3.3 Hoechst 33258 检测细胞凋亡率
将处于对数生长期的RAW264.7 细胞按照每孔每毫升2.0×105个细胞数接种于放有盖玻片6 孔板中,按照1.3.1 培养条件及实验分组处理24 h后,弃培养液,用预冷的PBS 洗1 遍,加入500 μL 4%的多聚甲醛固定液进行固定,时间10 ~15 min,弃掉固定液并用预冷的PBS 洗2 遍,加入500 μL Hoechest33258 染色液,摇床摇动5 min 后,弃掉染色液,PBS 洗2 遍,调整显微镜的荧光波长,于镜下仔细观察并拍照,圆形是正常细胞核的着色形态,呈现淡蓝色;凋亡细胞则是致密浓染,呈现亮蓝色。1.3.4 油红O 染色
将处于对数生长期的RAW264.7 细胞按照每孔每亳升2.0×105个细胞数接种于放有盖玻片的6孔板中,按照1.3.1 培养条件及实验分组处理24 h后,弃掉培养液,PBS 洗2 遍,加4%多聚甲醛,固定30 min,弃掉多聚甲醛,PBS 洗两遍,加入2 mL 油红O 染液,37℃孵育30 min,镜下观察,弃掉油红O 染液,苏木素复染2~3 min,水洗,甘油明胶封片,镜下观察拍照。
1.3.5 酶联免疫吸附实验(ELISA)
将处于对数生长期的RAW264.7 细胞按照每孔每毫升2.0×105个细胞数接种于6 孔板中,按照1.3.1 培养条件及实验分组处理24 h 后,收集各孔中的培养液并于-80℃保存,严格按照ELISA 试剂盒 说 明 书 操 作, 测 定 ICA 对 ox-LDL 诱 导 的RAW264.7 细胞炎症因子IL-1β、IL-6 和TNF-α 释放的影响。
1.3.6 免疫印迹实验(Western blot)
将处于对数生长期的RAW264.7 细胞按照每孔每毫升2.0×105个细胞数接种于6 孔板中,按照1.3.1 培养条件及实验分组处理24 h 后,弃掉培养皿中的培养液,PBS 洗2 遍,然后收集细胞。提取各组细胞总蛋白时按照提取试剂盒的说明书,采用BCA 定量法,然后进行SDS-PAGE 凝胶电泳,通过湿法转膜到PVDF 膜上,用脱脂奶粉封闭2 h,加入相应的一抗抗体,4℃冰箱中孵育过夜。第2 天用TBST 洗膜4 次,每次5 min 加入稀释后的二抗,室温摇床孵育2 h,TBST 洗膜4 次,每次5 min,按照高敏感度化学发光检测试剂盒说明书滴加发光工作液显色后,内参以GAPDH 作为参照,采用Image proplus 6.0 软件进行灰度分析。Western blot 实验过程中涉及的抗体及稀释浓度见表1。 目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。

表1 Western blot 法检测中使用的抗体和稀释浓度比例Table 1 Antibodies used in Western blot method detection and dilutions
1.4 统计学方法
统计学采用SPSS 23.0 统计软件进行分析。 计量资料经正态分布和方差齐性检验,实验结果以平均数±标准差(¯x±s)来表示,多组平均数比较采用单因素方差分析(One-way ANOVA),组间两两比较采用SNK-q检验。 以P<0.05 为差异有统计学意义。
2 结果
2.1 ICA 对ox-LDL 诱导的RAW264.7 细胞活力的影响
给药处理24 h 后,经CCK-8 法检测,与CON 组比较,MOD 组细胞活力明显降低,差异具有统计学意义(P<0.05);与MOD 组比较,ICA 20、40 μmol/L可以显著提高细胞活力,具有统计学意义(P<0.05),ICA 10 μmol/L 组细胞活力增加,但差异无统计学意义(表2)。

表2 ICA 对ox-LDL 诱导的RAW264.7 细胞活力的影响Table 2 Effect of ICA on the viability of RAW264.7cells induced by ox-LDL
2.2 ICA 对ox-LDL 诱导的RAW264.7 细胞凋亡的影响
给药处理24 h 后,经Hoechest33258 染色观察,未经药物处理的CON 组细胞生长状态良好,细胞核形态均一,整体细胞呈现均匀的蓝色荧光;与CON组比较,MOD 组细胞核变形皱缩且发出明显的蓝色荧光,即细胞染色质密集皱缩,出现高亮的凋亡小体,典型凋亡细胞核数目明显增多,具有统计学意义(P<0.05);与MOD 组比较,ICA 低、中、高剂量组亮蓝色荧光渐弱,高亮的凋亡小体数目逐渐减少,凋亡细胞核数逐渐减少,具有统计学意义(P<0.05)(表3,图1)。
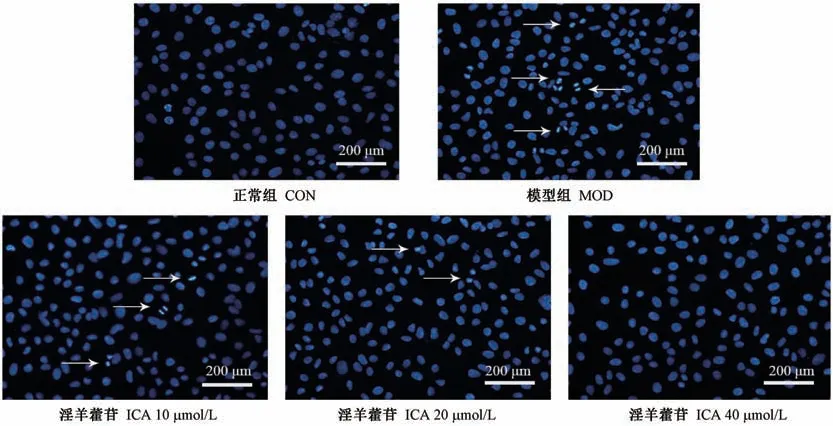
图1 ICA 对ox-LDL 诱导的RAW264.7 细胞凋亡的影响Figure 1 Effect of ICA on RAW264.7 cell apoptosis induced by ox-LDL
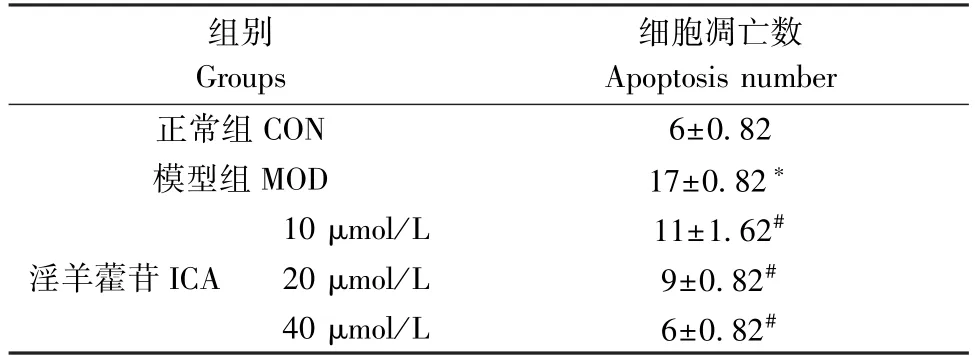
表3 ICA 对ox-LDL 诱导的RAW264.7 细胞凋亡的影响Table 3 Effect of ICA on RAW264.7 cell apoptosis induced by ox-LDL
2.3 ICA 对ox-LDL 诱导的RAW264.7 细胞油红O 染色观察
药物处理24 h 后,经油红O 染色观察,与CON组比较,MOD 组细胞体积增大且均有油红O 染色阳性细胞遍布,细胞内脂滴形成,具有统计学意义(P<0.05);与MOD 组比较,ICA 中、高剂量组油红O 染色阳性细胞逐渐减少,细胞内脂滴变小且减少,具有统计学意义(P<0.05),ICA 低剂量组油红O 染色阳性细胞减少,但差异无统计学意义(图2)。
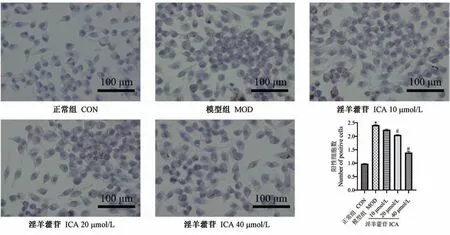
注:与CON 组相比,*P<0.05;与MOD 组相比,#P<0.05。
2.4 ICA 对ox-LDL 诱导的RAW264.7 细胞炎症因子释放的影响
药物处理24 h 后,收集细胞培养上清,经ELISA测定,与CON 组比较,MOD 组细胞分泌IL-1β、IL-6和TNF-α 因子均显著增加,具有统计学意义(P<0.05);与MOD 组比较,ICA 10、20、40 μmol/L 处理时可以降低IL-1β、IL-6 和TNF-α 因子的分泌,具有统计学意义(P<0.05),且呈剂量依赖性(表4)。

表4 ICA 对ox-LDL 诱导的RAW264.7 细胞炎症因子释放的影响(¯x±s,n=3)Table 4 Effect of ICA on the secretion of inflammatory factors in RAW264.7 cells induced by ox-LDL
2.5 ICA 对ox-LDL 诱导的RAW264.7 细胞Bcl-2、Bax、Caspase-3、IκBα 和NF-κB p65 蛋白表达的影响
ICA 浓度为10、20、40 μmol/L 预处理30 min,ox-LDL诱导24 h 后,提取细胞蛋白,经Western blot检测,与CON 组比较,MOD 组细胞Bax、Caspase-3和NF-κB p65 蛋白表达均显著增加,Bcl-2 和IκBα蛋白表达显著下降,差异均有统计学意义(P<0.05);与MOD 组比较,ICA10、20、40 μmol/L 处理时可以降低Bax、Caspase-3 和NF-κB p65 蛋白的表达,提高Bcl-2 和IκBα 蛋白表达,具有统计学意义(P<0.05),且呈剂量依赖性(图3)。

注:与CON 组相比,**P<0.01;与MOD 组相比,##P<0.01。
3 讨论
AS 是一种累及动脉血管壁的慢性炎症疾病,随着生活水平和生活方式的改变,AS 呈现逐年上升趋势,其发生发展与很多疾病紧密相关,比如肥胖病、高血压、糖尿病及高胆固醇血症等[11]。 目前他汀类药物是预防和治疗动脉粥样硬化的常用药物,但是他汀类药物可能会出现肌痛、肌炎和横纹肌溶解等肌肉病症,严重情况下还可能引起急性肾衰竭和肝功能受损[12]。
淫羊藿来源于小檗科多年生草本植物淫羊藿、箭叶淫羊藿、柔毛淫羊藿或朝鲜淫羊藿的干燥叶,其性温而味辛、甘,归肝、肾经,中医临床多用于肾阳虚衰,阳痿遗精,筋骨痿软,风湿痹痛,麻木拘挛等症。 淫羊藿具有悠久的药用历史,开始记载在《神农本草经》中。 现代的实验研究发现,淫羊藿中含有多种化学成分,其中以黄酮类为主要化学成分,还包括酚苷类、多糖类、生物碱类等其他多种化学成分,淫羊藿具有多种药理作用,比如抗炎、抗肿瘤、抗衰老和抗骨质疏松等[13]。 淫羊藿苷(ICA)是淫羊藿的主要活性成分之一,分子式为C33H40O15,分子量为676.65[14],是一种黄酮类的化合物,。 既往研究多集中于淫羊藿苷抗骨质疏松、抗炎、抗肿瘤和免疫调节等药理作用方面,最近几年来,越来越多的研究者们开始将研究目标转移到ICA 对心血管系统的作用上,在ICA 抗AS、抗高血压、抗心肌缺血等很多方面均取得了一些崭新的科研成果。本课题组对ICA 具有较为系统和深刻的药理学研究,目前成果主要集中在药物安全性评价;对ApoE-/-小鼠的抗AS 作用及治疗价值研究[15];对体外培养的平滑肌细胞药理作用及机制研究[16]。 基于此,本研究以巨噬细胞为切入点,明确ICA 对巨噬细胞凋亡及炎症因子的影响,从而揭示ICA 抗动脉粥样硬化的作用。
巨噬细胞在AS 的形成、发生以及发展中发挥至关重要的作用,参与着全过程[17]。 巨噬细胞凋亡在AS 病变早期可以抑制AS 的发生进程,但是在病变晚期,巨噬细胞降解细胞内脂质的能力下降,巨噬细胞凋亡则导致不稳定斑块的破裂,从而加速AS的发生进程[18]。 单核细胞迁移至内皮下分化形成巨噬细胞,巨噬细胞吞噬ox-LDL 形成泡沫细胞,泡沫细胞的形成是AS 发展过程中的一个典型事件[19]。 用ox-LDL 刺激巨噬细胞分化成泡沫细胞是研究AS 的经典模型,本研究在此模型上研究ICA的体外抗动脉粥样硬化作用及其机制。 结果表明,加入不同浓度的ICA 处理24 h 后,经ox-LDL 诱导的巨噬细胞细胞活力增加,凋亡细胞数减少;细胞泡沫化减少;IL-1β、IL-6 和TNF-α 炎症因子分泌减少,表明ICA 具有减少巨噬细胞凋亡并抑制IL-1β、IL-6 和TNF-α 炎症因子分泌的作用,提示ICA 具有抗AS 的药理作用。
在病理状态下,细胞内源性凋亡通路会在巨噬细胞吞噬ox-LDL 的过程中被激活[20]。 Bcl-2 是定位在线粒体膜上的一种蛋白,与Bax 蛋白共同形成异源二聚体,从而来控制线粒体膜的通透性,防止细胞色素C 的流出而激活下游Caspase-3 凋亡蛋白引发内源性凋亡[21-22]。 当泡沫细胞出现生存障碍时,泡沫细胞会发生破裂,从而释放出大量的炎症因子和脂质吞噬物[23-24],进一步导致不稳定斑块的形成和破裂。 刘学谦等[25]发现清心通脉饮可降低巨噬细胞的凋亡,其机制与降低促凋亡蛋白Bax 的表达,增加Bcl-2 蛋白表达有关;赵正等[26]研究发现TM 可引起Caspase-3 活性增加,诱导泡沫细胞凋亡,与ox-LDL 诱导的巨噬细胞泡沫化和凋亡结果相符;林徐泽等[27]研究表明脂肪因子Omentin-1 可显著抑制巨噬细胞的凋亡,其机制与Omentin-1 促进巨噬细胞抗凋亡蛋白Bcl-2 的表达,抑制Bax 及Caspase-3 的蛋白表达有关。 本研究结果表明,与CON 组相比,MOD 组Bax 和Caspase-3 蛋白表达增加,Bcl-2 蛋白表达减少;与MOD 组相比,ICA 将不同程度降低Bax 和Caspase-3 蛋白的表达,并提高Bcl-2 蛋白表达,并且呈剂量依赖性,与上述研究结果一致,表明ICA 可激活细胞内源性凋亡途径引起细胞凋亡。
Park 等[28]研究发现, NF-κB 的激活能够抑制巨噬细胞的凋亡,这一现象的发现提示可能与级联放大炎症反应相关。 NF-κB 的抑制因子是IκB,IκB与NF-κB 结合后,能够阻止NF-κB 转移到细胞核内。 当细胞处于静息状态时,NF-κB 和IκB 结合形成没有活性的复合体,存在于胞浆中,当外界信号的刺激细胞后,IκB 激酶复合体则将IκB 磷酸化,使NF-κB 暴露出核定位的相关位点。 游离的NF-κB迅速进入到细胞核中,与特异性κB 序列结合,诱导基因转录,进而抑制巨噬细胞凋亡。 本研究中,MOD 组NF-κB p65 蛋白表达增加,IκBα 蛋白表达减少。 ICA 处理后发现:ICA 将不同程度地提高IκBα 蛋白表达,降低NF-κB p65 蛋白的表达,并且呈剂量依赖性,与以往人们研究结果一致,表明ICA能够激活NF-κB 活性抑制巨噬细胞凋亡。 综上所述,本研究在细胞水平证实了ICA 可以提高巨噬细胞活性并减少细胞凋亡,抑制相关炎症因子的释放,激活细胞内源性凋亡途径和NF-κB 活性抑制凋亡蛋白的表达,为ICA 抗AS 的研究提供了实验证据。

