Lipin基因表达与宫内发育迟缓大鼠肝脏脂肪含量的相关性研究
卞京 陈平洋 卞读军 贺晓日 Alpha Kalonda Mutamba 王涛
(1.湖南师范大学生命科学院,湖南长沙 410006;2.中南大学湘雅二医院儿童医学中心新生儿专科,湖南长沙 410011;3.中南大学湘雅二医院放射科,湖南长沙 410011)
宫内发育迟缓(intrauterine growth retardation,IUGR)指胎儿在宫内生长势能偏离导致生长发育速度低于正常,本质上是发生在孕期的任何生物学进程偏离正常导致胎儿生长受限[1]。近来的流行病学研究显示宫内营养不足可以改变组织器官发育和代谢,孕期低蛋白饮食导致营养不良的胎儿显示一种“节俭表型”,青春期出现追赶性生长,成年后易患肥胖症和2型糖尿病、血脂异常等代谢综合征[2]。代谢紊乱与糖和脂肪酸代谢有关,肝脏和脂肪组织是脂质代谢的关键部位,这些部位的结构异常会影响脂质代谢[3]。IUGR 动物模型显示程序化的脂肪细胞,例如:内在的脂肪生成增强和脂肪细胞增生导致了肥胖的发生,主要原因是发育程序化作用,脂肪组织被确定为程序化的主要靶目标之一[4]。脂素基因包括Lipin1、Lipin2、Lipin3,主要功能是发挥三酰甘油、磷脂合成作用[5],同时调节脂肪酸利用和脂肪合成基因的表达,双向调控脂肪代谢[6]。Lipin基因表现出组织特异性表达,Lipin1基因在脂肪组织中高度表达,而Lipin2基因主要在肝脏中表达[7]。
氢质子磁共振波谱(1H proton magnetic resonance spectroscopy,1H-MRS)脂肪定量分析是最近发展起来的新型影像学研究方法,有文献报道其结果与病理结果具有良好的相关性[8]。目前,虽然肝脏脂质评估仍然需要肝脏活检,但是,活检是一种侵入性检查,会带来潜在的损害。相比之下,1H-MRS 是无创的肝脏代谢生化指标变化及定量分析的方法,具有可重复性。通过计算水和脂肪对应的波谱曲线下面积,可以间接用波谱技术量化脂肪含量[9]。
IUGR 动物模型的可视化影像学研究具有无创、直观、动态、可重复性的特点,同时探讨与Lipin基因表达的相关性,从分子影像学到基因-影像的关联,尤其动态研究具有重要的临床前意义。本研究目的是观察IUGR仔鼠内脏脂肪组织Lipin1、肝脏Lipin2的表达与肝脏脂肪含量的动态变化,探讨IUGR仔鼠Lipin基因的表达与肝脏脂肪含量的相关性。
1 材料与方法
1.1 动物模型
Sprague-Dawley(SD)孕鼠20只由中南大学湘雅二医院实验动物中心提供,实验方案已获得我院实验动物伦理委员会批准(2020169)。将孕鼠随机分为对照组和IUGR 组(每组10 只)。对照组孕鼠在孕期使用正常蛋白饲料喂养(蛋白含量21%),IUGR 组孕鼠在孕期使用低蛋白饲料喂养(蛋白含量10%),造模方法参考文献[1]。将两组孕鼠分娩的新生仔鼠分别纳入到对应的IUGR组和对照组。
在21 d 的哺乳期,IUGR 组和对照组母鼠均用正常蛋白饲料和正常饮水喂养;断乳后,IUGR 组和对照组仔鼠均用正常蛋白饲料和正常饮水喂养至生后12周。分别在生后1 d、1周、3周、8周和12周测量仔鼠体重。在3周、8周和12周测量仔鼠身长和腹围,同时计算体重指数(body mass index,BMI)。
1.2 磁共振检测
大鼠分别在生后3 周、8 周、12 周进行3.0T1H-MRS 检测,禁食6 h 后,用10%水合氯醛(0.35 mL/100 g)麻醉,利用支架固定位置后,仰卧位放进12通道大鼠线圈,肝区放置在线圈中央,腹部使用垫片固定,使用绷带绑住腹部能部分减少呼吸运动伪影。采用飞利浦公司Achieva 3.0T 磁共振扫描仪,常规采用快速自旋回波行横断位、矢状位、冠状位扫描。T1 加权成像(weighted imaging,WI):重复时间 (repetition time,TR)10 ms, 回 波 时 间 (echo time, TE) 2.3/3.4 ms;T2WI:TR 3 392 ms,TE 100 ms。采集次数 3 次;层厚1.5 mm,层间距0.1 mm,采集矩阵256×192,视野14 cm。
1H-MRS:选用常规横断位、冠状位及矢状位T2WI 定位波谱感兴趣区 (region of interest,ROI),注意避开大血管、胆囊、大胆管、皮下脂肪和肠道。运用多体素点分辨波谱分析(point-resolved spectroscopy,PRESS)序列加抑水/不抑水采集,匀场由扫描仪自动完成,必要时手动匀场,水抑制用手动选择最佳抑水点,使水峰半高全宽(full width at half maximum,FWHM)≤20。采集参数为TR 2 000 ms,TE 38 ms, 扫 描 体 素 是 10 mm×10 mm×15 mm,运用扫描仪所带工作站波谱分析软件进行数据处理后直接得到水峰面积(Iwater)和脂峰面积 (Ifa)t,使用公式Ifat/(Iwater+Ifa)t计算肝脂肪含量。波谱扫描结果由2位放射学医师共同观察判定其合格性,结合波谱图基线是否基本平稳、波峰是否可辨认及背景噪声等综合判断。基线严重变形,脂肪峰很宽、变形或难以辨认等被视为不合格。每组各时间点检测10 只大鼠,若出现不合格指标,则进行样本替补。
1.3 组织病理学
使用颈椎脱臼法处死IUGR 大鼠,收集生后1 d、1 周、3 周、8 周和 12 周肝组织。收集生后3周、8周和12周内脏脂肪组织。样品在液氮罐冷冻,0.4%多聚甲醛固定并石蜡包埋。
1.4 RT-qPCR法检测mRNA表达
肝脏和内脏脂肪组织样本存储在-80°C 超低温冰箱,按照生产商的说明书使用TRIzol 试剂盒(Invitrogen 公司,美国)提取总RNA。使用mRNA逆转录试剂盒(Thermo Fisher 公司,美国) 将RNA 逆转录得到cDNA,并以该cDNA 为模板,用针对目的基因设计合成的引物进行扩增,检测细胞或组织样本中目的基因的表达。PCR 扩增使用SYBR Green qRCR Mix(TOYOBO 公司,日本)试剂盒。Lipin 1和Lipin 2的基因序列和β-actin引物序列见表1,其设计及合成由长沙艾佳生物技术有限公司完成。PCR 反应条件:预变性95℃3 min;95℃变性30 s,60℃退火延伸30 s,共进行40个循环。绘制样本的内参基因β-actin和目的基因Lipin1、Lipin2的标准曲线。△Ct实验组=Ct(目的基因)-Ct(β-actin),△Ct 对照组=Ct(目的基因)-Ct(β-actin),通过反对数得到C值,原始浓度=浓度C×10,结果以目的基因和β-actin的比值表示。

表1 Lipin1、Lipin2和β-actin基因引物设计
1.5 Western blot法检测蛋白表达
称量肝脏和内脏脂肪组织,置于离心管中。在冰上将离心管中的组织剪切成细小碎片并加入裂解液。用电动组织匀浆器以转速15 000 r/min 进行匀浆,每次10 s,间隔10 s,直至组织充分裂解。再以13 000 r/min 离心20 min,取上清液,加入5×还原样品缓冲液,4℃分装保存,待测。BCA 蛋白浓度测定法测定各样本蛋白浓度。取20 μg 蛋白样本,采用5%浓度浓缩胶电泳20 min,再经不同浓度(8%~12%)分离胶电泳分离蛋白条带,然后90 V电压转印40 min,用5%牛血清白蛋白室温封闭NC膜2 h,洗膜后滴加蛋白特异性一抗Lipin 1(Abcam,英国,稀释比1∶1 000)或Lipin 2(Abcam,英国,稀释比1∶300),4℃孵育过夜,再滴加二抗溶液(湖南艾佳生物科技股份有限公司)(1∶15 000)孵育1 h,加入新鲜配制的显色液显色至条带清晰呈现后终止染色。采用Image J图像处理软件对Western blot 结果进行灰度分析,结果以目的蛋白(Lipin2 和Lipin1)与内参β-actin蛋白条带的积分光密度比值表示。
1.6 统计学分析
采用SPSS 23.0 统计软件对数据进行统计学分析。计量资料以均数±标准差()表示,两组间比较采用两样本t检验;采用Pearson相关分析Lipin 及其蛋白表达与肝脏脂肪含量的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 IUGR组和对照组仔鼠一般资料比较
两组孕鼠均在受孕后第20~23天产仔鼠,未发生流产现象。对照组和IUGR 组仔鼠总数分别为112只和105只。每组分别取10只观察生后3周、8周、12周时的一般资料,IUGR组仔鼠平均出生体重(5.4±0.5)g,低于对照组仔鼠平均出生体重[(6.6±0.3) g](t=7.781,P<0.05)。IUGR 组仔鼠生后1 周体重(12.0±0.4)g,低于对照组仔鼠生 后 1 周 体 重 [ (15.3±0.3) g](t=20.948,P<0.05)。生后 3 周时,IUGR 组仔鼠体重、身长、BMI 均低于对照组(P<0.05),两组腹围比较差异无统计学意义(P>0.05)。生后8 周时,IUGR 组仔鼠体重、BMI、腹围超过对照组(P<0.05),两组身长比较差异无统计学意义(P>0.05)。生后12周时,IUGR 组仔鼠体重、BMI、腹围亦超过对照组(P<0.05),两组身长比较差异无统计学意义(P>0.05)。见表2。
表2 两组仔鼠一般资料比较 (,n=10)
表2 两组仔鼠一般资料比较 (,n=10)
注:[BMI]体重指数。
BMI身长(cm)images/BZ_104_525_1200_813_1259.pngimages/BZ_104_1100_1200_1388_1259.pngimages/BZ_104_1388_1200_1673_1259.png6.6±0.4 7.9±0.7images/BZ_104_1673_1200_1958_1259.pngimages/BZ_104_813_1200_1100_1259.pngimages/BZ_104_237_1377_525_1495.png组别对照组IUGR组images/BZ_104_525_1377_813_1495.png5.5±0.6 4.4±0.5 7.6±0.8 8.4±0.6images/BZ_104_813_1377_1673_1495.png10.4±0.3 9.5±0.4images/BZ_104_1673_1377_1958_1495.png17.4±1.0 18.2±1.0 12周21.7±0.8 21.4±1.1 0.683 0.503images/BZ_104_237_1513_525_1631.pngimages/BZ_104_525_1513_1411_1572.png对照组IUGR组7.8±0.6 8.2±0.4体重(g)images/BZ_104_525_1572_1411_1631.png17.3±1.3 18.5±0.9 12周348±43 394±29 2.865 0.010images/BZ_104_1411_1572_1652_1631.pngimages/BZ_104_237_1749_1119_1867.png16.1±0.8 16.9±0.5images/BZ_104_1119_1749_1652_1867.png59±4 40±3images/BZ_104_1652_1749_1948_1867.png8周220±26 247±23
2.2 两组仔鼠内脏脂肪组织Lipin1 mRNA 及其蛋白表达变化
生后3周、8周、12周时,IUGR组仔鼠内脏脂肪组织Lipin1 mRNA及其蛋白表达水平均高于对照组(P<0.05),见表3和图1。
表3 两组仔鼠内脏脂肪组织Lipin1 mRNA及其蛋白相对表达比较 (,n=10)
表3 两组仔鼠内脏脂肪组织Lipin1 mRNA及其蛋白相对表达比较 (,n=10)
images/BZ_104_237_2342_516_2460.pngimages/BZ_104_516_2342_1385_2401.png蛋白对照组IUGR组images/BZ_104_237_2578_813_2696.png3周1.01±0.17 1.28±0.08 8周1.21±0.28 1.44±0.16images/BZ_104_813_2578_1385_2696.png12周1.23±0.18 1.53±0.14images/BZ_104_1385_2578_1671_2696.png3周0.34±0.17 0.66±0.06images/BZ_104_1671_2578_1957_2696.png8周0.49±0.08 0.73±0.14 12周0.52±0.19 0.88±0.12 4.869 0.001
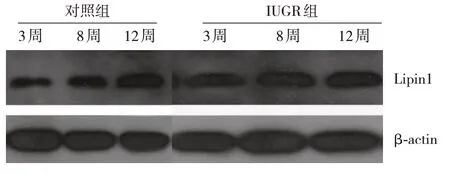
图1 对照组与IUGR组仔鼠内脏脂肪组织Lipin1蛋白表达条带图
2.3 两组仔鼠肝脏组织Lipin2 mRNA 及其蛋白表达变化
生后1 d时IUGR组肝脏组织Lipin2 mRNA及其蛋白表达水平低于对照组(P<0.05),而生后1周、3 周、8 周、12 周时 Lipin2 mRNA 及其蛋白表达水平均高于对照组(P<0.05),见表4和图2。
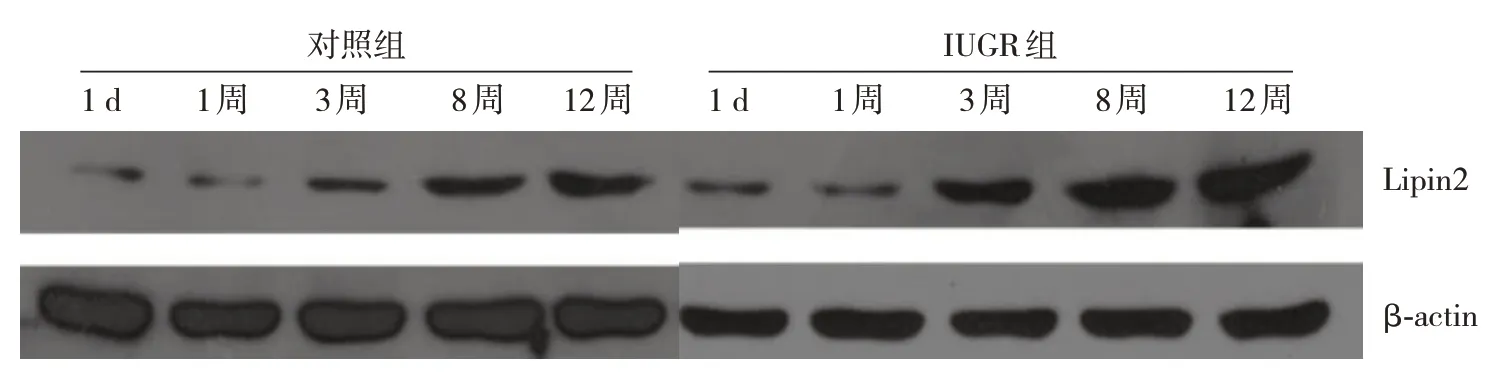
图2 对照组与IUGR组仔鼠肝脏组织Lipin2蛋白表达条带图
表4 两组仔鼠肝脏组织Lipin2 mRNA及其蛋白相对表达比较 (,n=10)

表4 两组仔鼠肝脏组织Lipin2 mRNA及其蛋白相对表达比较 (,n=10)
images/BZ_105_237_414_386_532.pngimages/BZ_105_386_414_1315_473.png蛋白对照组IUGR组images/BZ_105_386_473_1315_532.pngimages/BZ_105_237_650_572_768.png1.20±0.05 1.00±0.10images/BZ_105_572_650_758_768.png0.97±0.24 1.26±0.27images/BZ_105_758_650_943_768.png1.19±0.13 1.40±0.23images/BZ_105_943_650_1129_768.png1.18±0.07 1.57±0.25images/BZ_105_1129_650_1315_768.png1.24±0.05 1.48±0.14images/BZ_105_1315_650_1501_768.png1 d 0.48±0.14 0.32±0.09images/BZ_105_1501_650_1687_768.png1周0.37±0.08 0.54±0.15images/BZ_105_1687_650_1873_768.png3周0.56±0.34 0.93±0.32images/BZ_105_1873_650_2059_768.png8周0.96±0.31 1.23±0.21 12周0.94±0.08 1.46±0.39 4.101 0.001
2.4 两组仔鼠肝脏脂肪含量的变化
生后3 周时,IUGR 组仔鼠和对照组肝脏脂肪含量比较差异无统计意义(P>0.05),生后8 周、12周时,IUGR组仔鼠肝脏脂肪含量显著高于对照组(P<0.05),见表5。
表5 两组仔鼠肝脏脂肪含量比较 (,%,n=10)

表5 两组仔鼠肝脏脂肪含量比较 (,%,n=10)
images/BZ_105_1284_1881_1524_1999.png组别对照组IUGR组images/BZ_105_1524_1881_1764_1999.png3周3.4±0.3 3.8±1.0images/BZ_105_1764_1881_2004_1999.png8周3.9±0.6 7.6±0.9 12周4.8±0.6 8.5±0.7 12.772 0.001
2.5 肝脏脂肪含量与Lipin mRNA及其蛋白表达的相关性分析
IUGR 组大鼠 Lipin1 蛋白和 mRNA 表达与肝脏脂肪含量呈正相关(分别r=0.628、0.521,P<0.05),Lipin2 蛋白和mRNA 表达与脂肪含量呈正相关(分别r=0.601、0.524,P<0.05),见图3。

图3 肝脏脂肪含量与Lipin mRNA及其蛋白表达的相关分析图
3 讨论
宫内环境异常可能通过发育程序化的途径,引发出生后机体生理和代谢永久性的改变,增加成年期代谢性疾病发生的危险性[10]。导致IUGR肥胖的机制已经在动物模型上进行广泛的研究,脂肪组织被确定为程序化的主要目标之一[11]。制造IUGR 动物模型,可使用多种方法,如孕期营养限制、子宫胎盘结扎、糖皮质激素暴露、烟熏等方法,营养不足或过度都会通过表观遗传机制影响后代基因表达[12],这是健康和疾病发育起源理论的潜在分子机制[13]。IUGR动物模型提供了进一步的证据来支持以下假设,即子宫内生长受限的各种缺陷会导致三酰甘油代谢受损和成年期肥胖,并且在某些情况下,诱导的表型会影响多代[14]。孕期营养限制导致后代脂肪组织增多,脂肪细胞中Lipin1和Lipin2的过度表达导致三酰甘油积累增加[15]。本研究IUGR模型显示在出生3周后体重追赶生长,在8周时补偿和加速追赶生长出现早发性肥胖和血脂异常,过多的脂肪组织堆积。快速沉积的脂肪组织在12周可能导致肥胖和胰岛素抵抗。
IUGR 动物模型研究发现,由于脂肪功能紊乱出现不成比例的内脏脂肪组织沉积[16],IUGR大鼠成年期出现能量摄入增加,空腹血糖、总胆固醇和三酰甘油水平升高,呈现出高血脂和肝脏脂肪堆积,可能与IUGR大鼠的食欲增强和转录水平上调及脂肪酸氧化相关基因调节紊乱有关[17]。Lipin基因作为磷脂酸磷酸酶,是脂质合成和转录辅助活化因子所必需的。Lipin1主要表达于脂肪细胞和骨骼肌,Lipin2主要表达于肝脏[18]。本研究收集来源于肠系膜和网膜的内脏脂肪组织,分析发现3周、8 周、12 周 IUGR 组Lipin1基因表达高于对照组。出生1 d时的IUGR组仔鼠肝脏Lipin2表达量比对照组降低,说明IUGR组仔鼠在宫内或者刚出生时肝脏代谢较对照组减弱,证实了“脑保护效应”的学说,即受IUGR的影响,为了保证优先脏器如脑的发育,外周组织器官(如肝脏、脂肪等)代谢减弱。1周以后,IUGR组仔鼠肝脏Lipin2表达量持续高于对照组,显示IUGR仔鼠出生后处于正常营养的饮食状态时,出现追赶生长,IUGR组Lipin1和Lipin2在3~12周表达增强,推测IUGR仔鼠发育期肝脏代谢水平可能处于一种较对照组偏高的代谢状态。这一过程提示当IUGR形成的代谢状态与生后营养环境不相协调时,可能改变了肝脏的发育轨迹,导致物质代谢发生一定程度的紊乱,有可能导致代谢综合征的发生。
1H-MRS 是一种无创诊断技术,被认为是一种灵敏且可重复的定量肝脏脂质含量的影像学方法[19]。磁场强度增加波谱分辨率更高,肝脏脂质含量测量更准确。因为1H-MRS 检测的水信号平均浓度在肝脏比其他代谢物的浓度高数倍,必须进行水抑制。同时需要不抑制水的扫描来获得一个相同的体素参考信号[20]。波谱中的脂质信号来自脂质、脂肪酸和三酰甘油,主要是脂质前体或脂质分解产物,来自脂质脂肪酸链的甲基。在本研究中,IUGR 大鼠在生后8 周和12 周时肝脏脂肪含量显著高于对照组大鼠。说明肝脏和脂肪组织结构的变化发生在IUGR大鼠出生后的发育时期,表明1H-MRS 检测的脂肪含量能反映IUGR 大鼠脂质代谢情况。
1H-MRS 可以作为非侵入性方法部分替代组织病理学,磁共振成像对实验动物活体组织能准确评估肝脏脂肪[21]。三酰甘油积累是脂肪变性的组织病理学特征,磁共振的主要优势是它直接对三酰甘油显像的化学特异性。对于检测轻度脂肪变性,磁共振检查方法具有较高灵敏度和特异度[22]。本研究结果显示Lipin1蛋白及其mRNA表达水平与脂肪含量呈正相关,而Lipin2蛋白及其mRNA表达水平与脂肪含量呈正相关,提示肝脏脂肪含量与Lipin1和Lipin2基因的表达水平呈正相关。基于1H-MRS 的脂质测量,比组织病理学方法后处理时间更少,不需要牺牲动物,很容易进行重复随访,1H-MRS 广泛使用在动物实验中可能会部分节约实验动物数量。
总之,本研究表明,1H-MRS 能无创性测量IUGR大鼠肝脏脂肪含量,IUGR大鼠存在相关的脂质代谢异常。肝脏脂肪含量与Lipin1和Lipin2基因的表达呈正相关。IUGR 大鼠内脏脂肪组织Lipin1和肝脏组织Lipin2 mRNA及其蛋白表达上调可引起肝脏1H-MRS脂肪含量增加。1H-MRS能够无创测量IUGR 大鼠肝脏脂肪含量,为纵向临床前研究提供了可靠依据。本研究也存在几个局限性。首先,本研究中的大鼠自我调节食物摄入量,IUGR 大鼠和对照组大鼠之间的食物消耗量没有差异。其次,本研究使用临床大孔径磁共振扫描仪代替专用的小动物磁共振扫描仪,图像质量有待进一步提高。第三,成像时大鼠自由呼吸,可引起伪影,由于目前大鼠呼吸和心电指标在临床磁共振仪器尚无法检测到,因此呼吸或者心电门控技术尚无法使用。

