窒息新生儿生后一周内肠道菌群产气差异分析
张华婷,尹迪,王雪芳,管坤玉,龚小慧,胡勇
(上海交通大学附属儿童医院,上海市儿童医院 新生儿科,上海 200062)
新生儿窒息是指产前、产时、产后多种原因引起的新生儿缺氧缺血,可造成患儿的细胞代谢功能障碍,对其脑、心、肺、肾及消化道等多器官功能产生影响。窒息患儿早期胃肠道供氧供血减少,多有胃肠道功能紊乱症状,常表现为腹胀、肠鸣音减弱或消失等喂养不耐受表现,甚至并发新生儿坏死性小肠结肠炎。2017年我国一项多中心研究表明,新生儿窒息尤其是重度窒息患儿多存在不同程度的胃肠功能障碍,且多器官损害发生率可达40%以上[1],成为发展中国家新生儿时期死亡和儿童致残的主要原因之一[2],严重威胁新生儿健康。
目前普遍认为人类肠道菌群在新生儿甚至胎儿期即开始定植,胎盘、羊水、胎粪等均可检测到一定数量的细菌[3- 5],出生方式、喂养、胎龄以及外界因素可不同程度影响肠道菌群定植[6]。健康的肠道菌群参与构建稳定的肠道生态系统,肠道气体是人体肠道环境的重要组成部分,主要由肠道菌群分解代谢肠腔内碳水化合物产生[7],共同参与儿童生长过程中营养物质代谢、驱动免疫成熟、维持胃肠功能、影响神经内分泌及行为等[8],对婴儿生长发育乃至成年后的健康有深远的影响。
本研究使用国内首台体外发酵系统与气体分析仪,收集窒息新生儿和对照组新生儿出生1周内的粪便样本,基于不同底物分别进行体外发酵,检测发酵产物中几种主要气体的含量,并基于体外模拟平台,批量液体培养肠道菌群,同时体外发酵不同碳水化合物后进行产气测定,探讨肠道产气在胃肠功能中的临床意义。基于此,探究窒息新生儿肠道菌群产气特征,为避免腹胀、新生儿坏死性结肠炎等状况的发生提供理论依据,为窒息新生儿治疗提供参考。
1 对象、材料与方法
1.1 研究对象
选取2020年8月至12月间我院新生儿科收治的窒息新生儿,设为窒息组,纳入标准:(1) 符合中华医学会围产医学分会新生儿复苏学组新生儿窒息诊断标准之一[9]:①Apgar评分1 min≤7分或5 min≤7分,伴脐动脉血pH值<7.2;②未取得脐动脉血气分析结果的,Apgar 评分≤7分;(2) 足月儿,出生后24 h内入院;(3) 单胎;(4) 患儿母亲年龄20~40岁,无特殊饮食习惯。同时以我院非窒息新生儿作为对照组,纳入标准:(1) 出生后24 h内入院;(2) 新生儿生后无窒息复苏史,无败血症等;(3) 单胎;(4) 新生儿母亲年龄20~40岁,无特殊饮食习惯;并在性别、出生方式上与研究组患儿进行匹配。两组新生儿住院期间以人工喂养为主,两组研究对象排除标准:(1) 存在先天性消化道畸形;(2) 存在遗传代谢性疾病;(3) 未同时采集到出生后第1、第7天粪便样本;(4) 出生后1周内有益生菌制剂使用史。
本研究通过我院医学伦理委员会审查,所有入组新生儿家长均签署知情同意书,按照“知情同意、自愿参加”原则参与本研究。
1.2 研究材料与方法
1.2.1 标本采集和处理 采用同一规格无菌粪便收集盒收集入组患儿生后第1、第7天的新鲜粪便,于4~6 h内送达实验室进行处理。采集时用无菌棉签刮取尿不湿表面的新鲜粪便,尽量避免尿液污染,将新鲜粪便加入厌氧磷酸盐缓冲液(PBS,pH 7.0)配制成质量浓度为100 g·L-1的混悬液,混匀后用0.125 mm的无菌金属筛过滤除去大的食物残渣待用。
1.2.2 体外培养发酵 配置体外厌氧发酵培养基YCFA为基础培养基,成分为:胰蛋白胨10 g·L-1;酵母提取物2.5 g·L-1;L- 半胱氨酸1 g·L-1;血红素2 ml·L-1;NaCl 0.9 g·L-1;CaCl2·6H2O 0.09 g·L-1;KH2PO40.45 g·L-1K2HPO40.45 g·L-1;MgSO4·7H2O 0.09 g·L-1;维生素I 200 μl·L-1;刃天青(1 g·L-1)1 ml。其中维生素I 溶液配方为:生物素0.05 g·L-1,钴胺素0.05 g·L-1,对氨基苯甲酸0.15 g·L-1,叶酸0.25 g·L-1,吡哆胺0.75 g·L-1。向基础培养基中分别以8 g·L-1浓度加入下列4种碳水化合物:低聚果糖(FOS)、母乳低聚糖(FL- 2)、低聚半乳糖(GOS)、乳糖(LAT),构建4种不同碳源培养基。
体外发酵实验以批量厌氧发酵的形式进行。将500 μl处理好的新鲜粪便悬液分别接种到5 ml上述4种培养基中,放置于37 ℃的恒温培养箱中培养24 h。培养结束后,采用肠道微生物发酵气体分析仪检测其产气总量,以及二氧化碳(CO2)、氢气(H2)、甲烷(CH4)和硫化氢(H2S)4种气体的含量,并计算其各自的比例。
1.3 统计学处理
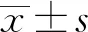
2 结 果
2.1 临床资料分析
2020年8月至12月间,我院新生儿科室共收治窒息新生儿61例,符合入组标准者35例,其中生后1周内死亡/放弃治疗1例,住院未满7 d 8例,未同时收集到生后第1、第7天粪便6例,最终入组20例患儿,设为窒息组;根据入组标准及性别、出生方式,匹配20例足月新生儿作为对照组,包括特发性围生期感染 10例、新生儿湿肺 4例、新生儿低血糖2例、心动过缓 1例、口腔肿物 1例、新生儿痤疮 1例、足月小样儿 1例。两组新生儿胎龄、出生体重比较,差异无统计学意义(P>0.05),见表1。

表1 两组新生儿一般临床资料比较
2.2 粪便发酵后产气总量
粪悬液发酵24 h后,两组4种培养基发酵液中均有气体产生。生后第1天窒息组患儿粪便发酵FL- 2后产气总量显著少于发酵FOS、GOS、LAT 3种底物者,而对照组发酵不同底物后产气总量差异无统计学意义。生后第7天窒息组患儿粪便发酵FL- 2后产气总量显著少于发酵FOS、LAT两种底物,对照组发酵GOS后产气总量显著低于发酵其他3种底物者。见图1A、B。两组间比较显示,生后第1天窒息组发酵FOS、GOS后产气总量显著高于对照组,生后第7天窒息组发酵GOS后产气总量显著高于对照组,见图1C、D。

a P<0.05, b P<0.01, c P<0.001
2.3 粪便发酵后产气成分分析
2.3.1 不同底物发酵的气体成分分析 生后第1天窒息组患儿粪便发酵FL- 2后产CO2量显著少于GOS、FOS两种底物者,产H2量显著低于FOS、GOS、LAT 3种底物者。生后第7天窒息组患儿粪便发酵FL- 2后产H2量显著低于FOS底物者。窒息组发酵LAT后产CH4量显著低于发酵FL- 2后,而产H2S量则显著高于GOS。见图2A、B。生后第1天对照组患儿粪便发酵不同底物后产气量差异无统计学意义,生后第7天粪便发酵GOS后产H2S量显著低于发酵FL- 2后,见图2C、D。

a P<0.05, b P<0.01, c P<0.001
纵向配对比较显示,生后第7天窒息组患儿粪便发酵GOS后产CO2、H2、H2S量均显著低于生后第1天,而窒息组粪便发酵LAT后产CH4量显著低于第1天,见表2。
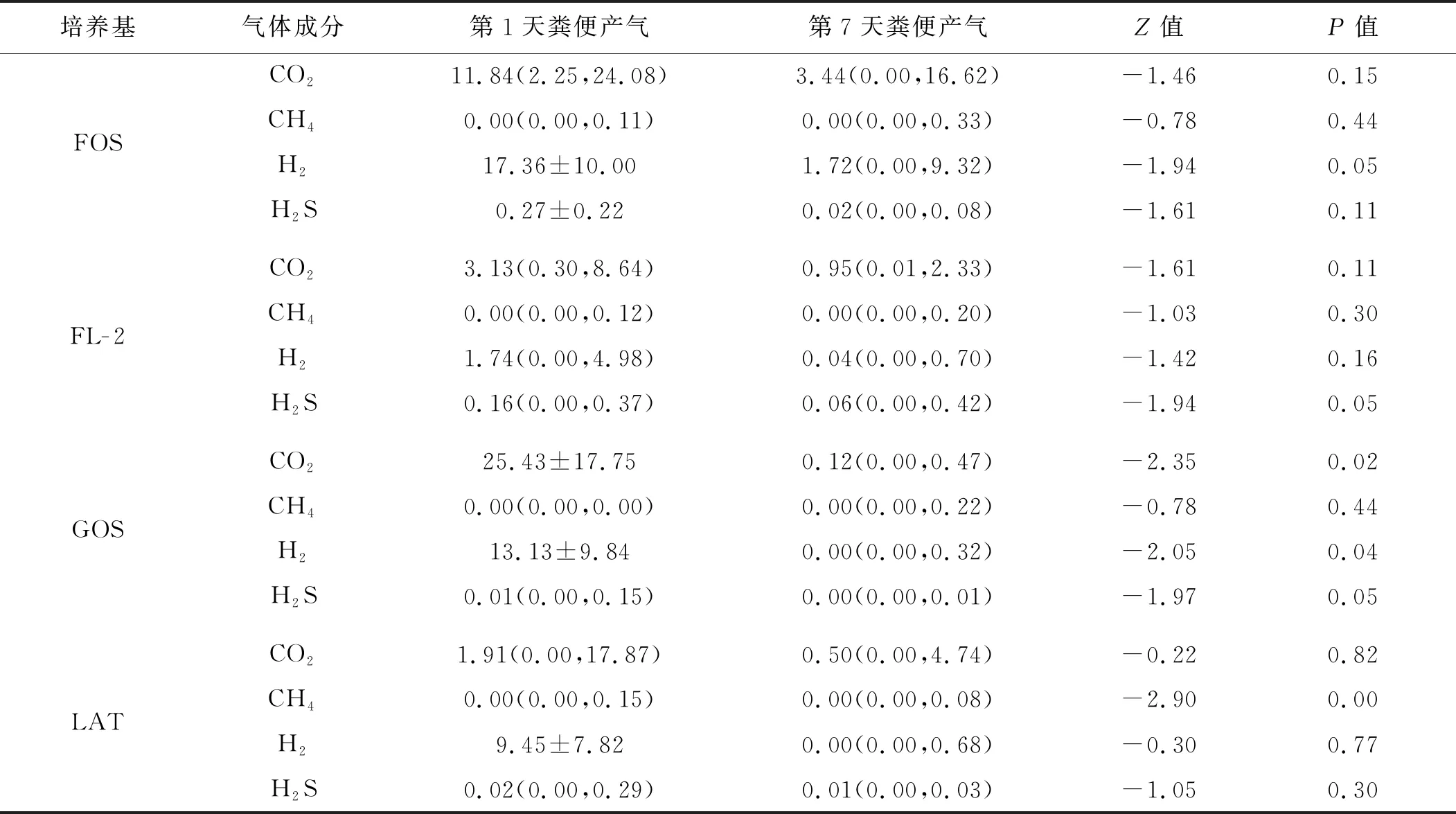
表2 窒息组新生儿粪便发酵后产气情况比较 %
2.3.2 两组新生儿生后1周内粪便产气成分比较 比较两组新生儿生后第1天粪便产气可见,窒息组粪便发酵FOS、GOS、LAT 3种底物后产CO2量均显著高于对照组,发酵4种底物后产CH4量均显著高于对照组,发酵FOS后产H2量明显高于对照组,发酵LAT后产H2S量明显高于对照组,见图3。
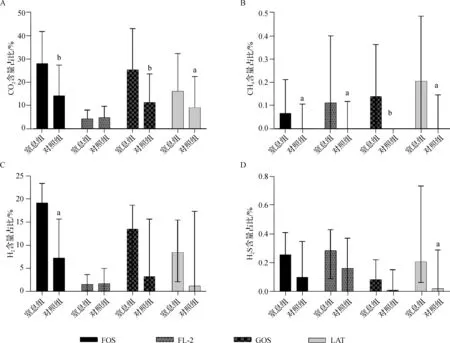
a P<0.05, b P<0.01, c P<0.001
生后第7天,窒息组粪便发酵FOS、GOS、LAT后产CO2量显著高于对照组,发酵FL- 2后产CH4量显著高于对照组,发酵GOS、LAT后产H2量显著高于对照组,发酵LAT后产H2S量显著高于对照组,见图4。
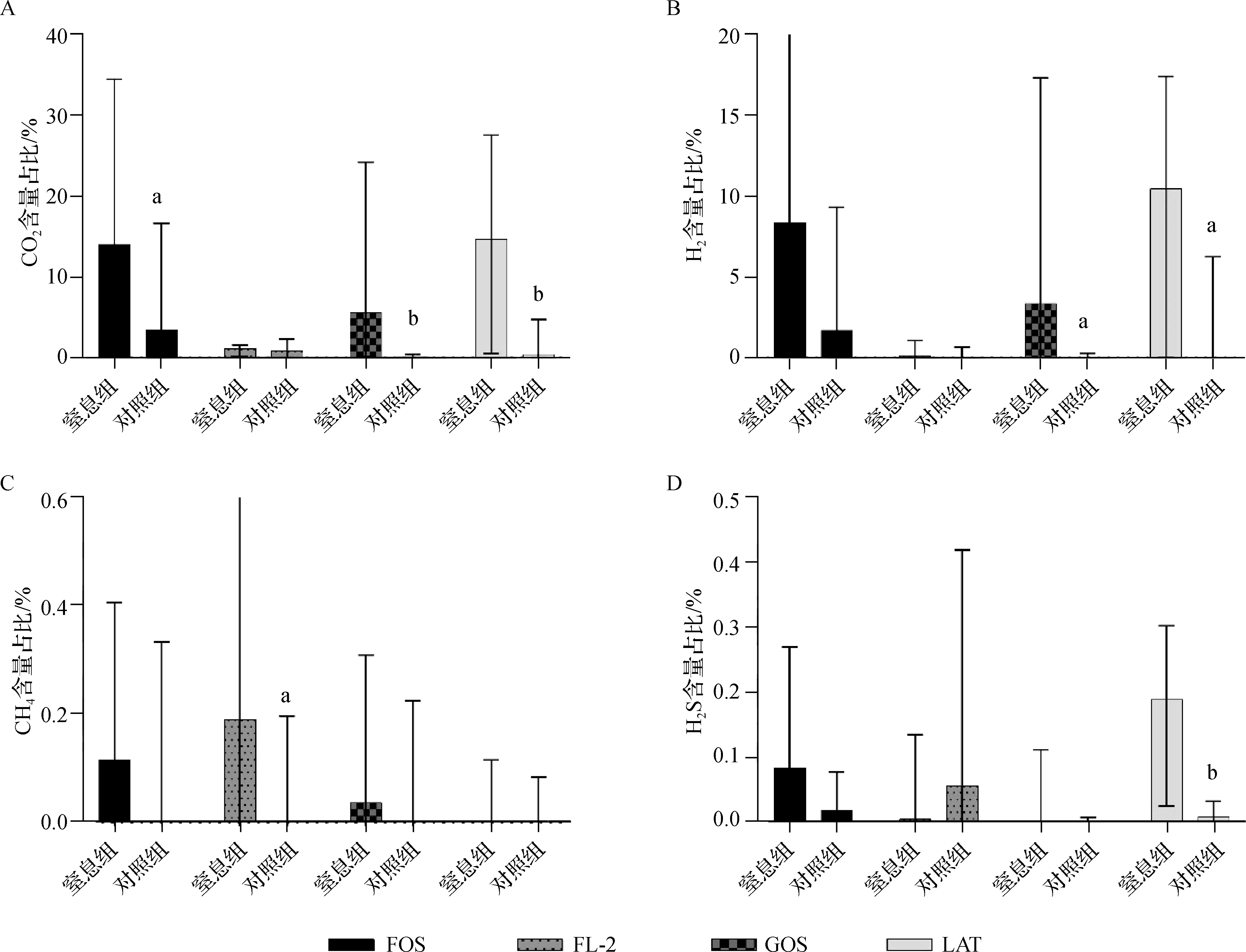
a P<0.05,b P<0.01,c P<0.001
3 讨 论
肠道内一定量的气体对维持正常肠道功能起重要作用,肠道菌群产气是肠腔内气体的重要来源,且受不同碳水化合物的影响。LAT是人乳重要成分之一,在消化道内的吸收依赖于乳糖酶,由于新生儿结肠乳糖酶发育不成熟,LAT多进入结肠由肠道菌群代谢利用。而FOS、GOS、FL- 2作为人类膳食中常见的低聚糖,几乎不被消化道前部吸收,经结肠由肠道菌群选择利用,可促进肠道内双歧杆菌等有益菌增殖,进而调节肠黏膜屏障、增加机体免疫力等[10]。FOS、GOS作为益生元普遍应用于婴幼儿配方乳粉中[11],FL- 2则广泛存在于人乳中,可促进有益菌定植,改善婴幼儿早期肠道健康[12]。临床上胃肠功能障碍、炎症性肠病以及新生儿坏死性小肠结肠炎等患儿病程中都有不同程度的气腹表现,提示肠腔产气紊乱。目前关于新生儿及窒息患儿肠道菌群产生气体研究不多,本研究结果显示,窒息患儿出生后第1天和第7天时,其粪便菌群利用GOS产生气体的总量均显著高于对照组,生后第1天的FOS和生后第7天的LAT中气体总量亦显著高于对照组,提示窒息新生儿肠道内菌群产气水平显著高于非窒息新生儿,与临床上窒息患儿易出现胃肠功能紊乱表现一致。
本研究进一步分析了主要气体的成分和差异,结果发现,窒息患儿的粪菌在以FOS、GOS、LAT为底物进行发酵时,均产生了显著高于对照组的CO2,仅在以FL- 2为底物时,产生的CO2含量与对照组基本一致,这证实窒息患儿早期适当肠外营养的合理性,且肠内喂养需提倡纯母乳喂养,过早摄入FOS以及GOS可使肠腔内CO2产生增加,增加肠腔内气体淤积,破坏患儿肠腔内气体平衡,成为窒息新生儿胃肠功能紊乱的重要影响因素,具体机制仍待进一步研究。
目前研究普遍认为肠道产CH4菌定植与年龄相关,3岁以前儿童呼出气内未检测到CH4[13]。一项儿童粪便研究表明,年龄小于27个月儿童粪便中未检测到产CH4菌,但3岁儿童粪便中40%可检测到产CH4菌[14],而成人肠内产CH4菌含量相对稳定[15]。本研究发现,对照组患儿4种培养基中产CH4量占比极低(<0.1%),提示新生儿肠道内可能无产CH4菌定植,这与既往研究相符。但窒息组患儿不同底物发酵后产CH4量相较对照组显著升高,占比相对恒定,提示窒息患儿肠道内存在产CH4菌可能,可利用肠道内H2和CO2产生CH4。研究认为肠道内CH4与肠易激综合征、肠道功能紊乱、慢性便秘等密切相关[16],CH4的产生可以消耗肠道内H2和CO2而减少气体体积[17],此外有研究显示CH4能减缓肠胃蠕动速度[18],具体作用机制尚未阐明。窒息患儿早期肠腔内CH4的存在对缓解肠道内积气有一定作用,但其对早期胃肠功能的影响尚待进一步研究。
H2对人体生理功能没有直接作用,常作为其他微生物菌的代谢原料,进一步发酵产生CH4、H2S等气体[19]。本研究发现,在以各种碳源为底物进行发酵时,窒息组患儿粪菌发酵产物中的H2含量偏高。1974年Newman[20]发现志愿者食用低聚糖含量丰富的豆类后呼出气内H2含量增加,并且出现腹部不适,且与H2含量呈正相关,乳果糖经肠道细菌发酵可产生大量H2[21],多种证据证实肠道H2含量与肠道菌群以及不同碳水化合物相关。本研究发现窒息组患儿生后1周内FL- 2培养基中H2含量占比最低,且与对照组比较差异无统计学意义,这一结论可为窒息患儿早期母乳喂养提供新的依据。
近年来有研究表明H2S是人体气体信号分子之一,H2S对肠缺氧再灌注损伤大鼠肠黏膜起保护作用[22]。Teague等[23]研究表明,H2S能够使大鼠回肠平滑肌舒张,抑制平滑肌运动。健康大鼠H2S合成减少可使肠道黏膜产生炎性损伤[24]。本研究两组患儿粪便发酵后均可检测到不同含量的H2S,窒息组在各个培养基中H2S含量均高于对照组,且LAT培养基中含量显著升高,提示窒息患儿肠道内H2S含量偏高。患儿早期肠黏膜功能尚未成熟,过量的H2S堆积可能是早期肠道炎性改变的原因之一。
总之,通过本研究,我们初步了解了窒息患儿肠道内菌群产气的特征,比较了肠道内气体主要成分的差异,为改善窒息患儿早期胃肠功能提供了新的思考方向。但本研究样本量少,采样点相对较少,尚需进一步扩大样本,深入研究窒息新生儿肠道气体的临床意义。

