典型六六六污染土壤热脱附修复后的生物响应效应
贾秀雯,李晓雪,王盼盼,史 怡,刘文菊,曹云者
(1.河北农业大学 资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071000;2.中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012)
六六六,作为有机氯广谱杀虫剂,曾在全球范围内广泛使用。其具有残留持久性,易在土壤中蓄积造成环境污染,尤其是在工业污染场地[1]。目前,国内外针对六六六污染土壤,采用较多的修复技术主要包括土壤淋洗、化学氧化还原、热脱附、土壤气相抽提以及微生物修复等,其中热脱附具有污染物去除效率高,修复周期短的特点,可快速修复六六六污染土壤。但热脱附技术在修复六六六污染土壤时操作温度通常需要达到500 ~750℃[2],才可完全去除污染物,如此的高温操作势必会破坏土壤的理化和生物学特性,影响修复后土壤的安全利用[3-6]。
有研究表明,不同污染的土壤,如石油烃、有机氯农药和多环芳烃污染的土壤经热脱附修复后,易造成土壤pH 上升,有机质、速效钾含量降低,同时也会降低土壤中粉粒和黏粒的含量,使土壤沙化程度增加,从而导致土壤结构改变,质量严重退化[7-11]。此外,热脱附后土壤理化性质的改变也会直接影响其生物学指标,有机氯农药污染土壤热脱附后,土壤酶活性和微生物群落短时间内难以恢复[10],并且植物也不能在修复土壤中正常生长[3],而多环芳烃污染土壤热脱附后经过长达2.5 年时间恢复,并在修复土中种植作物后,发现修复土壤中微生物和动物的丰度和多样性明显恢复,且高于对照[11]。因此当污染土壤进行热脱附处理后,有必要对修复后的土壤质量进行评价。而土壤生物学特性被认为是与土壤质量有关的敏感参数,主要包括植物生长状况、土壤微生物种群组成与结构、以及典型土壤酶的活性等[12-13],在一定程度上可表征为生物学指标对周围环境的响应,可作为评价修复后土壤的安全利用、土壤质量提升和土壤生态系统可持续性的重要指标[14-16]。而目前关于单一六六六污染土壤经过热脱附后其生物学响应鲜有报道。基于此本试验针对典型六六六污染,经热脱附高温处理后土壤,选择种植抗瘠薄能力强的植物—高羊茅(Festuca elataKeng ex E. Alexeev),从植物生长、土壤酶活性和土壤微生物群落多样性探究典型六六六污染土壤热脱附修复后的生物响应效应,为热脱附修复后土壤的安全再利用问题提供数据和方法支撑。
1 材料与方法
1.1 研究区概况
研究区为北方某有机氯农药厂,是一家有60 多年生产历史的农药厂,2013 年已停产,2019 年10月对厂区土壤进行热脱附修复。
1.2 供试材料
正常土壤(CK):为该农药厂周边无污染土壤(采样点位于污染场地南侧,相距3 km);修复后土壤(AR):有机氯农药厂污染土壤采用异位热脱附技术进行修复(热脱附工作温度为500 ~ 750℃,修复后的土壤回填至原有基坑,放置时间为1 个月)。供试植物:高羊茅(Festuca elata)品种为‘爱瑞3 号’(Arid 3),其适应性和抗逆性强,尤其是抗瘠薄能力很强。
供试土壤采用多点采样法采集0 ~20 cm 土样,运回实验室后阴凉处风干,将土壤磨碎后过5 mm筛后保存备用。种植高羊茅之前测定了供试土壤的基本理化性质(表1)和生物学特性(表2)。
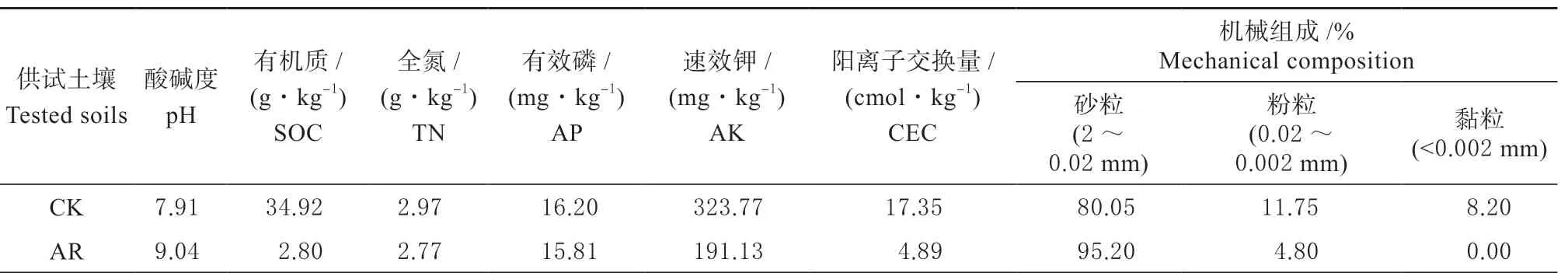
表1 供试土壤的基本理化性质Table 1 Basic physical and chemical properties of tested soils

表2 供试土壤的生物学指标Table 2 Biological characteristics of tested soils
1.3 试验设计
该盆栽试验于2020 年10 月21 日至12 月21 日在河北农业大学日光温室进行。本试验采用正常土壤(CK)和农药厂经热脱附修复后土壤(AR),均种植高羊茅,每个处理设6 次重复,共12 盆。每盆(直径约为15 cm,高10 cm)装1 kg 土壤,底肥施用量为 N:200 mg/kg、P2O5:150 mg/kg、K2O:200 mg/kg,分别以 (NH2)2CO、Ca(H2PO4)2·H2O、KCl 的形式施入,将底肥与土壤充分混匀后,灌水500 mL 使土壤持水量保持在70%~80%,土壤平衡5 d 后播种,期间为保持土壤水分每2 d 浇1 次水,每次浇水量为200 mL/盆。高羊茅种子经2%NaClO 消毒后,分散放在铺有湿润纱布的培养皿(ɸ9 mm)中,并在25 ℃黑暗条件下培养至露白播种,将其均匀播种在培养钵中,20 粒/盆,播深1 cm,浇水100 mL。待所有高羊茅完全出苗后进行间苗,每盆保留15 株长势均匀的幼苗。高羊茅种植60 d后收获。
1.4 测定指标与方法
土壤基本理化性值测定[17]:土壤pH 值在土水比1∶2.5 下用复合电极酸度计法测定;有机质(SOM)用重铬酸钾—稀释加热法测定;有效磷用NaHCO3浸提—钼锑抗比色法测定;速效钾用NH4OAc—火焰光度法测定;阳离子交换量用乙酸铵交换法;全氮使用碳氮分析仪测定;机械组成使用激光粒度仪测定。
植株生长指标:植株株高、茎粗和地上部、地下部干鲜重。
微生物区系(有效活菌数量)测定采用稀释平板计数法[18]:细菌用牛肉膏蛋白胨培养基;真菌用马丁孟加拉红培养基;放线菌用改良高氏1 号培养基。
土壤酶活性测定[19]:脲酶活性用苯酚钠-次氯酸钠比色法测定;磷酸酶(酸性和碱性)活性用磷酸苯二钠比色法测定;蔗糖酶活性用3,5-二硝基水杨酸比色法测定;脱氢酶比色法测定;β-葡萄糖苷酶用硝基酚比色法测定。
土壤细菌群落多样性测定:采用16S 高通量测序的方法,将16S rRNA 基因的V3 ~V4 区扩增,扩增引物为338F(5-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')。PCR 扩增条件为:95 ℃变性30 min,55 ℃退火30 s,72 ℃延伸45 s,27 个循环,最终72 ℃延伸10 min。PCR 反 应 体 系 为:5×FastPfu Buあer 4 μL,dNTPs(2.5 mmol/L)2 μL,正向和反向引物(5 mmol/L)各0.8 μL,FastPfu DNA 聚 合 酶0.4 μL,DNA 模 板(10 ng/μl)1 μL,最终用ddH2O 补足至20 μL。每个DNA 样品做3 次重复,将同一样品的PCR 产物混合后用2%的琼脂糖凝胶回收并用DNA 胶回收试剂盒(Axygen Biosciences, USA)进行纯化,Tris-HCl洗脱,2% 琼脂糖电泳检测。利用QuantiFluor™-ST (Promega, USA)测定浓度。高通量测序在上海美吉生物医药科技有限公司(Majorbio Bio-Pharm Technology Co., Ltd., Shanghai, China)测序平台进行。
1.5 数据处理
使用美吉云平台(www.i-sanger.com)进行细菌注释及多样性指数计算,Excel 2016 进行数据整理,SPSS23 软件进行方差分析,数据分析用独立样本T检验。
2 结果与分析
2.1 正常土壤和修复土壤中高羊茅生长状况分析
高羊茅在正常土壤和修复土壤中生长60 d 后,分析了植物的株高、茎粗、地上部和地下部干鲜重等生长指标(表3)。结果表明,高羊茅都能在2种土壤中发芽并生长,但是修复后的土壤种植的高羊茅其株高、茎粗和地上部鲜重、干重均显著低于正常无污染土壤;2 种土壤地下部根鲜重和干重无显著差异。因此,在60 d 的生长周期,修复土壤的状况抑制了高羊茅的正常生长。可能是因为六六六污染的土壤经过热脱附修复后,其土壤pH 值显著增加可高达9.0 以上,此外有机质、阳离子交换量和机械组成,尤其是土壤黏粒遭到高温的破坏而锐减(表2),从而显著影响了高羊茅的正常生长。

表3 正常土壤和修复土壤中高羊茅植株的生长状况Table 3 The growth conditions of tall fescue in normal soil and remediated soil
2.2 修复土壤中微生物数量和酶活性的响应效应
种植高羊茅60 d 后2 种土壤中微生物数量和6种土壤酶活性如下表所示(表4、表5)。热脱附修复后的土壤微生物区系有效活菌的数量显著低于正常土壤(P<0.05)。正常土壤中细菌、真菌和放线菌的数量分别是修复后土壤的28、55 和1 600 倍,两种土壤中放线菌数量的差异最大,这说明种植高羊茅60 d 后的修复土壤中细菌的恢复较快,其次是真菌,放线菌的恢复能力最弱。此外,研究发现与正常土壤相比,修复土壤中蔗糖酶、脲酶、酸性磷酸酶、碱性磷酸酶、脱氢酶和β-葡萄糖苷酶的活性分别较正常土壤低92.54%、79.68%、91.33%、90.65%、97.86%、88.93%(P<0.05),其中2 种土壤的脱氢酶活性降幅最大,且在修复土壤中脱氢酶的活性最低,而土壤脲酶活性的降幅最小,其他4种酶活性的降幅为88.93%~92.54%,这说明脱氢酶是敏感性的生物指示物,受外界环境的影响较大。综上所述,土壤微生物区系中放线菌属于敏感性菌群,土壤脱氢酶属于敏感性酶类,土壤脲酶则属于胁迫耐受型。
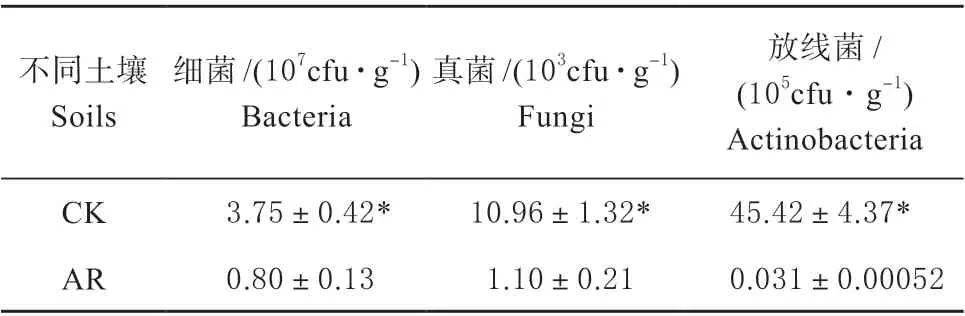
表4 正常土壤和修复土壤中微生物的数量的变化Table4 Variations of the microbial numbers in normal soil and remediated soil
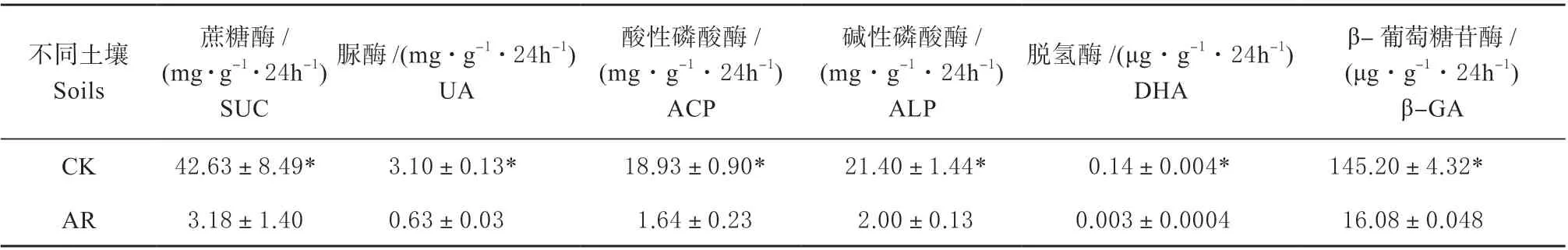
表5 正常土壤和修复土壤土壤酶活性的变化Table 5 Ariations of the soil enzyme activities in normal soil and remediated soil
2.3 修复土壤中细菌群落的响应效应
2.3.1 土壤细菌Alpha (α)多样性分析 种植高羊茅60 d 后,热脱附修复后的土壤细菌群落多样性指数和丰富度指数显著低于正常土壤(P<0.05)。与正常土壤相比修复后土壤中Shannon 指数、Sobs 指数、Ace 指数和Chao 指数分别降低39.84%,89.58%,90.61%和89.93%。而Simpson 指数较正常土壤增加635.85%(P<0.05),这说明修复土壤的细菌多样性明显降低。2 种土壤中Ace 指数差异最大,其次是Chao 指数、Sobs 指数和Shannon 指数的差异相对较小,这说明种植高羊茅60 d 热脱附后的土壤中细菌丰富度恢复程度较差,而细菌群落多样性的恢复程度较好,这可能是因为六六六污染土壤经过热脱附修复后,土壤中的微生物数量减少,尤其是真菌和放线菌数量均降为0(表2),而短时间内土壤微生物数量难以恢复,导致2 种土壤中细菌丰富度指数差异较大。2 种土壤Shannon 指数差异较小可能是因为热脱附后土壤细菌数量有所恢复(表2),这也间接说明修复土壤Simpson 指数较高,因为修复土壤中只有细菌恢复,物种组成较为单一所致。

表6 正常土壤和修复土壤中细菌多样性与丰富度的变化Table 6 Variations of the bacterial diversity index and richness index in normal soil and remediated soil
2.3.2 土壤细菌Beta (β)多样性分析 种植高羊茅60 d 后2 种土壤中细菌OTUs 基于PCA 的β-多样性分析如图1A 所示。两轴的总贡献率为97.09%,主成分一轴贡献率为90.20%,主成分二轴贡献率为6.89%。修复土壤与正常土壤处理沿PC1 轴分离,处理间细菌群落物种组成相似,这表明修复土壤与正常土壤细菌群落结构存在显著的差异。这个结果与正常土壤和修复土壤样品的聚类分析结果(图1B)类似。
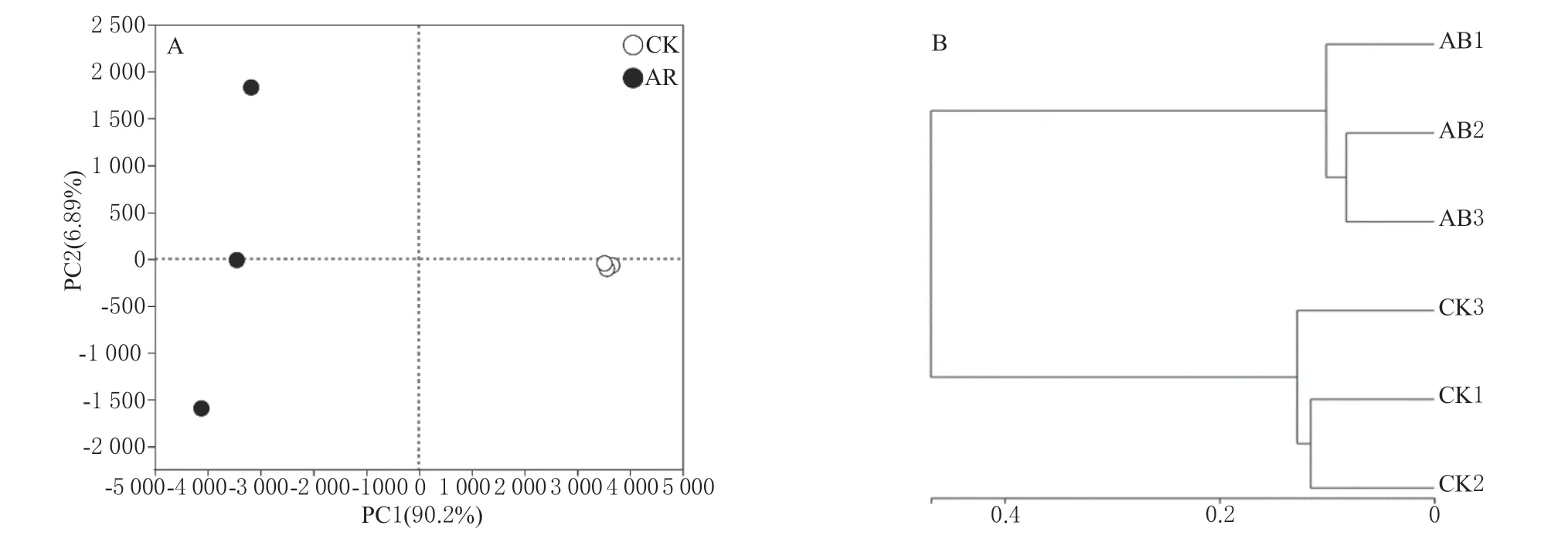
图1 土壤细菌群落PCA(A)和聚类分析(B)Fig.1 PCA (A) and cluster analysis (B) of soil bacterial community
2.3.3 土壤细菌群落在门和属水平的组成特征分析 土壤细菌群落组成图见图2,正常土壤细菌群落主要的优势菌门(相对丰度>1%)为变形菌门(Proteobacteria)(25.42%)、酸杆菌门(Acidobacteriota)(26.11%), 放 线 菌 门(Actinobacteriota)(15.10%),绿弯菌门(Chloroflexi)(11.11%)和芽孢杆菌门(Bacteroidota)(7.99%),相对丰度占整个细菌群落的85.73%,其次分别是芽单胞菌门(Gemmatimonadota)(4.29%)、粘菌门(Myxococcota)(1.45%)、髌骨菌门(Patescibacteria)(1.40%)、浮霉菌门(Planctomycetota)(1.31%)和Latescibacteria(1.10%)。修复土壤中优势菌门为变形菌门(81.08%)、放线菌门(10.05%)和厚壁菌门(Firmicutes)(6.50%),相对丰度占整个细菌群落的97.63%。
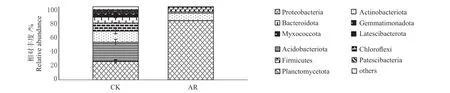
图2 正常土壤和修复土壤中细菌群落组成(门水平)Fig.2 Composition of bacterial community at phylum level in normal soil and remediated soil
修复土壤中变形菌门和厚壁菌门的丰度分别比正常土壤显著增加2.19 倍和11.04 倍(P<0.05),说明修复后土壤中2 个菌门的细菌对理化性质较差的土壤具有一定耐受能力;而修复土壤中放线菌门、酸杆菌门、绿弯菌门和芽孢杆菌门相对丰度显著降低了33.44%、99.93%、99.82%和78.55%(P<0.05),说明修复土壤环境可以抑制这4个菌门细菌的活性,也说明这4 个菌门的细菌对理化性质较差的土壤敏感性较强。
由图3 可知,正常土壤中细菌群落主要的优势菌属(相对丰度>2%)为norank_f__Vicinamibacteraceae菌属(8.41%)、鞘氨醇单胞菌属(Sphingomonas)(6.97%)、RB41菌 属(5.58%) 和norank_f__norank_o__Vicinamibacterales菌属(4.39%),总相对丰富占整个细菌群落的25.35%。而修复土壤中优势菌属为溶杆菌属(Lysobacter)(18.61%)、副球菌属(Paracoccus)(8.45%)、氢噬菌属(Hydrogenophaga)(8.17%)和Ellin6055菌属(6.28%),总相对丰富占整个细菌群落的41.51%。
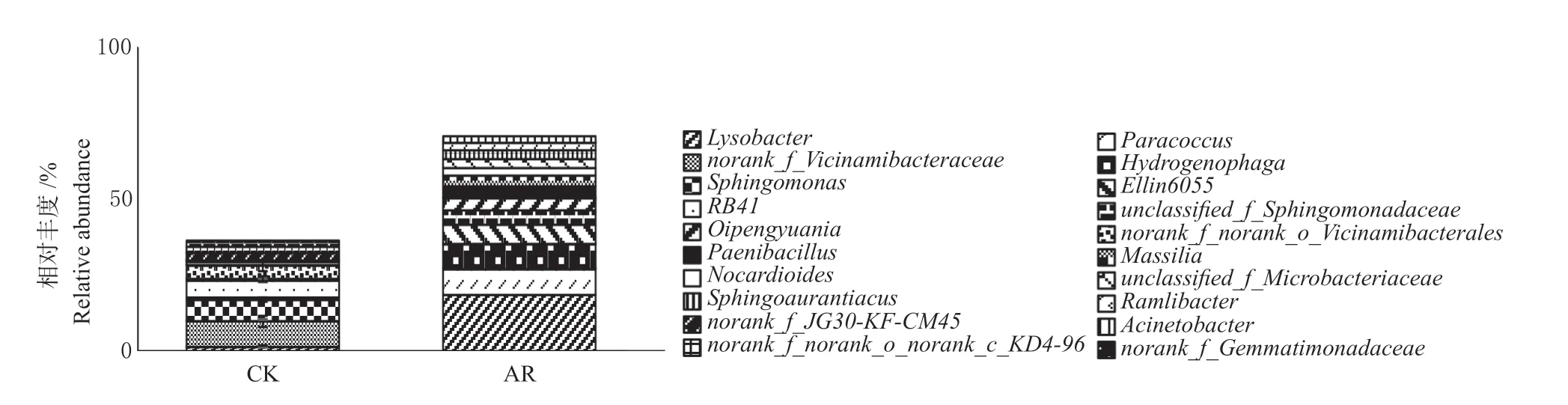
图3 正常土壤和修复土壤中细菌群落组成(属水平)Fig.3 Composition of bacterial community at genus level in normal soil and remediated soil
修复土壤中变形菌门的副球菌属、氢噬菌属、溶杆菌属、和Ellin6055菌属的丰度分别是正常土壤的654 倍、70 倍、12 倍、和8 倍(P<0.05),说明修复后土壤环境可以促进这些菌属微生物的活性,也说明其属于耐受型细菌;而修复土壤中norank_f__Vicinamibacteraceae菌 属、norank_f__norank_o__Vicinamibacterales菌属和鞘氨醇单胞菌属相对丰度显著降低了99.92%、99.94%、97.76%,RB41菌属相对丰度降为0(P<0.05),说明修复土壤环境可以抑制这4 个菌属微生物的活性,也说明其为敏感性型细菌。
2.3.4 土壤细菌群落结构与环境因子分析 采用冗余分析(RDA)研究种植高羊茅后正常和修复土壤微生物群落与土壤环境因子之间的关系(图4)。在细菌群落中,所选取的土壤环境因子解释了土壤整个细菌群落变化的99.43%,分别为97.11%(RDA1)和2.32%(RDA2)(图4A,4B)。此外,除土壤AP 外,所选取的土壤环境因子均影响了土壤细菌群落,其中有机质和脱氢酶显著影响了不同土壤中的细菌群落结构,影响系数分别为0.992 5 和0.998 1(表7)。
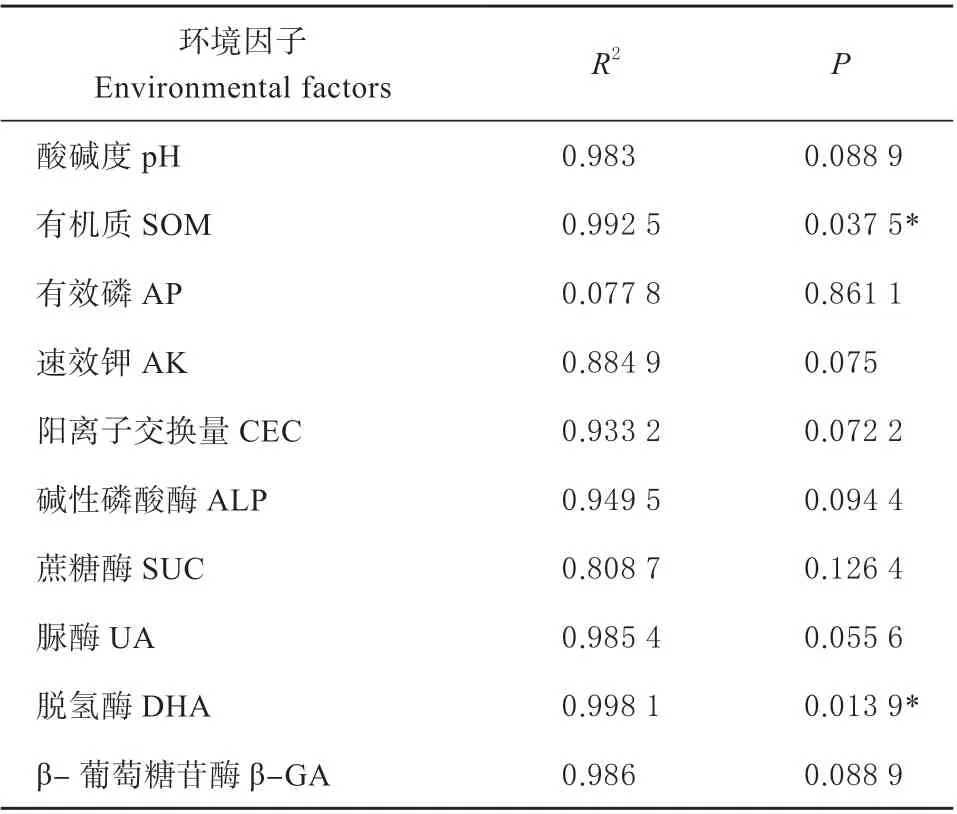
表7 土壤环境因子对土壤细菌整个群落的影响系数Table7 The influence coefficient of soil environmental factors on the whole bacterial communities
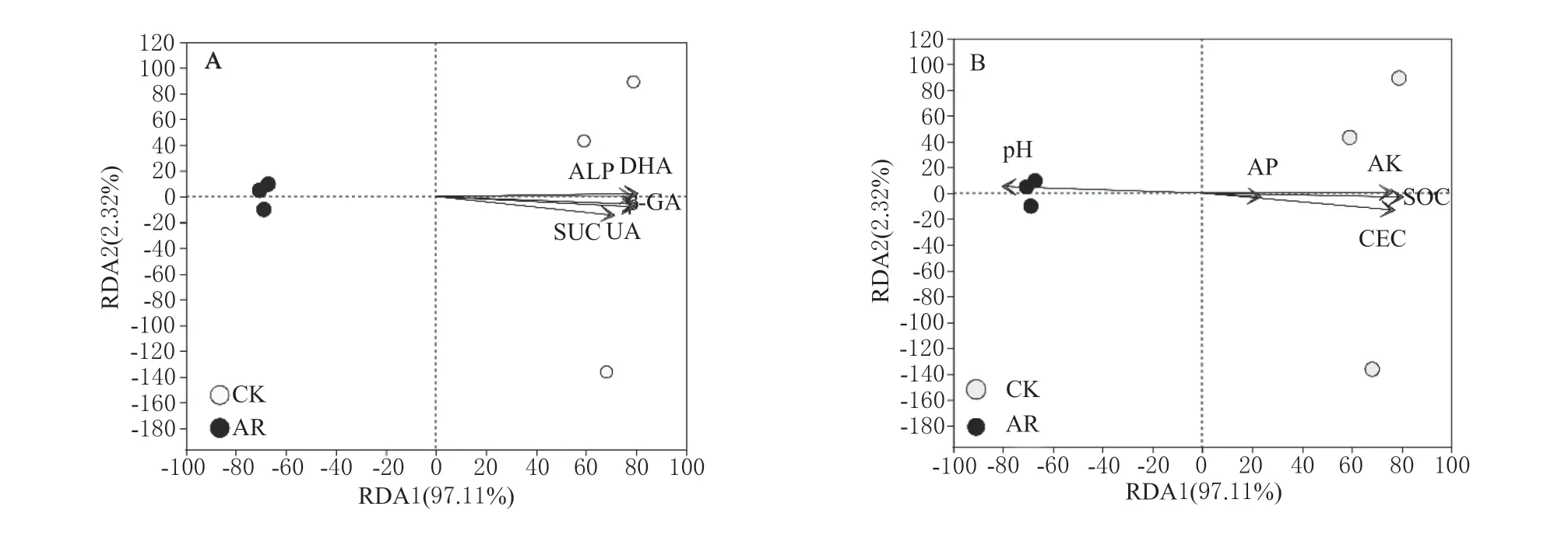
图4 土壤细菌群落与土壤环境因子之间关系的RDA 分析Fig.4 RDA analysis of soil bacterial communities and selected environmental variables
3 讨论与结论
3.1 热脱附修复后土壤对高羊茅生长情况的影响
土壤经过高温后显著改变其基本理化性质,研究表明当土壤温度高于500 ℃时,土壤有机酸的破坏导致pH 值增加,土壤有机质完全燃烧,黏粒和粉粒的比例下降[9],进而降低阳离子交换量[8]。本研究中选择热脱附修后的土壤,其工作温度在500 ~700 ℃,修复后土壤pH 值增加到9.0 以上,有机质、阳离子交换量和土壤黏粒占比显著低于正常土壤,说明修复后土壤理化性状遭到严重破坏,不利于植物的健康生长。因此经过60 d 的生长周期,修复土壤中高羊茅株高、茎粗、生物量显著低于正常土壤。这与Vidonish 等[8]研究热脱附修复后土壤严重制约植株正常生长的结论一致,热脱附后土壤结构改变,质量严重退化,土壤保肥保水性能以及养分循环转化能力较差,势必会影响植物的正常生长。
3.2 热脱附修复后土壤种植高羊茅对土壤微生物量和酶活性的影响
本试验中修复土壤经过种植高羊茅60 d 后,土壤中微生物量和酶活性显著低于正常土壤。这说明修复后土壤理化性质的改变,影响了土壤中微生物的数量和酶活性,进而导致土壤速效养分循环较差[20],这可能也是造成修复土壤中植株生长较差的主要原因。这与前人研究结果一致,土壤经过高温后,土壤中微生物量和酶活性短时间内难以恢复,显著低于对照[21]。
3.3 热脱附修复后土壤种植高羊茅后对土壤微生物群落结构的影响
本研究通过对土壤细菌群落结构分析发现,修复土壤优势菌门主要为变形菌门、放线菌门和厚壁菌门;在属水平溶杆菌属、副球菌属、氢噬菌属和Ellin6055是优势菌属,且均属于变形菌门。已有研究表明变形菌门、放线菌门和副球菌属对自然界中污染物具有活性降解作用[20-24],这表明修复土壤经过种植高羊茅后的优势物种中存在能够降解污染物的细菌,这与Ceb 等[25]研究结果相一致,即对多环芳烃污染的土壤热脱附修复后,发现经过长达2 年的时间,微生物群落群落组成是以降解多环芳烃的降解菌为主的。此外,溶杆菌属是一种新型生防菌,具有很强的溶菌抑菌效果,对多种植物病原真菌、细菌及线虫等都具有较好的拮抗活性[26-27]。而本研究中修复土壤溶杆菌属相对丰度较高,从微观角度上说明了修复土壤通过种植高羊茅后,土壤的微生态环境在向好的趋势发展。
综上所述,热脱附技术修复的六六六污染的典型土壤,对土壤理化性质和生物学特性均产生较大负面影响,并抑制了修复土壤中高羊茅的生长。虽然修复土壤中主要土壤酶和细菌多样性显著下降,但是16S 高通量测序技术则发现在修复土壤中存在一些耐受型有益微生物,其生存能力很强且能较快恢复其活性,有益于改善修复土壤的生物学特性,加快其安全利用的进程。

