3D口腔粘膜模型的构建及其在口腔护理产品的抗炎功效中的应用
陈敏珊 王真史 李 平 陶 丽
(广州薇美姿实业有限公司,广东广州 510665)
引言
根据2017年公布的第四次全国口腔健康流行病学调查结果显示,我国中年人牙石和牙龈出血检出水平较高,与10年前相比牙龈出血检出率上升了10.1个百分点,牙周健康状况有待提高[1]。口腔炎症被认为是宿主对入侵病原体保护作用的不良结果,口腔炎症性疾病如牙龈炎、牙周炎等,不仅危害口腔健康而且与全身疾病有着密切关系,严重时可引起全身炎症反应。牙周局部炎症会破坏上皮的完整性,导致致病菌扩散到循环系统。同时牙周袋内含有大量的炎症介质,尤其是与慢性炎症相关的炎症介质,如白细胞介素、肿瘤坏死因子α、以及前列腺素均会由牙周袋进入血液循环系统从而引起系统性炎症反应。口腔炎症与全身系统性疾病,包括心血管系统、内分泌系统、呼吸系统、免疫系统、神经系统等疾病的发生发展密切相关[2-3]。口腔护理用品作为一类日常必需品,在预防与减缓初期口腔炎症有着重要的作用。因此如何研制出疗效快、显效好的抗炎功效成分并应用、开发出具有预防与减缓初期口腔炎症的口腔护理产品是现阶段口腔护龈领域的研究热点。口腔护理产品的抗炎验证方法一直是行业中所面临的难点。2009年3月,欧盟要求禁止对化妆品成分进行动物实验,并且禁止对成品或者成分进行过局部/急性动物实验的化妆品销售。欧洲、美国、日本等地区或国家已成立动物实验替代机构旨在积极推动替代方法进行更为系统而深入的研究,目前已顺利完成相关技术储备,并通过立法程序建立起相应的技术性贸易措施体系。我国现也已有和国际接轨的相关法律法规,以体外替代试验方法取代传统的动物试验[4]。《医疗器械生物学评价第1部分:评价与试验(GB/T16886-1)》提到:只要科学上证明能获得与动物试验同样的信息,建议优先采用体外模式。前期我司已经建立采用单层细胞建立了用于口腔护理产品的体外抗炎、修复损伤功效模型,即2D模型。在大量的应用数据中发现,经过2D模型测试的功效产品直接用动物模型或临床实验模型进行功效评价,结果存在着一定的局限性。本研究以正常的人体口腔黏膜生理结构和功能为基础,构建了口腔黏膜体外三维细胞模型,即3D口腔模型。同时,立足于含救必应提取物的口腔护理产品的抗炎功效测试,对比2D模型、3D口腔模型、动物实验和临床实验的相关性,探讨了口腔黏膜体外三维细胞模型应用在口腔护理产品功效验证中的可行性。一方面,可以寻找并建立更加快捷可靠的抗炎评价方法;另一方面,也是为口腔护理行业动物替代实验进行探索,最终旨在为口腔护理产品开发及功效验证提供一个新思路。
1 3D口腔粘膜模型介绍
1.1 口腔黏膜的结构与功能[5]
口腔黏膜覆盖于口腔表面,正常的人体口腔黏膜生理结构包括固有层和上皮层。其中,上皮层为复层鳞状上皮,主要由角质细胞构成,此外还有少数非角质细胞。固有层由致密的结缔组织组成。固有层的基本细胞成分是成纤维细胞,有合成和更新纤维及基质的功能。固有层的纤维主要是Ⅰ型胶原纤维。口腔黏膜根据所在的部位和功能不同可分为三类,即咀嚼黏膜、被覆黏膜和特殊黏膜。
口腔黏膜具有的保护性功能主要体现在抵抗机械刺激和限制微生物和毒性物质的侵入。咀嚼期间口腔黏膜常常承受压力、切力、牵拉力和磨擦力,黏膜的结构适应于承受这些力。例如硬腭和附着龈黏膜有角化层以抵抗磨擦,并且紧密附着于其下方的骨组织以抵抗切力和压力;颊黏膜易于活动并富有弹性利于组织的扩展,从而可缓解牵拉力。口腔内有大量的微生物以及它们的毒性产物和其他潜在的有害物质,口腔黏膜上皮是限制它们进入机体的主要屏障。
口腔黏膜还有感觉功能,可对疼痛、触动和温度做出反应,还有特殊的感觉系统即味觉。在某些方面,感觉功能具有保护性,因为口腔黏膜的感受器能启动吞咽、恶心和流涎等反射。因此口腔黏膜还与唾液的分泌以及某些药物的渗透性吸收有关。
1.2 口腔炎症
口腔炎症是口腔疾病发病的早期征兆,最常见的口腔炎症表现为牙龈发红、肿胀、易出血,严重时牙龈缘可有溃疡和假膜形成,并伴有疼痛感。细菌感染、外物刺激以及食物嵌塞是引起口腔炎症的主要原因,其中最常见的是细菌感染。口腔是人体最复杂的生态微环境之一,约有700多种微生物。口腔微生物与宿主之间存在共生、竞争、拮抗及相互制约的特殊关系。一旦这种关系失调,特异性致病菌数量增多,细菌及其毒性产物就可启动牙周的初期炎症过程。即细菌及其毒性产物刺激上皮细胞通过受体介导产生细胞因子,同时释放神经肽,引发局部血管舒张[6]。释放的趋化因子引发第一道防线:免疫细胞离开血管,迁移到微生物入侵的地方,清除入侵的细菌,产生细胞因子和趋化因子,激活淋巴细胞介导的适应性免疫反应。在此阶段口腔炎症的临床症状表现为出血、肿胀和牙龈发红,即为牙龈炎[7]。若宿主防御功能旺盛并得到适当治疗,初期口腔炎症会被免疫细胞控制或清除。当宿主的防御功能与修复能力低下,无法抵御细菌微生物的侵袭时,细菌及其毒性产物会激活宿主的防御细胞产生并释放更多的炎症因子,使口腔炎症进一步扩大及恶化(图1)。当炎症过程延长和转化为慢性炎症时,炎症引发组织创伤,导致口腔软、硬组织包括牙槽骨被破坏,临床上表现为不可逆转的牙周炎。目前,研究表明引发牙龈炎症的致病菌多为G-厌氧菌,主要有牙龈卟啉单胞菌(P.g)、放线共生放线杆菌(A. a)、福赛斯类杆菌(B. f)[8,9]。
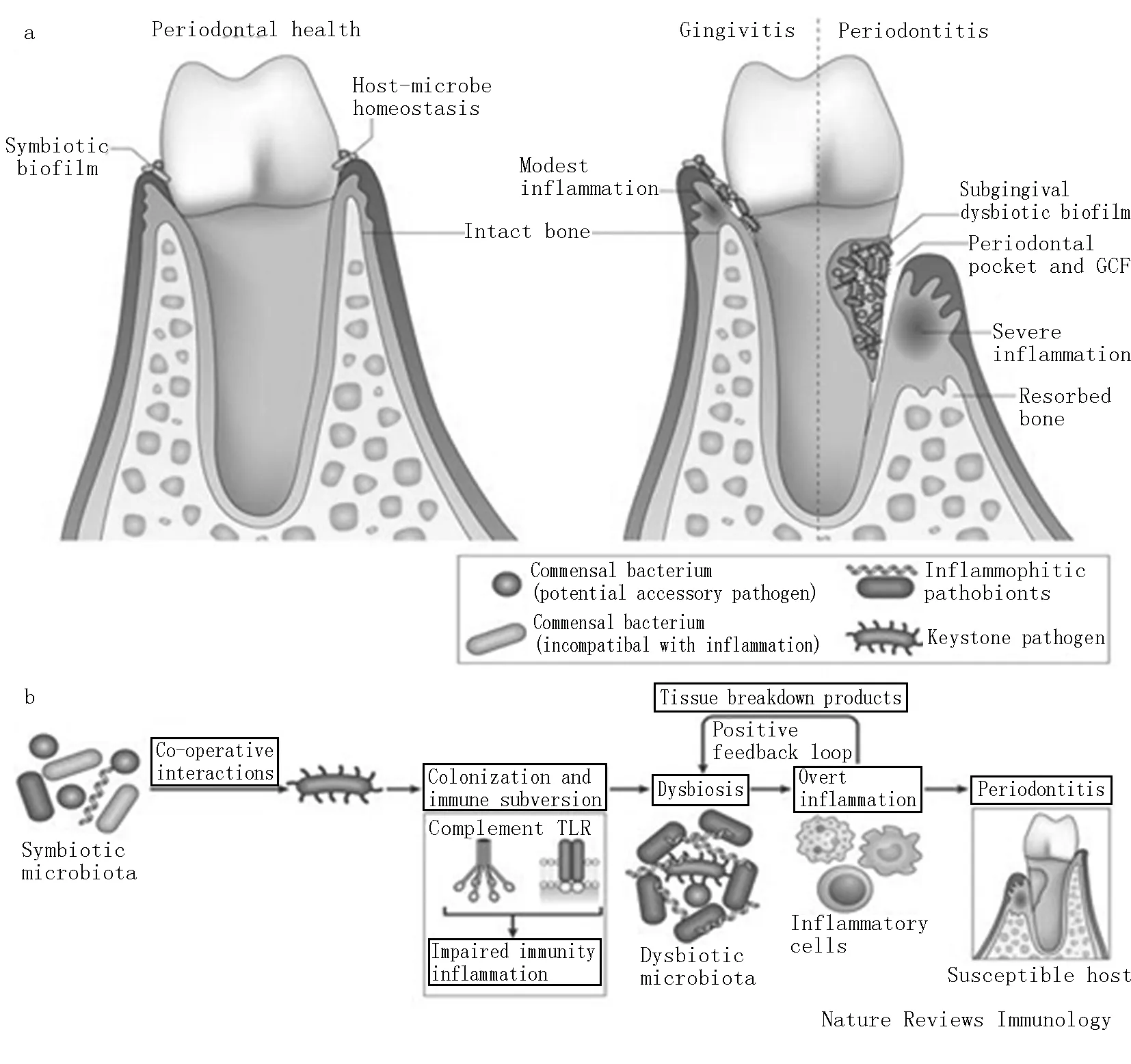
图1 口腔炎症的发生机理
1.3 口腔的体外模型
体外口腔模型有二维(2D)贴壁培养和三维(3D)培养两类。
目前常用于评价口腔原料或口腔护理产品的2D炎症模型有:脂多糖(LPS)诱导单核/巨噬细胞RAW264.7细胞的炎症模型,脂多糖(LPS)诱导牙龈成纤维细胞(HGFs)的炎症模型,或者牙龈卟啉单胞菌(P.g)诱导牙龈成纤维细胞(HGFs)的炎症模型[10, 11]。二维细胞培养,即单一细胞系贴附于培养器皿表面或悬浮于培养液中生长,细胞分裂、繁殖、细胞数量増加的过程。2D培养过程简单高效,为人类在科学研究方面提供了巨大的便利。然而,2D培养方法将生长于极复杂的生物体内的细胞离体并进行简单化、均一化培养,因此2D细胞的生长环境与体内环境存在巨大差距,从而导致细胞生物学特征及细胞行为发生了巨大改变,进而造成2D细胞对产品的应答模式与体内存在显著差距,这不利于产品的评价与开发[12]。
体外细胞培养的一个重要原则是需模拟体内细胞生长环境, 该模拟系统中最重要的核心因素是细胞与培养环境之间的相互作用。不同于传统的二维化单层细胞培养, 三维细胞培养技术(3D) 是指将具有三维结构不同材料的载体与各种不同种类的细胞在体外共同培养, 使细胞能够在载体的三维立体空间结构中迁移、生长, 构成三维的细胞-载体复合物。三维细胞培养是将细胞培植在一定的细胞外基质中, 细胞外基质( Extracellularmatrix, ECM) 蛋白充当生长支架, 使得细胞能够分化产生一定的三维组织特异性结构, 所创建的细胞生长环境, 则最大程度地模拟体内环境。3D作为体外无细胞系统及单层细胞系统的研究与组织器官及整体研究的桥梁,显示了它既能保留体内细胞微环境的物质及结构基础,又能展现细胞培养的直观性及条件可控性的优势。近几年三维细胞培养技术在组织形成、血管发育和器官再造等发育生物学的分支领域得到了广泛的应用;同时在筛选新药的疗效分析和毒理实验方面, 利用三维培养获得了和二维单层培养完全不同的结果, 引起了药物学家的极大兴趣[13, 14]。现阶段,国内外报道的三维(3D)培养技术应用于口腔炎症的模型比较少,国内已报道的口腔黏膜模型只构建了口腔黏膜上皮层,并且以口腔黏膜鳞状癌细胞为种子细胞,不能很好地反映人天然口腔黏膜结构。因此本研究旨在构建一种与人体口腔黏膜上皮组织的结构及功能高度相似的体外口腔黏膜上皮模型,探讨其在口腔护理产品的抗炎功效的应用,填补我国在口腔黏膜体外三维细胞模型及在口腔护理产品中应用的空白。
2 用于口腔护理产品抗炎功效验证的3D口腔粘膜模型建立
2.1 实验材料和方法
2.1.1 试剂与仪器
人白介素6 ELISA试剂盒、人介素1β Elisa试剂盒(中国,武汉华美生物工程有限公司),细胞毒性检测试剂盒说明书(中国,Beyotime),DMEM高糖培养基(美国,Gibco),CO2培养箱(美国,Thermo),Tecan Infinite M200 Pro酶标仪(瑞士,Tecan)。
2.1.2 细胞培养
人牙龈成纤维细胞株HGF-1(ATCC® CRL-2014TM, Rockville, MD, USA)细胞培养于含有20%牛血清的DMEM高糖培养基,添加100 U/mL的青霉素和100μg/mL的链霉素(美国Hyclone公司),37℃,5% CO2饱和湿度的培养箱内。人口腔角质HOKs细胞 (ScienCell Research Laboratories, Carlsbad, CA)用特殊的培养基培养,具体培养方法根据说明书。
2.1.3 菌株培养
在含有0.001%的氯高铁血红素和0.0001%的维生素K (THB-HK)的Todd Hewitt肉汤(BBL Microbiology Systems, Cockeysville, MD, USA)中厌氧培养牙龈卟啉单胞菌P.g (P.gingivalis ATCC 33,277)。
2.1.4 人口腔黏膜体外三维细胞模型的建立[15, 16]
将HOKs细胞种植在胶原包埋人龈成纤维细胞收缩而成的真皮层上,待HOKs细胞长至多层,气提培养7 d,分成含基质层、棘层、肉芽层、角质层的人工皮肤。基底层的配置:取Collagen I、DMEM培养基、FBS(牛血清)按照1∶2∶1比例混合,置于PET膜上,于25℃条件下静置1 h,再移至37℃培养箱静置1 h。固有层的配置:取Collagen I、DMEM培养基、FBS(牛血清)按照1∶2∶1比例混合,将混合液重悬HGF-1细胞,使其密度为1.5×105个/mL,置于基底层上,于25℃条件下静置1 h,再移至37℃培养箱静置1h。固化后,加入培养液Ⅱ浸泡固化后的固有层,于37℃二氧化碳培养箱中培养4~7天,得固有层。上皮层的配置:舍弃部分固有层培养基,使固有层表面没有液体,以便于表皮细胞均匀附着在真皮层;取HOKs细胞(1.5×105个/mL)平铺于所述固有层,于37℃孵育2 h使HOKs细胞完全附着在固有层上,加入口腔角质细胞的扩增培养培养液,于37℃二氧化碳培养箱培养2天;之后进行气液界面培养,于37℃二氧化碳培养箱培养2~3天后。将上皮培养基舍弃,加分化培养基进行气液界面培养7天得成熟的全层3D口腔黏膜。
2.1.5 组织学切片[17]
2.1.5.1 取材:新鲜组织用固定液固定24 h以上。将组织从固定液取出在通风橱内用手术刀将目的部位组织修平整,将修切好的组织和对应的标签放于脱水盒内。
2.1.5.2 脱水浸蜡:将脱水盒放进吊篮里于脱水机内依次梯度酒精进行脱水。脱水处理的步骤具体如下:
a)采用浓度为75%的酒精脱水处理4 h;
b)采用85%酒精脱水处理2 h;
c)采用90%的酒精脱水处理2 h;
d)采用95%的酒精处理1 h;
e)使用无水乙醇处理30min;
f)使用无水乙醇处理30min;
g)使用醇苯处理5-10min;
h)使用二甲苯处理5-10min;
i)使用二甲苯处理5-10min;
j)使用温度为65℃的融化石蜡处理1 h;
k)使用65℃的融化石蜡处理1 h;
l)使用65℃的融化石蜡处理1 h。
2.1.5.3 包埋:将浸好蜡的组织于包埋机内进行包埋。先将融化的蜡放入包埋框,待蜡凝固之前将组织从脱水盒内取出按照包埋面的要求放入包埋框并贴上对应的标签。于-20℃冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。
2.1.5.4 切片:将修整好的蜡块置于石蜡切片机切片,厚4 μm。切片漂浮于摊片机40℃温水上将组织展平,载玻片将组织捞起,在烘箱内60℃的温度下烤片。水烤干蜡烤化后取出常温保存备用。
2.1.5.5 B.HE染色
a)石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ中20min、二甲苯Ⅱ中20min、无水乙醇Ⅰ中5min、无水乙醇Ⅱ中5min、75%酒精中5min,最后用自来水洗。
b)苏木素染色:将上述切片置于苏木素染液中染3~5min,用自来水清洗,采用分化液分化,再次清洗,返蓝液返蓝,最后用流水冲洗。
c)拍摄:正置光学显微(日本尼康,Nikon Eclipse E100)在不同倍镜下拍照。
2.1.6 体外2D模型评估产品的抗炎性能[18]
HGF-1细胞(5×104个/孔)接种于24孔板中暴露于稀释后的口腔护理产品后用P.g(1.6×106CFU/mL)刺激。24h后, 收集离心上清液。取120μL上层清液进行细胞毒性检测,操作根据细胞毒性检测试剂盒说明书(Beyotime, Beijing, China),如2.1.8。同时再取120μL上层清液进行抗炎检测,白介素(IL)-6和IL-1β蛋白质分泌的含量检测操作根据ELISA试剂盒说明书,如2.1.9。
2.1.7 体外3D模型评估产品的抗炎性能
将成熟的全层3D口腔黏膜连同Transwell小室转移到装有1.5mL培养基的6孔板中,将稀释后的口腔护理产品和P.g(1.6×106CFU/mL)涂抹于口腔黏膜的上皮层上,孵育24h后,收集离心上清液。取120μL上层清液进行步骤2.1.8细胞毒性测试,再取120μL上层清液进行步骤2.1.9酶联免疫吸附实验。
2.1.8 细胞毒性测试
细胞毒性测试操作根据乳酸脱氢酶细胞毒性检测剂盒说明书。
细胞毒性(%) =(受试组OD值-溶剂对照组OD值)/(细胞最大酶活性OD值-溶剂对照组OD值)×100
2.1.9 酶联免疫吸附实验(ELISA)
IL-1β和IL-6是牙周炎症中最突出的两个炎症因子,它可以调节其他细胞因子的作用,在发生炎症时其表达水平增加。可通过ELISA方法检测待测样品对这些炎症相关因子的影响从而了解其抗炎作用的机理。IL-1β和IL-6的含量检测操作根据ELISA试剂盒说明书。
炎症因子抑制率(%) =(模型组炎症因子含量-受试组炎症因子含量)/(模型组炎症因子含量-溶剂对照组炎症因子含量)×100
2.1.10 小鼠耳肿胀TPA致炎模型评估产品的抗炎性能[19]
取雄性昆明种小鼠,体重18~22g,小鼠适应性喂养3 d后,根据样品数量随机平均分组,每组4只,即TPA模型对照组、丁硼乳膏组(阳性对照组)、含复合物牙膏组。含复合物牙膏组每只动物的右耳里外两面分别涂布适量膏体,每天早晚各1次,连续3天,该动物的左耳作为自身空白对照。阳性对照组处理方式同含复合物牙膏组,施加样品为丁硼乳膏。末次涂含复合物牙膏及丁硼乳膏10min后,将小鼠右耳内外两侧涂10 uL TPA(25 μg/mL),模型组同样方式进行处理,6 h之后,脱臼处死动物,擦净耳部所涂的膏体(左耳同样进行擦洗操作),沿耳廓基线剪下两耳,用6.5 mm打孔器冲下左右两耳同一部位的圆片,称重(精确到0.0001g),同一只动物左右耳的重量差即为肿胀度。
肿胀率(%) =(TPA组肿胀度—受试组肿胀度)/TPA组肿胀度×100
2.1.11 临床测试评估产品的减轻牙龈炎症性能[20]
进行随机、双盲、对照、平行的临床研究。纳入标准:
a)全身健康状况良好、无全身系统性疾病、有20颗以上的完好牙齿;
b)年龄在18~70周岁;
c)如果为女性,不得处于妊娠期和哺乳期内;
d)改良Quigley-Hein菌斑指数≥1.5;
e)Loe-Silness龈炎指数≥1.0;
f)没有同时参加其他类似试验研究;
g)签署知情同意书,能按要求完成临床试验。
排除标准:
a)戴正畸器具;
b)有部分义齿;
c)软硬组织有肿瘤;
d)严重牙龈炎;
e)1个月内使用抗生素;
f)参加其他临床试验;
g)吸毒及酗酒。
共100名研究对象参加了临床研究,随机分为含复合物牙膏组(试验组)与不含复合物牙膏组(对照组),对全部实验对象进行洁牙。给受试者统一发放各自相应的牙膏和软质牙刷,要求受试者按规定一日刷牙2次(早、晚),每次时间至少1min。要求实验过程中不使用任何其他口腔卫生用品。对饮食和抽烟不作限制。6周时补充实验的牙膏和牙刷。在使用牙膏牙刷6周和12周时,对受试者牙菌斑和牙龈炎状况按照基线检查的程序进行再评估。
检查指标(第三磨牙除外):
菌斑指数(Quigley-Hein改良Turesky菌斑指数,PI):检查每个牙颊面及舌的近中,中及远中面。
龈炎指数(改良Loe-Silness龈炎指数,GI):检查每个牙颊面及舌的近中,中及远中面。
PI和GI由2位已经过自身校正合格的医师检查。在基线检查PI后,所有牙面的菌斑用橡皮环和抛光膏去除。
2.1.12 数据统计与分析
每个实验至少独立重复3次,数据以均数±标准差(M±SD)表示,采用GraphPad计算机软件对所得数据进行分析,组间比较采用ANOVA统计学分析,运用Newman-Keuls方法计算显著性差异,P<0.05表示差异有统计学意义。
2.2 实验结果
2.2.1 3D口腔粘膜模型的构建过程和组织学切片
口腔黏膜体外三维细胞模型的构建过程如图2所示。人体口腔黏膜模型的制备方法模拟人体口腔黏膜的生长发育过程,制备周期短,方法简易,可控性强,原料易于获取,可实现大规模产业化生产,保证维持口腔黏膜各层细胞生长的微环境,制备的全层口腔黏膜更接近于正常人体口腔黏膜结构,并具备相应的功能性,在体外条件下其功能和活性维持时间,能够满足相关口腔黏膜生物学检测的需求。既弥补了传统的使用单层黏膜组织模型的方法的缺陷,在缩短构建时间、降低成本的同时,又保证了模型的安全性与功效性。

图2 口腔黏膜体外三维细胞构建的简图
为了能够直观地观测到所得的人体口腔黏膜模型的结构,采用组织学切片分析方法,并将所构建的人体口腔黏膜模型置于光学显微镜下观测。结果显示,该3D口腔黏膜自上而下分别为由上皮细胞生发复层分化组成的上皮层,由成纤维细胞及其胞外基质组成的固有层组合(图3),表明该模型构建的有效性。

图3 对构建的口腔黏膜体外三维细胞模型行组织学切片
2.2.2 牙龈卟啉单胞菌诱导3D口腔粘膜的炎症模型的构建
评价牙龈卟啉单胞菌对细胞的毒性,采用LDH分析方法。结果显示,P.g在浓度为1.6×103-1.6×106CFU/mL时无细胞毒性(表1)。将安全剂量范围内的P.g涂抹于口腔黏膜的上皮层上,分别孵育;在P.g对3D口腔黏膜无毒性剂量范围内,本研究检测了它诱导3D口腔黏膜8、14和24小时后产生IL-1β和IL-6量。实验结果如图4所示,与空白对照组相比,1.6×104-1.6×106CFU/mL的P.g在8h和24h时能显著地诱导3D口腔黏膜分泌IL-1β和IL-6量。并且浓度为1.6×106CFU/mL的P.g诱导3D口腔黏膜24h后,3D口腔黏膜分泌的IL-1β和IL-6量最多,所以选在P.g浓度为1.6×106CFU/mL,诱导时间为24h进行后续抑制炎症的实验。

图4 P.g刺激3D口腔黏膜分泌IL-1β和IL-6量

表1 不同浓度的牙龈卟啉单胞菌的细胞毒性
数据以3个不同实验的平均值±标准差表示。
不同浓度牙龈卟啉单胞菌(1.6×103-1.6×106CFU/mL)对诱导3D口腔黏膜炎症的影响。每个实验至少独立重复3次,数据以均数±标准差(M±SD)表示。(*** P<0.001 vs. controlgroup)
2.2.3 口腔护理产品对卟啉单胞菌诱导的2D口腔细胞释放IL-6和IL-1β的抑制作用
首先采用LDH分析方法评价口腔护理产品对HGF-1细胞的毒性。结果显示在200ug/mL时,空白牙膏对照组、含救必应牙膏组和丁硼乳膏组显示未有细胞毒性(表2)。因此在安全剂量下,采用ELISA分析方法检测,其对P.g诱导的HGF-1细胞的IL-6和IL-1β的抑制作用。图5显示,空白牙膏对照组对IL-6和IL-1β的抑制率达到了57.2%和56.76%,与含救必应牙膏组和丁硼乳膏组未有显著性差别。可见未加功效物的牙膏也有抗炎作用,提示此2D口腔细胞不适合应用于产品的抗炎功效评价。

图5 口腔护理产品刺激2D口腔细胞分泌IL-1β和IL-6量

表2 口腔护理产品对卟啉单胞菌诱导2D口腔细胞的细胞毒性
数据以3个不同实验的平均值±标准差表示。
200ug/mL空白牙膏、含救必应牙膏和丁硼乳膏对P.g (1.6×106 CFU/mL) 刺激细胞24h后,IL-6和IL-1β产量的影响。每个实验至少独立重复3次,数据以均数±标准差(M±SD)表示。
2.2.4 口腔护理产品对卟啉单胞菌诱导的3D口腔黏膜释放IL-6和IL-1β的抑制作用
采用LDH分析方法评价口腔护理产品对3D口腔黏膜的毒性。如表3所示,在20-1000ug/mL的浓度下,空白牙膏对照组、含救必应牙膏组和丁硼乳膏组显示未有细胞毒性。并且如图5显示,空白牙膏对照组对IL-6和IL-1β未有抑制作用。在安全剂量下,相比于空白牙膏对照组,含救必应牙膏组和丁硼乳膏组对P.g诱导的3D口腔黏膜分泌的IL-6和IL-1β有显著的抑制作用。500ug/mL的含救必应牙膏组和丁硼乳膏组对IL-1β的抑制率到达56.02%和84.96%,对IL-6的抑制率到达78.52%和90.86%。提示,此3D口腔黏膜模型可能适用于产品的抗炎功效评价。

表3 口腔护理产品对卟啉单胞菌诱导3D口腔细胞的细胞毒性
不同浓度空白牙膏对照组(200μg/mL~1000μg/mL)、含救必应牙膏组(200μg/mL~1000μg/mL)、丁硼乳膏组(200μg/mL~1000μg/mL)对卟啉单胞菌(1.6×106CFU/mL)刺激3D口腔黏膜24h后,IL-6和IL-1β产量的影响。每个实验至少独立重复3次,数据以均数±标准差(M±SD)表示。(# P<0.05 vs. controlgroup; * P<0.05; ** P<0.01; ***P<0.001 vs. LPSgroup)

图6 口腔护理产品对卟啉单胞菌刺激3D口腔黏膜释放IL-6和IL-1β抑制率的影响
2.2.5 口腔护理产品对小鼠耳肿胀TPA致炎模型的抗炎性能作用
为了验证3D口腔黏膜模型对口腔护理产品的抗炎功效评价的有效性,本项目又进行了小鼠耳肿胀试验。由表4中的数据可知,含救必应牙膏组和丁硼乳膏组对耳肿胀的抑制率分别达到36%和35%,且无显著差异,两款口腔护理产品具有较好的抗炎效果,同3D口腔黏膜模型验证效果一致。

表4 小鼠耳肿胀TPA致炎模型评估含救必应提取物的口腔护理产品的抗炎性能
2.2.6 含救必应提取物的口腔护理产品的临床测试
为更进一步验证3D口腔黏膜模型对口腔护理产品的减轻牙龈炎症的效果的准确性,本项目进行了临床试验。在100名受试者的测试中,86例受试者(实验组43例,对照组43例)完成试验。失访的14例是因为个人和家庭原因,非试验牙膏的不良反应。两组在基线时的各项指标基本类似(表5)。

表5 完成研究人群的基线检查结果
两组试验结果分别见表6。6周检查结果:使用试验牙膏与对照组比较,6周减少龈上菌斑和龈炎指数分别为1.97%与6.24%。组间均未显示统计学意义的差异(P>0.05)。12周检查结果:使用含复合物牙膏组(实验组)较使用不含复合物牙膏组(对照组)减少龈上菌斑13.95%、含复合物牙膏组(实验组)较不含复合物牙膏组(对照组)的龈炎指数减少13.77%。PI和GI在组间均显示统计学意义的差异(P<0.01)。

表6 试验前后受试者牙龈指数与菌斑指数变化情况
临床研究表明,使用含复合物牙膏与使用不含复合物牙膏相比,具有控制牙菌斑、抑制牙菌斑的形成,降低龈炎指数,减轻牙龈炎的趋势,具有改善牙龈健康的作用。12周组间具有统计学显著性差异(P<0.05),12周临床研究未观察到该牙膏的副作用。
3 讨论与分析
本研究以正常的人体口腔黏膜生理结构和功能为基础,成功开发了3D口腔黏膜模型。研究构建的3D口腔黏膜模型包括基底层以及固有层之外,还包括上皮层,从而高度接近人体口腔黏膜的上皮组织的结构。由于将成纤维细胞复合于生物支架材料内部,使生物支架材料模拟细胞外基质的作用,在细胞之间形成适宜的空间分布和细胞联系,并且使上皮细胞在固有层表面接种,通过气液面培养法使上皮细胞复层化,使该模型接近人体口腔黏膜的上皮组织的结构和功能。该3D口腔黏膜模型制备周期短,方法简易,可控性强,原料易于获取,可实现大规模产业化生产,保证维持口腔黏膜各层细胞生长的微环境,制备的全层口腔黏膜更接近于正常人体口腔黏膜结构,并具备相应的功能性。
为验证所构建3D口腔黏膜模型能够满足相关口腔黏膜生物学检测的需求,本研究立足于含救必应提取物的口腔护理产品的抗炎功效测试,对比2D模型、3D口腔模型、动物实验和临床实验的相关性,探讨了口腔黏膜体外三维细胞模型相对应用在口腔护理产品功效验证中的可行性。一方面,可以寻找并建立更加快捷可靠的抗炎评价方法;另一方面,也是为口腔护理行业动物替代实验进行探索,最终旨在为口腔护理产品开发及功效验证提供一个新思路。研究结果发现,3D口腔模型相较于2D模型在口腔护理产品的抗炎功效评估过程中更具有可靠性和准确性。既弥补了传统的使用单层黏膜组织模型的方法的缺陷,在缩短构建时间、降低成本的同时,又保证了模型的安全性与功效性。未来,3D口腔黏膜模型将成为首选的口腔体外抗炎评价工具。

