纯钛表面制备纳米氧化镁薄膜的抗菌性能研究*
林 豪 韩 蕊 黄萍萍 徐礼斌 杨 晶 马 雷
种植义齿具备美观、舒适以及功能性好等优势,逐渐成为牙列缺损患者更青睐的选择。种植体周围炎是种植修复常见的并发症[1]。最近一项Meta分析显示欧洲和北美等区域种植体周围炎的发生率高达22%[2],其发生的根本原因为细菌在种植义齿周围黏附、堆积[3,4],牙龈卟啉单胞菌是种植体周围炎的主要致病菌[5]。减少细菌在种植义齿表面的附着,是预防种植体周围炎发生的关键[6]。
钛为牙科种植体的最常用的材料,然而,钛本身不具备抵抗细菌粘附的特性。因此,通过对钛的表面改性,使细菌无法粘附在种植体表面,成为预防种植体周围炎的研究热点。近年来,无机纳米颗粒由于其优异的抗菌活性而受到越来越多的关注,有关银纳米粒子、二氧化硅纳米粒子、氧化锌纳米粒子、钴纳米粒子等研究均较为广泛[7-10]。纳米氧化镁作为无机纳米颗粒的一种,具有制作成本低,抗菌效果优异等优势[11-13]。研究证明,纳米氧化镁对革兰氏阴性杆菌和革兰氏阳性杆菌均有很好的抑菌作用[14,15]。
物体表面制备纳米氧化镁的方法有多种,现阶段最常用的包括化学沉积法,溶胶-凝胶法以及磁控溅射等方法。其中,化学沉积法存在以下缺点:1.薄膜厚度难以控制;2.反应不够彻底,溶液易造成环境污染。溶胶-凝胶法的操作及装置较为简单,但这一方法的主要缺陷是:样本在制作过程中,极易发生团聚,影响样本的质量[16]。而磁控溅射有着操作简便、结合强度高、无污染、薄膜生长均匀致密等优势[17],可以很好的弥补前两者的缺陷。因此本实验拟利用磁控溅射技术在纯钛表面制备不同厚度纳米氧化镁薄膜,并检测其对牙龈卟啉单胞菌的抑菌作用。
1.材料和方法
1.1 实验试剂99.99%氧化镁靶材(中诺新材北京科技有限公司),维生素K、氯化血红素、厌氧产气包、BHI培养基、琼脂粉(青岛海博生物技术有限公司),细胞α-MEM培养基、胎牛血清(BI,以色列),CCK-8试剂(MCE,美国),磷酸盐缓冲溶液(大连美仑生物技术有限公司),0.25%胰蛋白酶、链霉素-青霉素双抗(Solarbio,中国),MC3T3-E1 subclone 14小鼠前成骨细胞(中国科学院上海生命科学研究院细胞资源中心)。
1.2 实验设备 高真空磁控溅射薄膜沉积系统(中国科学院沈阳科学仪器股份有限公司),扫描电镜(zeiss supra,德国),X射线能谱仪(Oxford,英国),原子力显微镜(Bruker,美国),X射线衍射仪(Bruker,德国),酶标仪(BIO-TEK,美国),CO2恒温细胞培养箱(Wiggens,德国),电感耦合等离子发射光谱仪(ICPE-9000,日本)。
1.3 样本制作 首先制作直径14 mm,厚3 mm的圆形钛片,然后将各组钛片抛光备用。采用磁控溅射技术,以纯度>99.99%的氧化镁为靶材,以圆形钛片为底材,将各组钛片放入真空反应室,通入氩气,气压3.5 Pa,恒温20℃,真空度为6.0×10-5,沉积速率为1.37 nm/min。MgO-Ⅰ组沉积73 min,约100 nm厚度;MgO-Ⅱ组沉积146 min,约200 nm厚;MgO-Ⅲ组沉积218 min,约300 nm厚;抛光后不进行磁控溅射沉积的记为Ti组。
1.4 表面特征 使用扫描电镜(SEM)观察各组样本表面形貌。通过X射线能谱(EDS)分析各组样本表面元素。使用原子力显微镜(AFM)对各组样本表面粗糙度进行分析。通过X射线衍射(XRD)对各组表面进行物相分析。
1.5 亲水性测定 使用接触角测量仪分别测量各组样本三次,取平均值进行统计分析。接触角的大小与亲水性成反比。
1.6 镁离子释放 样本在37℃的10 ml PBS中浸泡1、3、5、7、14天。同一时间点收集上清液,使用电感耦合等离子体发射光谱仪检测镁离子的释放量。
1.7 体外抗菌检测
1.7.1 细菌培养 实验选用牙龈卟啉单胞菌(Porphyromonas gingivalis,-ATCC 33277)进行抗菌性检测,在添加了维生素K和氯化血红素的BHI培养基上进行厌氧培养。
1.7.2 菌落计数 各组钛片使用75%的酒精浸泡2 h,PBS冲洗,放入24孔板中,于各钛片表面接种60 ul浓度为107CFU/ml的牙龈卟啉单胞菌菌液,培养24 h,PBS冲洗掉未黏附的细菌,将钛片转移到盛有4 ml PBS的离心管中,充分震荡1 min,取400 ul上述液体,加入3.6 ml的PBS中,再稀释10倍和100倍,涂布于固体培养基上,待细菌生长1 d,筛选合适的稀释倍数,进行单菌落计数。
1.7.3 细菌形态 各组钛片使用75%的酒精浸泡2 h,PBS冲洗,放入24孔板中,于各钛片表面接种60 ul浓度为107CFU/ml的牙龈卟啉单胞菌菌液,培养24 h,2.5%的戊二醛固定2 h,PBS冲洗,不同浓度梯度的乙醇(30%、50%、75%、90%、95%、100%)依次脱水,扫描电镜观察细菌形态。
1.8 细胞毒性 采用MC3T3-E1细胞进行细胞毒性检测。将四组样本使用75%的酒精浸泡2 h,PBS冲洗,放入24孔板中,每孔接种4×104个MC3T3-E1细胞,放入37℃的CO2培养箱中培养24 h后,吸出孔内培养基,每个钛片表面加入500 ul的培养基和50 ul的CCK-8试剂,避光培养2 h,然后吸出上述孔内的液体至96孔板中,100 ul/孔,3孔/组。使用酶标仪于波长450 nm下测量各组OD值。然后重复上述步骤测量细胞培养48 h、72 h后的OD值。
1.9 统计学分析 数据分析使用Graph Pad Prism软件,采用单因素方差分析评定差异P的统计学意义。P<0.05认为有统计学意义。
2.结果
2.1 表面特征
2.1.1 磁控溅射原理 采用磁控溅射技术,在钛片上制备纳米氧化镁薄膜。在真空环境中,氧化镁靶材被轰击后生成纳米氧化镁颗粒,纳米氧化镁颗粒不断沉积在钛片上,最终形成连续的薄膜(图1)。
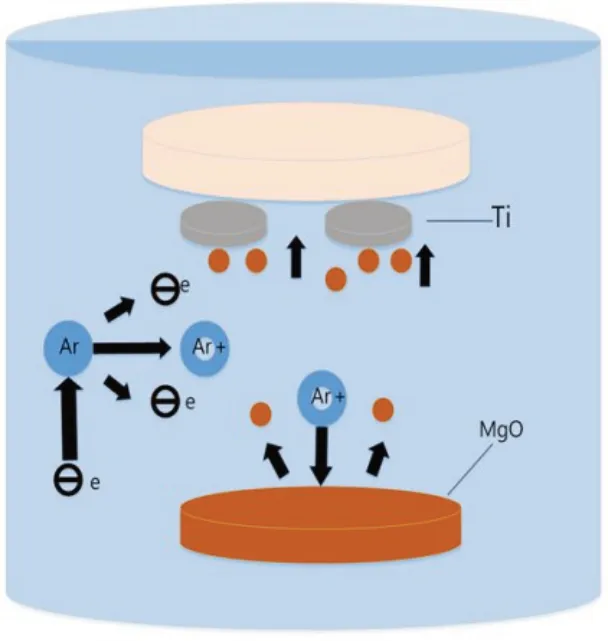
图1 磁控溅射工作原理
2.1.2 扫描电镜Ti组样本表面仅可见少量划痕,未见杂质存在。MgO-Ⅰ表面明显可见有薄膜覆盖,局部薄膜出现裂痕,薄膜分布较均匀。MgO-Ⅱ组样本表面薄膜无裂痕出现,局部可见一些氧化镁的靶材颗粒沉积。MgO-Ⅲ组样本表面薄膜也是清晰可见,值得一提的是,和前三组相比,MgO-Ⅲ组的样本表面沉积了更多的氧化镁颗粒(图2)。
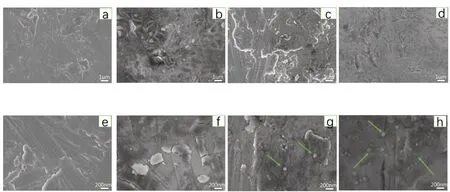
图2 各组SEM观察图像
2.1.3 X射线能谱分析EDS元素含量结果分析显示,除Ti组外,MgO-Ⅰ组、MgO-Ⅱ组和MgO-Ⅲ组表面均可检测出镁元素和氧元素(图3)。
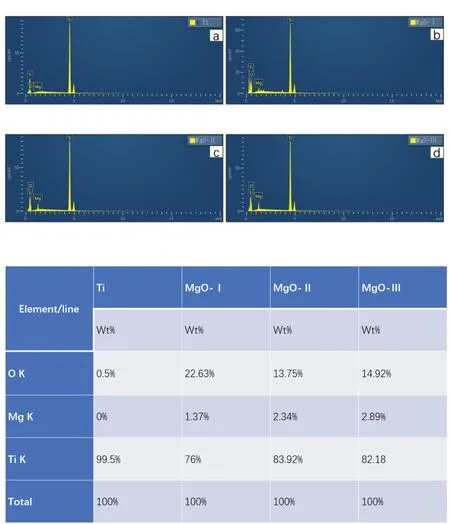
图3 X射线能谱分析结果
2.1.4 X射线衍射Ti组和MgO-Ⅰ组仅见Ti的衍射峰,MgO-Ⅱ和MgO-Ⅲ组表面除Ti的衍射峰外,MgO的衍射峰也开始出现,并且部分Ti的衍射峰消失(图4)。
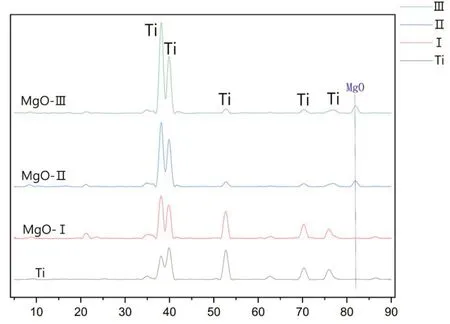
图4 各组X射线衍射结果
2.1.5 粗糙度Ti组,MgO-Ⅰ组,MgO-Ⅱ组和MgO-Ⅲ组的RA分别为(39.07±2.8 nm)、(49.93±3.89 nm)、(70.4±4.73 nm)、(78.23±3.84 nm),表明随纳米氧化镁薄膜厚度的增加,样本表面的粗糙度也在增加。与Ti组相比,实验组的粗糙度显著增加(P<0.05)。与MgO-Ⅰ组相比,MgO-Ⅱ组和MgO-Ⅲ组两者的粗糙度也有显著增加(P<0.001)。MgO-Ⅱ组和MgO-Ⅲ组两者相比,样本表面粗糙度无差异(P>0.05)(图5)。

图5 各组原子力显微镜图像及粗糙度
2.1.6 亲水性Ti组表面的水接触角最大,为(56.82±2.66)。MgO-Ⅰ组和MgO-Ⅱ组表面的水接触角有所减小,分别是(37.83±0.59)和(36.42±0.67),而MgO-Ⅲ组表面的水接触角最小,是(28.44±1.48)。Ti组与实验组相比,水接触角明显增大(P<0.05),表明Ti组的亲水性最差。MgO-Ⅰ组和MgO-Ⅱ组之间的水接触角变化不明显(P>0.05)。MgO-Ⅲ组与其余三组相比,其表面的水接触角最小(P<0.05),表明MgO-Ⅲ组的亲水性都要好(图6)。

图6 各样本表面水接触角代表性图像及接触角数值统计学分析
2.1.7 镁离子释放MgO-Ⅰ组、MgO-Ⅱ组和MgO-Ⅲ组表面的镁离子在第一天都获得了爆发性释放,各组初期的释放速度较快,随着时间的推移,释放速度逐渐减慢。第三天,MgO-Ⅰ组镁离子释放开始减少,基本消失不见。MgO-Ⅱ组镁离子的释放持续到第5 d才开始变得缓慢,后续仍有少量镁离子释放。MgO-Ⅲ组镁离子一直持续释放,在7-14 d,仍可检测到镁离子的释放(图7)。
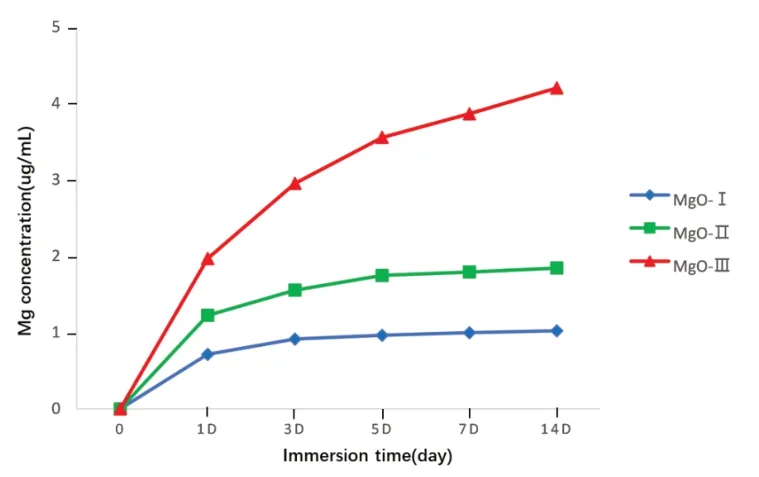
图7 MgO‑I、MgO‑Ⅱ、MgO‑Ⅲ镁离子释放曲线
2.2 体外抗菌活性
2.2.1 菌落计数Ti组表面的牙龈卟啉单胞菌可以正常生长,而其余覆盖纳米氧化镁薄膜的三组,样本表面牙龈卟啉单胞菌的生长均受到抑制,并且随着薄膜厚度的增加,菌落数也逐渐减少。MgO-Ⅰ组对牙龈卟啉单胞菌的平均抑菌率达78.14%,MgO-Ⅱ组和MgO-Ⅲ组的平均抑菌率更高,分别为87.16%和99.86%。各组之间的平均抑菌率,存在明显差异(P<0.001)(图8)。
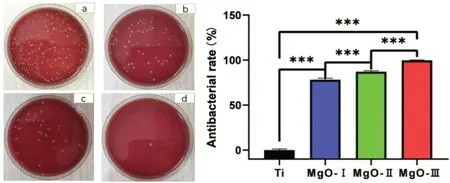
图8 各组对牙龈卟啉单胞菌的抗菌效果及抗菌率
2.2.2 细菌形态Ti表面,细菌形态完整,细菌生长良好,MgO-Ⅰ组表面出现破裂的细菌,两者之间的数量无明显差异。MgO-Ⅱ组和MgO-Ⅲ组表面的细菌数量明显减少,且大部分细菌出现破裂,无完整结构(图9)。
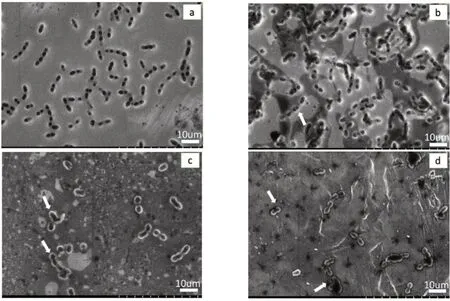
图9 各组扫描电镜下的细菌形态
2.3 细胞毒性实验 使用MC3T3-E1细胞进行细胞毒性检测,分别测试24 h、48 h和72 h三个时间段的细胞存活率,各组细胞存活率无明显统计学差异(P>0.05),表明三种厚度的纳米氧化镁薄膜均无细胞毒性(图10)。
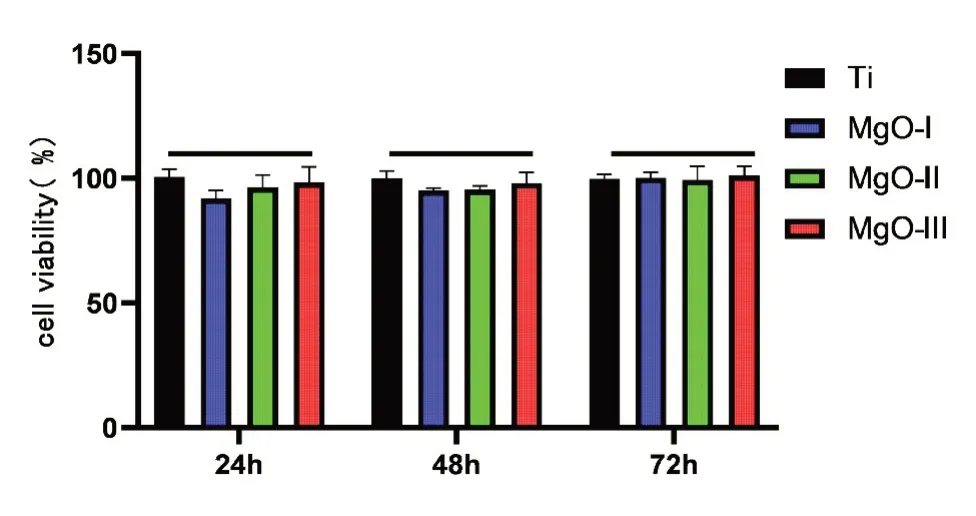
图10 各组样本表面培养MC3T3‑E1细胞不同时间点的细胞活性
3.讨论
随着种植义齿的广泛应用,种植体周围炎的发病率也逐渐增加[18,19]。为了减少种植体周围炎的发生,人们不断进行着探索和研究,其中表面改性是一大热点。现有的抗菌涂层,都或多或少的存在各种缺陷,例如,抗菌肽(AMPs)的稳定性差[20],银等金属离子存在细胞毒性[21],TiO2需要光照发挥抗菌效果等。因此,人们一直致力于开发一种简便、安全、有效的涂层。
纳米氧化镁具有制作简单、价格低廉、抗菌效果优异等优点,研究证明其对革兰阳性菌和革兰阴性菌都有一个良好的抗菌活性[22,23]。因此,纳米氧化镁涂层可解决当前涂层存在的多种弊端。作为物理气相沉积的一种方式,磁控溅射操作简便,薄膜与底材的结合强度高,无污染,所生成的薄膜致密[17]。基于上述考虑,本研究选用磁控溅射技术,制备了不同厚度的纳米氧化镁薄膜,探索其对牙龈卟啉单胞菌的抗菌效果。种植体表面改性涂层的结合强度对于涂层发挥长期的生物学作用具有重要影响。但遗憾的是,目前并没有较为可靠准确的方法来测量涂层与钛表面的结合强度。先前研究表明,通过磁控溅射法在钛的表面上形成的羟基磷灰石涂层的拉伸粘结强度可达80MPa[24]。赵玉涛等人借助磁控溅射技术在钛表面制备了HA/YSZ(钇稳定氧化锆,Yt-tria stabilized zirconia)生物梯度涂层,通过检测得出钛与该涂层之间结合强度可达60 MPa[25]。因此,我们认为通过磁控溅射在钛表面形成的涂层是稳定可靠的。
实验结果表明,厚度约100 nm的薄膜已具备良好抑菌效果且随薄膜厚度的增加,其抗菌效果也会增强,当薄膜厚度达到约300 nm时,牙龈卟啉单胞菌基本无法在其表面存活。由此可见,通过控制纳米氧化镁薄膜的厚度,可获得理想的抗菌效果。此外,观察扫描电镜下的细菌形态显示,除Ti外,另外三组均出现破碎的细菌,并且MgO-Ⅱ组和MgO-Ⅲ组表面的细菌数量明显减少。由此可得出结论,纳米氧化镁薄膜不仅可以抑制牙龈卟啉单胞菌的生长,还可破坏细菌的结构。
目前纳米氧化镁的抗菌机制尚未明确,大部分研究人员认为纳米氧化镁的抗菌机制与活性氧(reactive oxygen species,ROS)损伤有关。溶液中存在的O2在纳米氧化镁的催化作用下发生还原反应,产生的超氧阴离子自由基O2-可以破坏细胞膜壁,从而杀死细菌[26]。Hewitt提出纳米氧化镁催化O2发生催化反应,依靠的是其表面存在的氧空位,进一步导致脂质过氧化和ROS的产生[27]。此外,纳米氧化镁与水反应生成Mg(OH)2,形成的碱性环境可以为O2-提供更加稳定的一个环境,提高杀菌效果[28]。
然而,Leung[29]制作了三组不同的纳米氧化镁,发现三组纳米氧化镁对大肠杆菌均有良好的抗菌效果,但只有一组纳米氧化镁可以检测出ROS,因此提出纳米氧化镁可能通过与细菌接触,改变细胞膜周围PH值,或者释放Mg2+,来破坏细菌结构,以达到抗菌效果。此外,Yamamoto[30]等也通过实验发现,纳米氧化镁除引起氧化损伤外,也可吸附到细菌表面,破坏细菌结构。纳米氧化镁的尺寸小,比表面积大,可以更好的与细菌相接触。综上所述,关于纳米氧化镁的抗菌机制,仍存在争议,还有待进一步研究。
本实验中,实验组和对照组对牙龈卟啉单胞菌的抗菌效果存在差异,也与纳米氧化镁薄膜表面亲水性较强有关。因为疏水利于细菌在物体表面黏附[31],其可能由于蛋白质的吸附作用及细菌与疏水表面的相互作用。同时,Yang等人通过实验发现,比起疏水表面,人骨髓间充质干细胞更易黏附于亲水的表面[32]。这对于种植义齿修复的临床治疗,是非常有利的。
样本的粗糙度也是本次实验需要关注的一项物理特征,因为粗糙度和细菌黏附也有密切的关系。研究表明,粗糙物体的表面比光滑物体更容易引起细菌的黏附[33]。为进一步研究粗糙度对细菌黏附的影响,Bollen CML制作了普通机械加工处理的钛的基台和高度抛光的陶瓷基台,并通过比较两者表面的口腔多种微生物的黏附数量,提出了一个影响细菌黏附的粗糙度的精准阈值,当粗糙度大于200 nm时,会使细菌黏附增加[34]。本研究中,实验组因为表面纳米氧化镁颗粒的存在,粗糙度比起对照组均有所增加,但各组的Ra值都远低于200 nm,所以纳米氧化镁颗粒导致的粗糙度增加并不会影响细菌的黏附。
4.结论
在本研究中,通过在钛表面制备不同厚度的纳米氧化镁薄膜,有效地抑制了牙龈卟啉单胞菌的生长。实验结果表明,纳米氧化镁有望用于种植义齿表面,预防种植体周围炎的发生。本研究尚存在不足之处:⑴关于纳米氧化镁对牙龈卟啉单胞菌的确切抗菌机制还有待进一步探究;⑵纳米氧化镁薄膜对钛的机械强度的是否会有影响,以及材料在口腔内长期存在后薄膜的结合强度是否会改变仍有待于进一步研究。我们相信,随着材料的发展和技术的进步,纳米氧化镁有望成为各领域中常用的抗菌材料。

