纯芝麻酱中花生致敏蛋白Ara h2、Ara h3及芝麻蛋白2S albumim的分析鉴定比较
任秀,王亚萍,白继超,周巍,张晓东,陈怡文,崔生辉*,林兰*
(1.中国食品药品检定研究院,北京 100050)
(2.河北省食品检验研究院,河北省食品安全重点实验室,河北石家庄 050071)
芝麻味甘、性平,有补血明目等多种功效,可用于治疗头发早白、贫血萎黄等症[1,2]。芝麻酱由炒熟的芝麻仁研磨而成,呈黏稠糊状,有香味,可调味可佐餐[3],其中含丰富蛋白质及矿物质[4],受到广大消费者的喜爱。芝麻与花生售价悬殊,一些企业为获得更高的利润,在芝麻酱中掺入花生成分,甚至使用霉烂花生、玉米糕粉加入其它植物油和添加剂等制作没有芝麻的芝麻酱[5]。1995年,联合国粮食与农业组织(FAO)认定了8种最常见的致敏食物,可引起90%以上食物过敏反应,花生即为其中之一[6]。文献报道,世界范围内花生过敏人群不在少数,美国约为1.1%[7],丹麦约为0.2%~0.4%[8],英国约为0.5%[9]。我国对花生过敏的人群也在增多。经调查显示,协和医院变态反应科约有4%就诊患者因食用花生而引起过敏[10]。花生中的致敏物质热稳定性高、耐酸、耐酶解,一般的生产方式无法去除[11],仅100 μg花生足以引起敏感人群轻度过敏,如荨麻疹[12],若摄入较多,则会引起严重的过敏反应,如皮炎、哮喘、呼吸困难乃至死亡[13]。因此,为保证消费者的饮食安全,很多发达国家在食品包装标签中强制要求标识花生等过敏原成分[14]。
目前国内外检测过敏成分主要针对过敏原蛋白和DNA残留进行[15],主要方法有酶联免疫吸附法(ELISA)、免疫印迹法、聚合酶链式反应法(PCR)、实时荧光定量PCR法(Real-time PCR)、生物传感器法及质谱法等。这些方法中,酶联免疫吸附法发展较为成熟,实时荧光定量PCR检测法特异性较高[16,17],二者各有优缺点,检测结果也有一定差异。张晓东等[18]使用实时荧光定量PCR法与酶联免疫吸附法在核桃露(乳)饮品中检测花生和大豆成分也印证这一发现。
针对芝麻检测的主要过敏蛋白是芝麻2S albumin蛋白(又名2S白蛋白),在芝麻蛋白中所占比例较高,约为25%,是主要的致敏蛋白。目前权威认可的花生过敏原有11种,Ara h2、Ara h3是主要作为检测的过敏原,可被90%花生过敏患者识别,其中Ara h2被认为是致敏性最强的花生过敏原。
查阅文献,目前暂无文献报道实时荧光定量PCR检测法与酶联免疫吸附法应用于芝麻酱中花生源检测结果对比分析。2017年原国家市场监督管理总局发布的食品补充检验方法《植物蛋白饮料中植物源性成分鉴定》(BJS 201707)(以下简称补充检验方法)中[19],推荐应用实时荧光定量PCR方法特异性检测植物蛋白饮料中的花生源性成分。本研究使用酶联免疫吸附法和补充检验方法中推荐的实时荧光定量PCR法对市售纯芝麻酱中花生源性成分进行了检测及对比。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
十六烷基三甲基溴化铵缓冲液(CTAB),德国amresco公司;蛋白酶K(20 mg/mL),德国Roche公司;DNA提取液(酚:氯仿:异戊醇=25:24:1),北京索莱宝公司;DNeasy Plant Mini Kit试剂盒,德国Qiagen公司;PCR试剂盒,中国Takara公司;QubitTMdsDNA BR Assay kit,美国赛默飞世尔公司;PA3-EK-96花生过敏原检测试剂盒,美国BioFront公司。
CTAB裂解液:20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris-HCl,0.02 mol/L EDTA,pH=8.0。
1.1.2 引物及探针
参照《植物蛋白饮料中植物源性成分鉴定》(BJS 201707)补充检验方法提供的芝麻源和花生源引物及探针序列(表1),由英潍捷基(上海)贸易有限公司合成,经PAGE方法进行纯化。
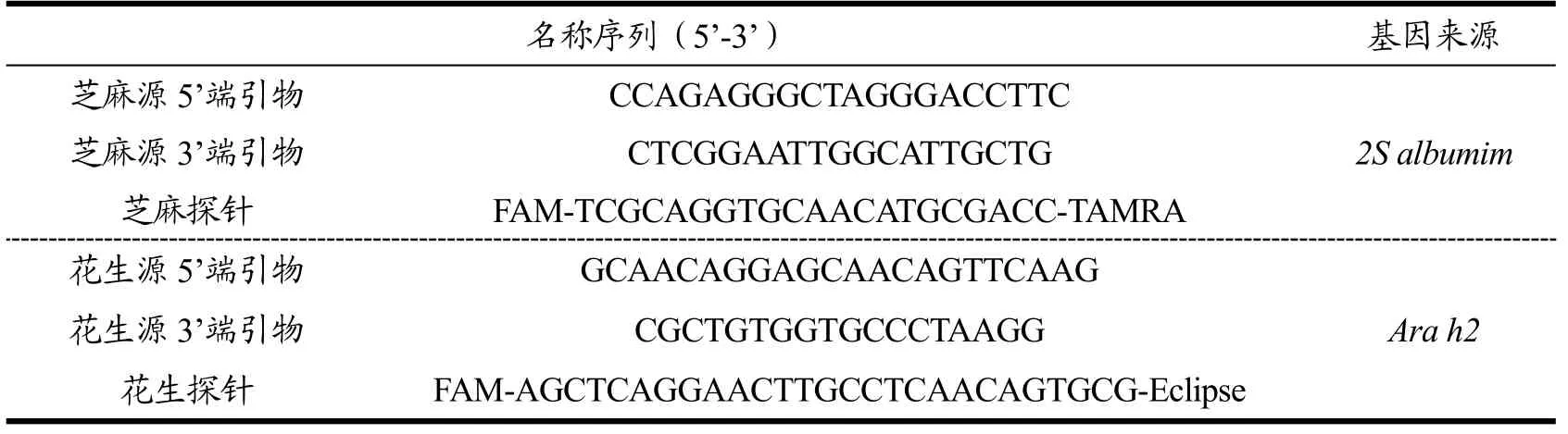
表1 芝麻源和花生源检测用引物及探针序列Table 1 Primer and probe sequence for detection
1.1.3 样品
纯芝麻酱样品采集:从超市(48批次)、菜市场(12批次)及网络店家(30批次)采购芝麻酱样品90批次,标签标识均声称仅使用芝麻作为原料。其他样品采集:花生、芝麻、核桃、杏仁、榛子、大豆实物样品,均购于北京大型超市,组织研磨仪粉碎成粉末后待用。
1.2 仪器与设备
SWB25恒温振荡水浴,美国赛默飞世尔公司;PL2002电子天平,瑞士梅特勒托利多公司;Qubit 1.0核酸蛋白定量仪,美国Invitrogen公司;ND2000核酸蛋白分析仪,美国赛默飞世尔公司;CFX96实时荧光定量PCR仪,德国Bio-Rad公司;TissueLyser II组织研磨仪,德国QIAGEN公司;Synergy HT多功能酶标仪,美国BioTek公司。
1.3 实验方法
1.3.1 实时荧光定量PCR方法
1.3.1.1 DNA提取
将芝麻酱样品静置,弃上层油层后,混匀,称取300 mg芝麻酱样品于2 mL离心管中,加入适量灭菌玻璃珠,使用组织研磨仪在290 Hz频率下研磨3 min。研磨后,加入600 μL CTAB缓冲液和10 μL蛋白酶K,56 ℃恒温震荡30 min。震荡结束后,吸取消化液500 μL,2000 r/min离心15 min后,吸取上清液至新的2 mL离心管中,加入等体积-20 ℃预冷的异丙醇,震荡均匀,12000 r/min离心20 min后,弃上清液,将沉淀用柱式DNA提取试剂盒进行纯化。花生等实物样品DNA使用DNeasy Plant Mini Kit试剂盒,参考说明书方法进行提取。提取后使用Qubit 1.0核酸蛋白定量仪及ND2000核酸蛋白分析仪进行DNA浓度及纯度测定。
1.3.1.2 实时荧光定量PCR检测
实时荧光定量PCR方法进行纯芝麻酱中芝麻蛋白2S albumin基因及花生致敏蛋白Ara h2基因检测。检测反应体系为25 μL,其中10×PCR buffer缓冲液2.5 μL,dNTP mix(2.5 mmol/L)1 μL,50 μmol/L上游及下游引物各0.2 μL,50 μmol/L探针0.2 μL,5 U/μL Taq酶0.15 μL,DNA模板2 μL,用无菌去离子水补至25 μL。反应条件如下:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s(收集荧光),40个循环;12 ℃保存。每个样品独立重复检测三次,每次检测时设置两个平行复孔。
1.3.2 酶联免疫吸附法
1.3.2.1 蛋白提取
参考试剂盒说明书方法进行。具体方法如下:将芝麻酱样品静置,弃上层油层后,混匀,称取100 mg芝麻酱样品于1.5 mL离心管中,加入900 μL预热至100 ℃的1×抽提缓冲液,混匀并短时震荡使管中物品悬浮。置于99 ℃恒温震荡水浴中孵育10 min,孵育期间使用950 r/min转速进行震荡。结束后,室温2000 r/min离心10 min,取上清液200 μL转移至96孔检测板中。
1.3.2.2 花生致敏蛋白Ara h3酶联免疫吸附法检测
将检测板在室温下孵育10 min后,弃去孔中物品,在吸水纸上拍打去除剩余液体。用1×洗涤缓冲液(WB)洗涤三次。每次用量≥200 μL。而后在每孔中加入100 μL 1×花生抗体耦合物(CON)。将检测板置于黑暗环境中室温孵育10 min。弃去孔中物品,再次洗涤。在每孔中加入100 μL HRP底物(SUB)。将检测板置于黑暗环境中孵育10 min。在每孔中加入100 μL淬灭溶液(STOP)。使用酶标仪在450 nm处读取各孔的吸光度值。结合三阶多项式曲线拟合,进行花生致敏蛋白Ara h3成分的含量计算。每个样品独立重复检测三次,每次每个样品设置两个平行复孔。每次样品检测同时测定试剂盒提供的标准蛋白,以用于标准曲线的绘制。
1.3.3 方法学验证
实时荧光定量PCR方法称取300 mg样品提取DNA,酶联免疫吸附法称取100 mg样品提取蛋白,按照以下方法进行验证。
特异性:芝麻、核桃、杏仁、榛子、大豆进行检测,与花生比较结果。
重复性:花生样品提取后独立进行三次重复检测。
灵敏度:花生样品提取后,无菌去离子水进行10倍系列稀释,从10-1稀释至10-6后进行检测。
1.4 数据处理
实时荧光定量PCR法:查看样品检测的原始扩增曲线是否正常,若存在扩增曲线不典型、异常或扩增CT值结果与直观可见结果不符时,在荧光信号阈值设置中将荧光本底信号扣除以进行校正,结果保留两位小数。
酶联免疫吸附法:根据花生过敏原检测试剂盒中所带标准蛋白质控样品检测结果,绘制OD值与蛋白浓度的标准曲线。将样品检测的OD值结果带入标准曲线计算所测得的蛋白浓度,结果保留两位小数。
2 结果与讨论
2.1 两种花生成分检测方法的验证结果
芝麻、核桃、杏仁、榛子、大豆及花生实物样品粉末提取DNA后,使用Qubit 1.0核酸蛋白定量仪进行浓度测定,提取的DNA浓度均大于10 ng/μL,A260/280吸光度比值均在1.8~2.2之间。使用花生Ara h2基因引物及探针对芝麻、核桃、杏仁、榛子、大豆及花生DNA进行荧光定量PCR检测,扩增CT值均大于40(见图1);同时使用花生Ara h3蛋白酶联免疫吸附法检测试剂盒对上述样品进行检测,除花生外,其余样品结果均显示为阴性(见表2)。
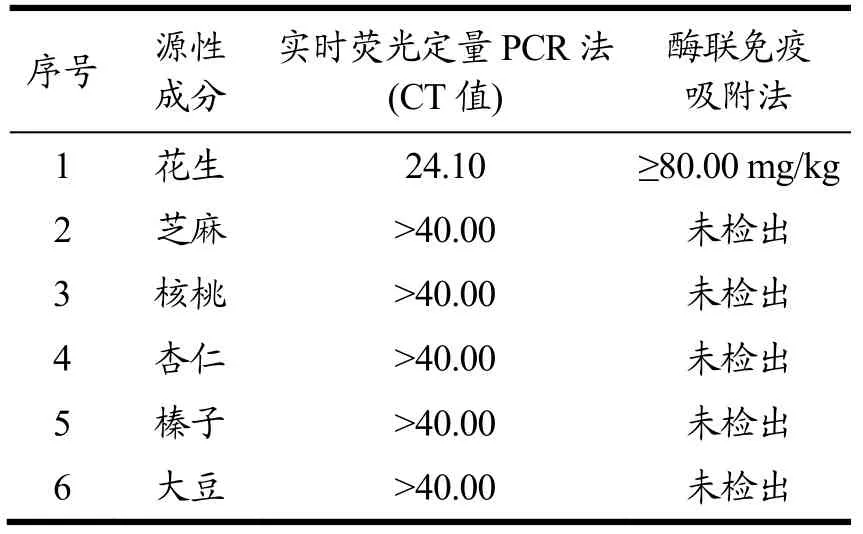
表2 实时荧光定量PCR法及酶联免疫吸附法特异性检测结果Table 2 Test results of real-time PCR and ELISA
使用实时荧光定量PCR法对从花生样品提取的DNA进行三次独立重复检测,CT值基本一致(MeanCT=23.54,RSD=1.4%)(见图2);使用酶联免疫吸附法对从花生样品提取的蛋白进行三次重复检测,结果均为阳性(见表3)。
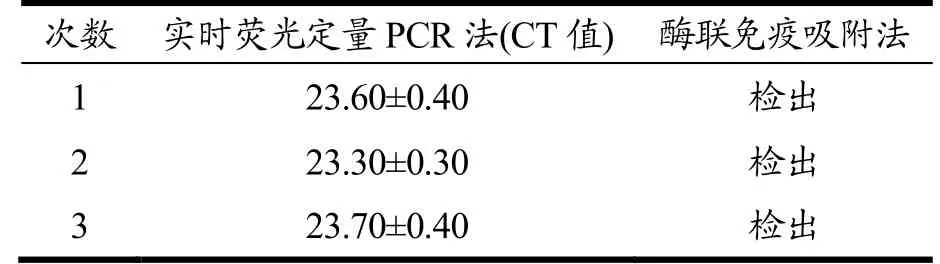
表3 实时荧光定量PCR法及酶联免疫吸附法重复性检测结果Table 3 Repeatability test results of real-time PCR and ELISA
验证结果显示,两种花生成分检测的方法,特异性及重复性良好、稳定。因此,本研究所用的两种方法均适用于芝麻酱样品中花生源的检测,可为今后相关研究提供基础数据。
实时荧光定量PCR方法可对花生样品10-3稀释度DNA提取液检出,10-4稀释度不可检出;酶联免疫吸附法均可对花生样品10-1至10-6稀释度蛋白提取液检出(见图3)。可见酶联免疫吸附法灵敏度更高,具体检测结果汇总见表4。
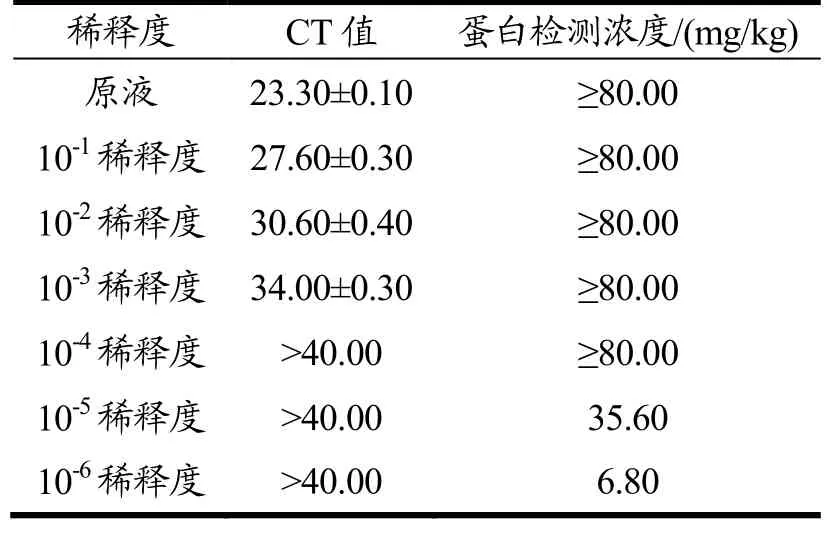
表4 实时荧光定量PCR及酶联免疫吸附法灵敏度检测结果Table 4 Sensitivity test results of real-time PCR and ELISA
2.2 样品检测结果
2.2.1 实时荧光定量PCR法检测结果
使用Qubit 1.0核酸蛋白定量仪进行测定显示,从90批次芝麻酱样品中提的DNA浓度介于0.10 ng/μL至45.80 ng/μL之间,A260/280吸光度比值均在1.8~2.2之间。通过实时荧光定量PCR方法,90批次样品DNA均检出芝麻蛋白2S albumin基因,CT值介于22.00~33.80之间,检测结果见表5。使用实时荧光定量PCR方法与酶联免疫吸附方法进行花生成分检测验证时,花生样品均可检出,芝麻、核桃等其余5种样品均未能检出,无交叉影响,方法重复检测3次后结果一致、稳定。其中45批次样品DNA(50.00%)检测出花生致敏蛋白Ara h2基因,其CT值介于25.60~38.60之间(见表5)。
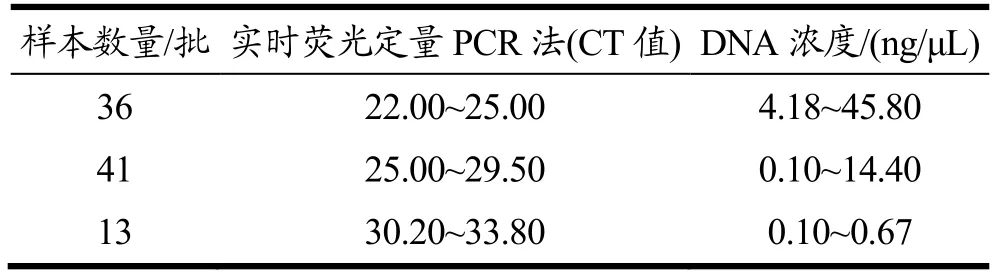
表5 实时荧光PCR法检测芝麻源DNA结果Table 5 Results of real-time PCR detection of sesame-derived DNA
2.2.2 酶联免疫吸附法检测结果
90批次芝麻酱样品中,使用酶联免疫吸附法,83批次样品中检出花生过敏蛋白Ara h3,其中有62批次蛋白含量的检测值大于80.00 mg/kg,45批次与实时荧光定量PCR法花生致敏蛋白Ara h2基因检测结果一致;其余21批次的蛋白含量在2.60~78.00 mg/kg之间,这些样品实时荧光定量PCR法均未检出花生致敏蛋白Ara h2基因(表6)。

表6 实时荧光PCR法和酶联免疫吸附法检测花生源结果Table 6 Results of real-time PCR and ELISA detection of sesame-derived DNA
2.3 讨论
实时荧光定量PCR方法检测芝麻2S albumin基因时,所有样品均可检出,可见市售芝麻酱均使用了芝麻作为加工原料,未存在不使用芝麻制作的造假行为。理论上,CT值与待扩增样品DNA含量成反比,DNA浓度越高,CT值越小。本研究中CT值小于30.00的为77批次纯芝麻酱存在DNA浓度很低的样品(0.1 ng/μL),不符合理论情况。实时荧光定量PCR方法与酶联免疫吸附方法检测花生成分时,酶联免疫吸附方法检测出的阳性样品更多,方法更灵敏。酶联免疫吸附方法与实时荧光定量PCR方法灵敏度有大于1000倍的差异(见表4)。在90批次真实样品的花生成分检测中,酶联免疫吸附法检出花生成分的样品比实时荧光定量PCR检测方法检出花生成分的样本多38个,主要集中在酶联免疫吸附法检出蛋白含量较低的浓度范围内(≤80.00 mg/kg)。在酶联免疫吸附法检出花生成分的蛋白含量≥80.00 mg/kg时,有72.60%(45/62)的样品可被实时荧光定量PCR方法检出。
芝麻酱进行加工制作时,需要经过除杂、清洗和烘焙等工艺[20],其中烘烤和磨浆最为关键[21]。烘烤时原料会经过约150 ℃高温处理15~20 min后迅速降到25 ℃研磨,会严重破坏DNA结构,放置过程也会缓慢降解,即使DNA浓度可检测(见表5)也无法进行正常的PCR扩增反应或扩增CT值滞后。另外,实时荧光定量PCR方法基于花生过敏原Ara h2致敏蛋白的基因,检测时要通过检测编码过敏蛋白的基因进行间接检测,芝麻酱加工工艺会在一定程度上将DNA及蛋白分离,PCR手段检测结果也会受到影响,以致实时荧光定量PCR方法灵敏度受到限制。酶联免疫吸附法检测基于花生过敏原Ara h3蛋白,此蛋白属于Cupin超家族(Cupin Superfamily)中11S球蛋白六聚体(豆球蛋白)的一种,结构上有至少6个β-折叠形成的桶状结构,比较稳定,其三级结构具耐热性[22],因此检测时具有更好的灵敏度。
纯芝麻酱中检出花生源成分的情况时有发生。查阅文献,袁茵等[23]使用PCR方法检测17批次纯芝麻酱样品,发现64.70%(11/17)的样品中含有花生成分;谢文佳等[24]使用LAMP技术检测市场流通环节标识为纯芝麻酱的41批次样品中植物源成分,43.90%(18/41)的样品中检出花生源成分。二人检测结果中花生检出率与本研究中荧光定量PCR方法花生检出率(50.00%,45/90)基本一致。由于检测芝麻酱中花生源成分时,未见应用酶联免疫吸附法进行相关研究的报道,因此无法比较本研究与其他研究人员检测数据是否一致。
3 结论
3.1 本研究中,实时荧光定量PCR方法更方便快捷,但对于样品中花生含量较低的样品检测时存在一定难度,可能存在假阴性结果。而酶联免疫吸附法虽检测价格较高,但灵敏度高,可检出的花生含量更低。两种方法检测结果在高浓度样品中具同一性,在考虑加工工艺、食品样品特点等情况后,预估花生成分含量较高的食品样品可选择使用本研究中实时荧光定量PCR方法检测,较低或无法预估的则可使用本研究中酶联免疫吸附法检测。
3.2 目前本研究方法只能进行样品中花生源定性及含量小于80.00 mg/kg浓度下的半定量检测,无法具体测算样品中所含花生及芝麻比例。鉴于一些厂家生产线可能存在多个产品共线加工的情况,本研究还无法区分交叉污染。下一步我们将更加深入研究,希望能对样品中花生源成分检出是否存在恶意添加行为找到线索。
3.3 本研究中检测的样品均为纯芝麻酱,厂家未在标签标示中说明可能存在其他过敏原情况。依据《预包装食品标签通则》(GB 7718),花生为必须标识的致敏物质,无论用作配料还是加工带入均应提示。若属于过敏人群的消费者认为纯芝麻酱中只有芝麻成分而误食,则会造成不可设想的严重后果。目前我国现有的芝麻酱相关标准为国家粮食局发布的《LS/T 3220-2017 芝麻酱》行业标准,其中涉及的主要为感官、微生物及理化检测指标,并无过敏原检测标准。监督执法人员在日常执法工作中会陷入即使厂家有违法违规行为却无法可依、无法惩处的困境。综上,建议相关监管部门加大市场流通环节纯芝麻酱样品标签标识不符情况的查处力度,尽快建立芝麻酱中过敏原检测的相关规范或标准,推动及规范市场更加有序,保障人民饮食安全。

