焦磷酸测序对药品中5种致病菌的快速鉴定方法
李秀珍 刘风琴 王芳 郭树静


[摘要]目的建立焦磷酸测序对药品中5种致病菌的快速鉴定方法。方法通过信息网站及专业设计软件设计引物,扩增后进行电泳与焦磷酸测序,测序结果与Genebank库相应基因序列进行比对。结果5种致病菌测序结果与Genebank库相应基因序列匹配率均在93%以上,均能得到良好的鉴定结果。结论焦磷酸测序方法可以实现对5种致病菌的快速鉴定,大大提高鉴定效率。
[关键词]焦磷酸测序;5种致病菌;通用引物;快速鉴定
[中图分类号]R969;R446.5 [文献标识码]A [文章编号]2095-0616(2022)01-0055-04
Rapid identification of five pathogenic bacteria in drugs by pyrosequencing
LI Xiuzhen LIU Fengqin WANG Fang GUO Shujing
Department of Biological Testing,Dezhou Food and Drug Inspection and Testing Center,Shandong,Dezhou 253000,China
[Abstract]Objective To establish a rapid identification method for five pathogenic bacteria in drugs by pyrosequencing. Methods Primers were designed through information website and professional design software,and then electrophoresis and pyrosequencing were conducted after the amplification of primers. The sequencing results were compared with the corresponding gene sequences in Genebank library. Results The sequencing results of the five pathogenic bacteria matched the corresponding gene sequences of the Genebank library by more than 93%,and all of them could be identified well. Conclusion The method of pyrosequencing can realize the rapid identification of five pathogenic bacteria and greatly improve the identification efficiency.
[Key words]Pyrosequencing;Five pathogenic bacteria;Universal primer;Rapid identification
随着人们对微生物快速鉴定的重视,建立一种快速准确的致病菌鉴定方法成为研究热点[1-2]。传统的鉴定方法主要是表型微生物鉴定法,其操作烦琐,耗时长,受主观因素影响较大[3-5],且可能存在因受损微生物不能完整表达其表型属性,而被正确鉴定分类的情況[6]。焦磷酸测序(pyrosequencing)技术是新一代脱氧核糖核酸(DNA)序列分析技术,克服了传统培养技术的不足,具有敏感快速、操作简便、分析结果更加全面、准确等优势[7-9],可应用于多个领域的病原菌快速检测[10]。目前,应用焦磷酸测序对微生物进行鉴定,大多需要使用不同的引物。对于同一样本,想要排查多种致病菌时,需要多次重复操作,费时费力。通过研究,本研究建立5种常见致病菌(副溶血性弧菌、单核细胞增生李斯特菌、福氏志贺氏菌、阪崎肠杆菌、金黄色葡萄球菌)快速鉴定方法。采用一条通用引物,一次鉴定可同时排查5种致病菌,大大提高鉴定效率。现报道如下。
1 材料与方法
1.1 材料
1.1.1 标准菌株 选取福氏志贺菌ATCC12022、金黄色葡萄球菌ATCC6538、单核细胞增生李斯特菌ATCC19115、副溶血性弧菌ATCC17802、阪崎肠杆菌ATCC29544、沙门氏菌ATCC14028、大肠0157 ATCC35150共7种常见致病菌株,均为德州市食品药品检验检测中心购买标准菌株。菌株复苏后接种于相应的增菌培养基中过夜培养。
1.1.2 主要仪器和试剂 仪器:刀式研磨仪GM200、冷冻高速离心机FRESCO21、核酸蛋白测定仪QIAxpert、基因扩增仪ETC811、QIAxcel Advanced全自动核酸分析系统、实时定量焦磷酸序列分析仪PyroMark Q48 Autoprep。测序软件及版本号为PyroMark Q48 Autoprep 2.4.2。试剂:PowerFood Microbial DNA Isolation kit购于凯杰企业管理(上海)有限公司、PyroMark PCR Kit(200)购于凯杰企业管理(上海)有限公司、PyroMark Q48 advanced CpG Reagents购于凯杰企业管理(上海)有限公司、扩增及测序引物购于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 引物的设计与合成利用基因库数据检索网站美国国家生物信息中心(NCBI)及焦磷酸测序仪配套专业软件,设计测定通用引物,进行致病菌的鉴定。通用引物为:上游引物F:5TCGATGCAACGCGAAGAA 3,下游引物R:5ACATTTCACAACACGAGCTGACGA 3,测序引物S:CGCGAAGAACCTTACC,由生工生物工程(上海)股份有限公司合成。
1.2.2 细菌DNA的提取 取1.8 ml上述各细菌过夜培养物(或样品中分离的各纯菌落过夜培养物)至2 ml收集管中,13 000 r/min离心1 min,弃上清,按照PowerFood Microbial DNA Isolation kit 提取试剂盒操作说明,提取上述各细菌DNA模板备用。
1.2.3 PCR(聚合酶链反应)反应体系及扩增程序PCR反应体系的配制 扩增反应体积为25 μl,分别为:10×CoralLoad Concentrate 2.5 μl,2×PyroMark PCR Master Mix 12.5 μl,引物(5 μmol/L)各1μl,模板DNA(50~200 ng/μl)2 μl,加灭菌去离子水至25 μl;扩增程序:95℃-15 min,94℃-30 s,60℃-30 s,72℃-30 s,45个循环,72℃-10 min,4℃保存。
1.2.4 电泳取PCR产物 利用QIAxcel Advanced 全自动核酸分析系统进行毛细管电泳。
1.2.5 测序 按照焦磷酸测序仪操作规程进行操作,按照(ATCG35个循环)进行喷射,单端测序,根据仪器提示在试剂舱相应位置加入所需产物、底物、酶和A、C、G、T等,按照仪器操作提示进行测序。
2 结果
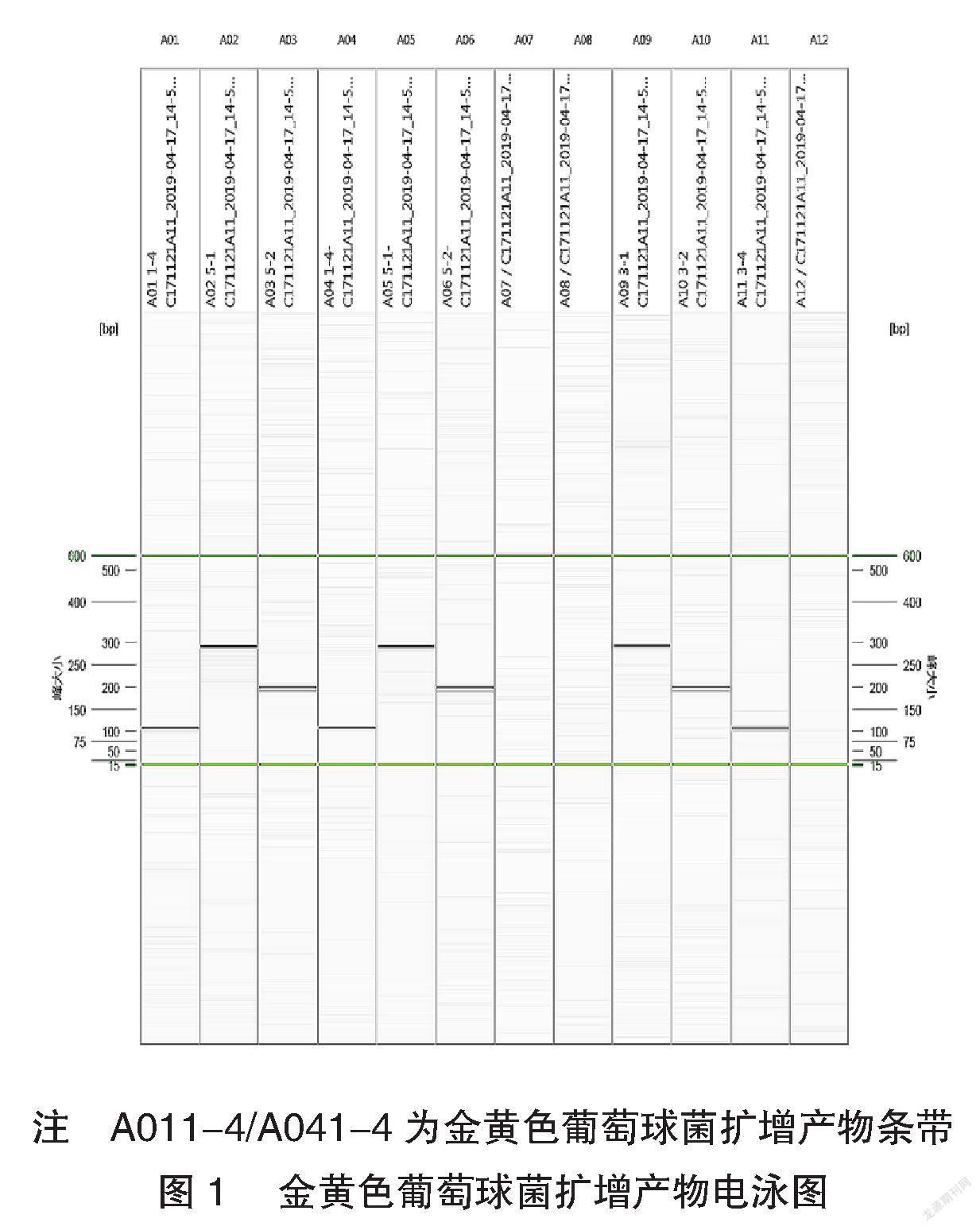
2.1 扩增产物电泳结果
将PCR产物进行毛细管电泳,均能得到100 bp左右的扩增片段条带。见图1~3。
2.2 扩增产物焦磷酸测序结果
将扩增后产物进行焦磷酸测序,测序后其中5种致病菌均能得到良好的测序结果。见图4~8。
2.3 測序比对结果
将上述5种致病菌测序结果与标准序列进行比对,测得序列与标准序列几乎一致,均能得到良好的比对结果。见图9~13。
以上5种致病菌经同一引物进行扩增,扩增后进行测序,测得序列(以上扩增后测序结果,均为原结果,由测序序列去除两端引物区,未进行拼接与剪切,未进行任何修饰与改动)与Genebank库相应基因序列进行比对,匹配率(identities)均在93%以上,均能得到良好的鉴定结果。
3 讨论
3.1 当前研究状况
3.1.1 方法设计 本研究利用微生物特异性与保守型更强的V3、V4、V5、V6区分别进行引物设计,旨在寻求一条通用引物,可以同时对更多菌株进行焦磷酸快速鉴定。本研究使用常见的7种致病菌:副溶血性弧菌、单核细胞增生李斯特菌、福氏志贺菌、阪崎肠杆菌、金黄色葡萄球菌、沙门氏菌、大肠0157进行实验。发现使用V6区设计的引物(见1.2.1),对其中5种菌(副溶血性弧菌、单核细胞增生李斯特菌、福氏志贺菌、阪崎肠杆菌、金黄色葡萄球菌)扩增后均可以进行测序区分,省时省力。本研究以V6区设计的引物作为通用引物,建立焦磷酸测序对5种致病菌的快速鉴定方法。
3.1.2 方法证实 为进一步验证方法的可靠性,本研究用上述5种标准菌株及实验室样品中分离的5种阳性菌株进行多次测定,测定结果与传统培养法、全自动微生物鉴定仪鉴定结果进行比对,鉴定结果均一致。
3.2 同类研究比较
焦磷酸测序作为新一代DNA测序技术,在突变基因[11-13]、DNA甲基化[14-15]等方面已有大量研究报道。在致病菌的快速检测方面,曹冬梅等[16]建立了快速鉴定食品中肠炎沙门菌的PCR—焦磷酸测序法,张丽娜等[10]建立了快速检测3种海洋性弧菌的焦磷酸测序方法。对致病菌的快速鉴定,多采用不同引物,对不同致病菌鉴定,操作烦琐。本研究建立的焦磷酸测序对5种致病菌的快速鉴定方法,仅采用一条通用引物,即可同时满足对5种致病菌的快速鉴定,操作更方便,鉴定时间更短,可大大提高鉴定效率。
3.3 不足之处及今后探索的方向
因本研究实验室菌株有限,该方法仅验证了7种致病菌,测序后其中5种致病菌均能得到良好的测序结果。未能实现对更多致病菌的鉴定研究。今后将继续探索研究,希望能够建立焦磷酸测序对更多致病菌的通用鉴定方法,为实验室快速鉴定致病菌提供更多的参考。
[参考文献]
[1]宁雅婷,杨启文,陈新飞,等.临床微生物快速检测新技术发展现状与前景[J].协和医学杂志,2021,12(4):427-432.
[2]姚帮本,闫超,姚丽,等.食源性致病菌快速检测方法研究进展[J].分析测试学报,2021,40 (5):617-627.
[3]高雯暄,甘芝霖,陈爱亮,等.核酸技术在食源性致病菌检测中的研究进展[J].食品安全质量检测学报,2020,11(24):9440-9450.
[4]钟丽琪,郭亚辉,曹进,等.食源性致病菌检测技术的研究概述[J].食品安全质量检测学报,2020,11(13):4387-4393.
[5]尤明亮.分子诊断技术在病原微生物检测中的应用进展[J].医学理论与实践,2020,33(19):3150,3167-3168.
[6]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020:503-505.
[7]徐石勇,赵新,张富丽,等.基于焦磷酸测序分析技术的金银花掺伪鉴别方法研究[J].生物技术进展,2020,10(6):637-645.
[8]李葱葱,高越,沈晓玲,等.基于焦磷酸测序技术的基因编辑位点检测方法的建立[J].中国农业大学学报,2019,24(9):10-16.
[9]解美霞,王燕,赵新,等.基于焦磷酸测序技术建立基因编辑水稻检测方法[J].生物技术进展,2020,10(6):668-673.
[10]张丽娜,郑妍,胡成进,等.焦磷酸测序快速检测3种海洋性弧菌的方法学建立及创伤弧菌16S rRNA 基因分型的研究[J].臨床检验杂志,2017,5(7):481-485.
[11]Wei Rongbin,Fei Zhongjie,Liu Yanrong,et al.A digital coding combination analysis for mutational genotyping using pyrosequencing[J].Electrophoresis,2021,42(11):1262-1269.
[12]赵焕英,方宵,李慎涛,等.免疫组化和直接测序以及焦磷酸测序对IDH1突变的比较研究[J].实验技术与管理,2019,36(10):73-76.
[13]邱然,陆健.T-RFLP和454焦磷酸测序方法分析制麦过程细菌群落的动态变化[J].食品与生物技术学报,2019,38(7):71-77.
[14]王玲,彭付端,赵慧,等.焦磷酸测序和MassARRAY定量检测DNA甲基化在年龄推断中的差异[J].南方医科大学学报,2020,40(12):1831-1837.
[15]Zhang J,Fu H,Xu Y.Age Prediction of Human Based on DNA Methylation by Blood Tissues[J].Genes,2021,12(6):870.
[16]曹冬梅,倪长鹏,刘宇,等.PCR—焦磷酸测序法快速鉴定食品中肠炎沙门菌[J].大连工业大学学报,2015,34(1):29-33.

