吲哚菁绿造影在穿支皮瓣术后血管危象监测中的实验研究
完颜超杰 吴中明 张峰瑞 李欢 杨子桧 王珺 韩雪娇 杨向明 雷德林 杨新杰 魏建华
游离皮瓣移植是创面缺损修复的重要手段,在口腔颌面外科应用日益广泛。近年来,穿支皮瓣因其设计灵活,微创美观,最大程度恢复功能等优点,显著提高了缺损修复的治疗效果[1]。随着显微外科发展,皮瓣移植成功率已高达95%,但血管危象发生率仍接近10%~30%[2]。血管危象是游离皮瓣失败的主要原因,如在8~12 h内不能及时发现和抢救,皮瓣将出现不可逆坏死[3]。穿支皮瓣血管比常规主力皮瓣血管口径更为细小,术后更易发生动静脉危象[4]。早期皮瓣危象的抢救成功率很高,因此有效监测及早发现和诊断血管危象尤为重要[4]。目前临床上主要通过观察皮瓣颜色、温度、毛细血管充盈试验、针刺试验等方法诊断血管危象,但缺乏客观统一标准,对观察者有较高要求[5]。因此亟需一种客观、即时、无创而简便实用的方法进行术后监测[6]。吲哚菁绿造影(indocyanine green angiography,ICGA)不仅能在术中评估皮瓣血流灌注情况,而且术后有助于发现动静脉危象[7]。本研究拟构建大鼠髂腰穿支皮瓣危象模型,探讨ICGA识别皮瓣术后血管危象的规律,为临床皮瓣监测提供指导。
1 材料与方法
1.1 实验动物
成年健康雄性SD大鼠(第四军医大学动物实验中心)42只,体重(300±10)g。实验操作符合第四军医大学动物实验伦理要求。
1.2 主要试剂与设备
注射用吲哚菁绿(indocyanine green,ICG)(25 mg/支,丹东医创药业有限责任公司);手术荧光影像系统Real-IGSFLI-10B系列(南京诺源医疗器械有限公司);SXF-IC手术显微镜(上海医光仪器有限公司)。
1.3 实验方法
1.3.1 髂腰穿支皮瓣制备 SD大鼠由1%戊巴比妥钠(0.4 mL/100 g)经腹腔注射麻醉,右侧背部脱毛,俯卧位,固定于手术台。将FLI-10B的探头移动对焦至髂腰穿支区,股静脉给予0.05 mL浓度为2.5mg/mL ICG溶液,注射的同时开始FLI-10B探测并录像。显影过程中,将显影最早、最亮、搏动最强的点定义为动脉穿支血管所在的位置。标记出髂腰穿支点,设计大小为5 cm×4 cm的髂腰穿支皮瓣。待ICG代谢消失荧光强度恢复基线水平后,自皮瓣远端全层切开至浅筋膜,自浅筋膜深面向皮瓣近端剥离,显露并剥离髂腰血管。离断周围所有组织,仅保留髂腰穿支血管(图1)。
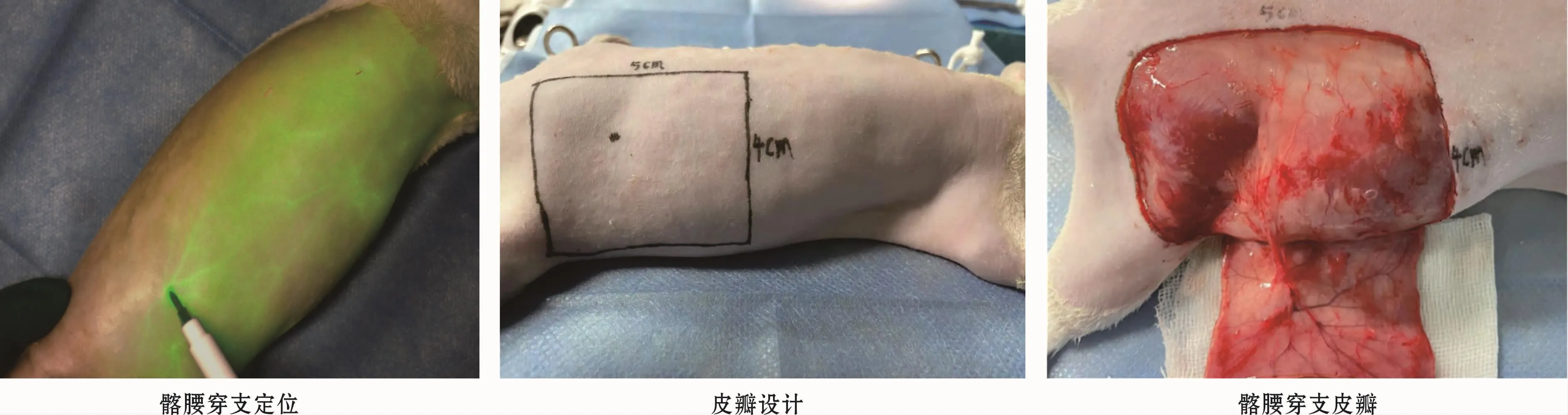
图1 髂腰穿支皮瓣的制备Fig 1 Preparation of iliolumbar perforator flap
1.3.2 血管危象模型建立与分组 前期实验表明动脉危象时长不同,ICGA图像表现一致;静脉危象时长不同,ICGA图像表现各不相同;静脉危象超过4 h,皮瓣荧光显像不再变化。根据预实验结果将实验分为以下7组。对照组:保髂腰穿支血管,不作任何处理;动脉危象组(危象时长15 min):8倍显微镜下分离髂腰动静脉,结扎髂腰动脉,保留静脉通畅;静脉危象组:结扎髂腰静脉,保留动脉通畅;根据危象时长分为5组,依次为15min,0.5、1、2、4 h(n=6)。将皮瓣原位间断缝合,动态观测皮瓣变化。
1.3.3 皮瓣大体观察和术后ICGA检测 血管危象模型建立成功后,记录各组皮瓣大体变化。再次行ICGA,注射后在第30、60、90、180、300 s抓拍图像并定量分析荧光信号。以髂腰穿支点为中心选取1 cm×1 cm的感兴趣区域(regions of interest,ROI),在周围组织选取等大的ROI,Image J软件计算出ROI的平均荧光强度值(mean fluorescence intensity,MFI),分别代表皮瓣和周围组织的血流灌注量;线图分析每组皮瓣和周围组织MFI随时间的动态变化;SPSS软件计算注射后30 s皮瓣的相对灌注值(relative perfusion value,RPV),RPV=MFI(皮瓣 ROI)/MFI(周围组织 ROI)。
1.4 统计学分析
2 结 果
2.1 皮瓣大体观察
对照组皮瓣颜色红润,组织弹性及张力适中,毛细血管充盈正常,和周围组织一致;动脉危象组皮瓣苍白灰暗,皮温降低,皮瓣张力减低,毛细血管反应稍迟钝;静脉危象组在0~1 h,皮瓣颜色逐渐加深,皮温降低,皮瓣肿胀,毛细血管反应稍加快;静脉危象1~2 h,皮瓣表面逐渐出现散在的瘀点;静脉危象4 h组斑点逐渐融合成片状青紫瘀斑,直至皮瓣变黑坏死(图2)。
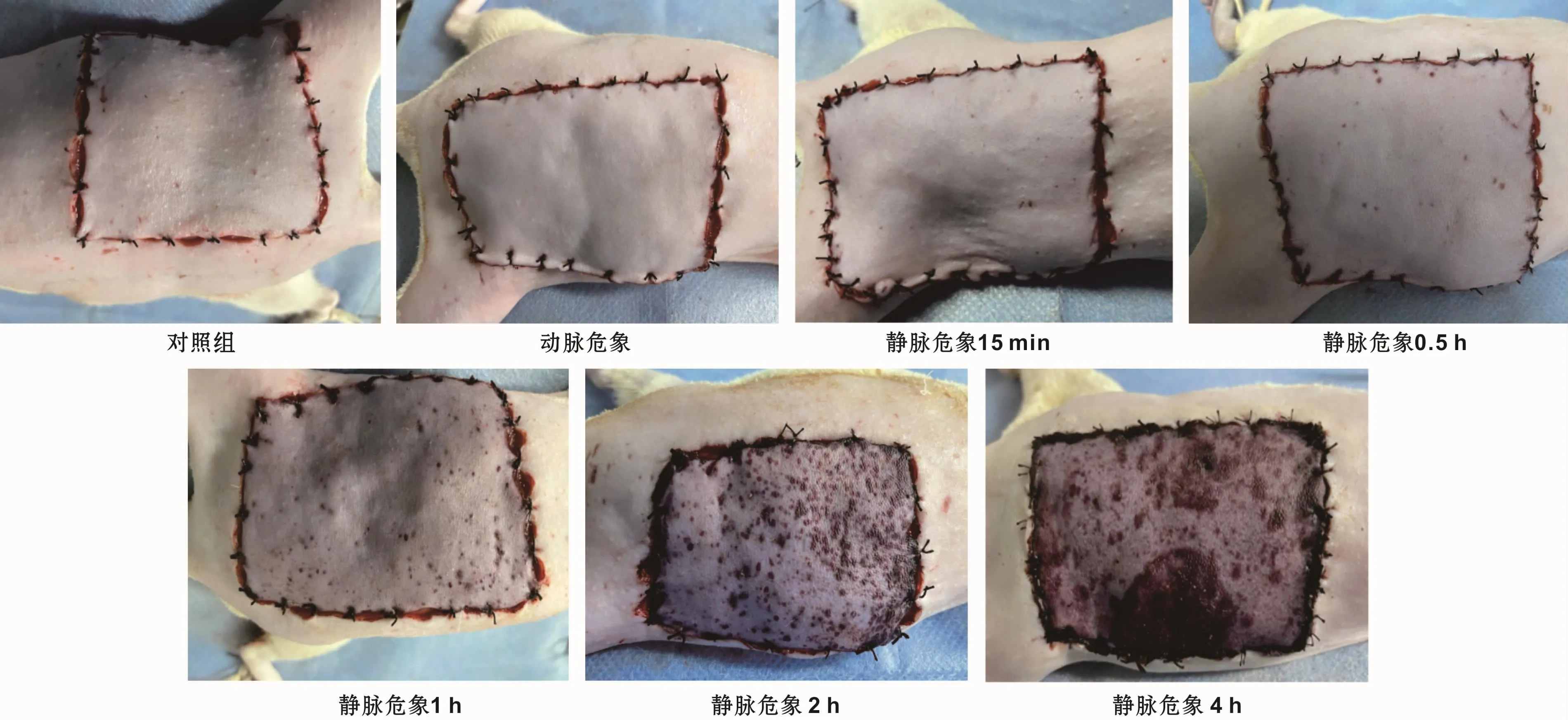
图2 皮瓣大体观察Fig 2 Gross observation of the skin flaps
2.2 ICGA检测结果
静脉注射ICG后,在30 s时各组周围组织MFI达到最大,为(193.4±17.8)AU,之后逐渐变小。在 30~300 s,荧光衰减较为迅速,300 s时 MFI为(62.9±11.0)AU;300 s后荧光衰减缓慢。约15 min时,ICG代谢消失,周围组织MFI恢复至术前基线水平,为(36.1±6.2)AU。
对照组在注射后5~8 s后,皮瓣内髂腰动脉开始显影,可以清晰观察到动脉期、毛细血管期、静脉期。动脉期时间非常短暂,约2~3 s,血管纤细,呈 “树枝状”影,供应皮瓣中央区域;之后迅速经过毛细血管交换进入静脉期,静脉期维持时间较长,静脉血管稍粗大(图3)。皮瓣和周围组织MFI在30 s达到峰值后逐渐变小,并且在不同时间点基本保持同步变化(图5)。

图3 对照组血液灌注分期Fig 3 Blood perfusion staging of the control group
动脉危象组皮瓣无灌注分期,在观察期各时间点均呈现“暗区”,MFI为(34.9±5.8)AU,与基线水平无明显差异(P>0.05);在注射后 30 s时,RPV为(18.1%±1.2%),与静脉危象 2、4 h组无统计学差异(P>0.05)(图 4~6)。
静脉危象各组无灌注分期,皮瓣和周围组织MFI变化不同步。静脉危象15 min皮瓣MFI在30~300 s
始终大于周围组织,而危象0.5、1、2 h组皮瓣MFI在观察初期小于周围组织,继而大于周围组织;静脉危象2 h皮瓣内荧光“混沌”,血管形态难以辨认。静脉危象4 h组皮瓣始终呈现“暗区”,MFI在各时间点始终处于基线水平。在注射后30 s时,静脉危象15 min组皮瓣 RPV为(112.8%±3.8%),大于对照组RPV(95.9%±1.0%);随着静脉危象程度加深,皮瓣RPV逐渐变小,均小于对照组(P<0.05)(图 4~6)。
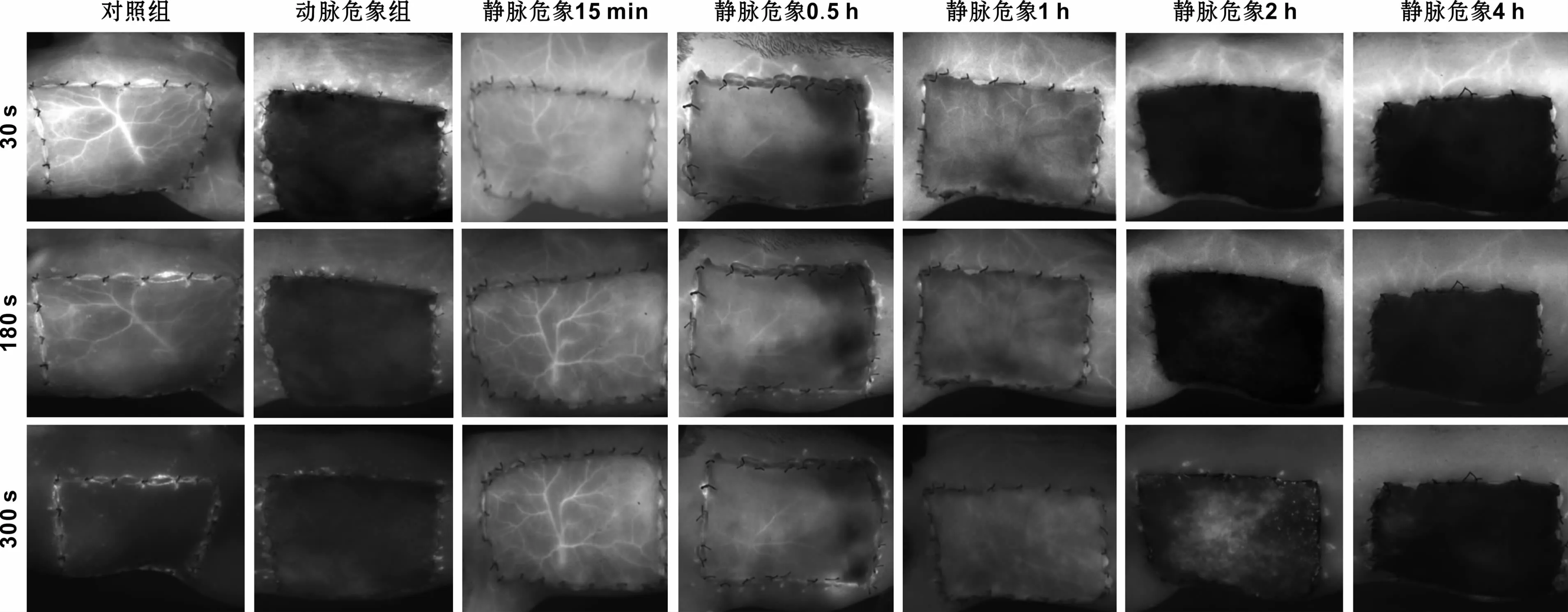
图4 各组皮瓣荧光动态变化Fig 4 Dynamic changes of fluorescence in the flaps of the groups

图5 皮瓣和周围组织平均荧光强度定量分析Fig 5 Quantitative analysis of MFI of the flaps and surrounding tissues
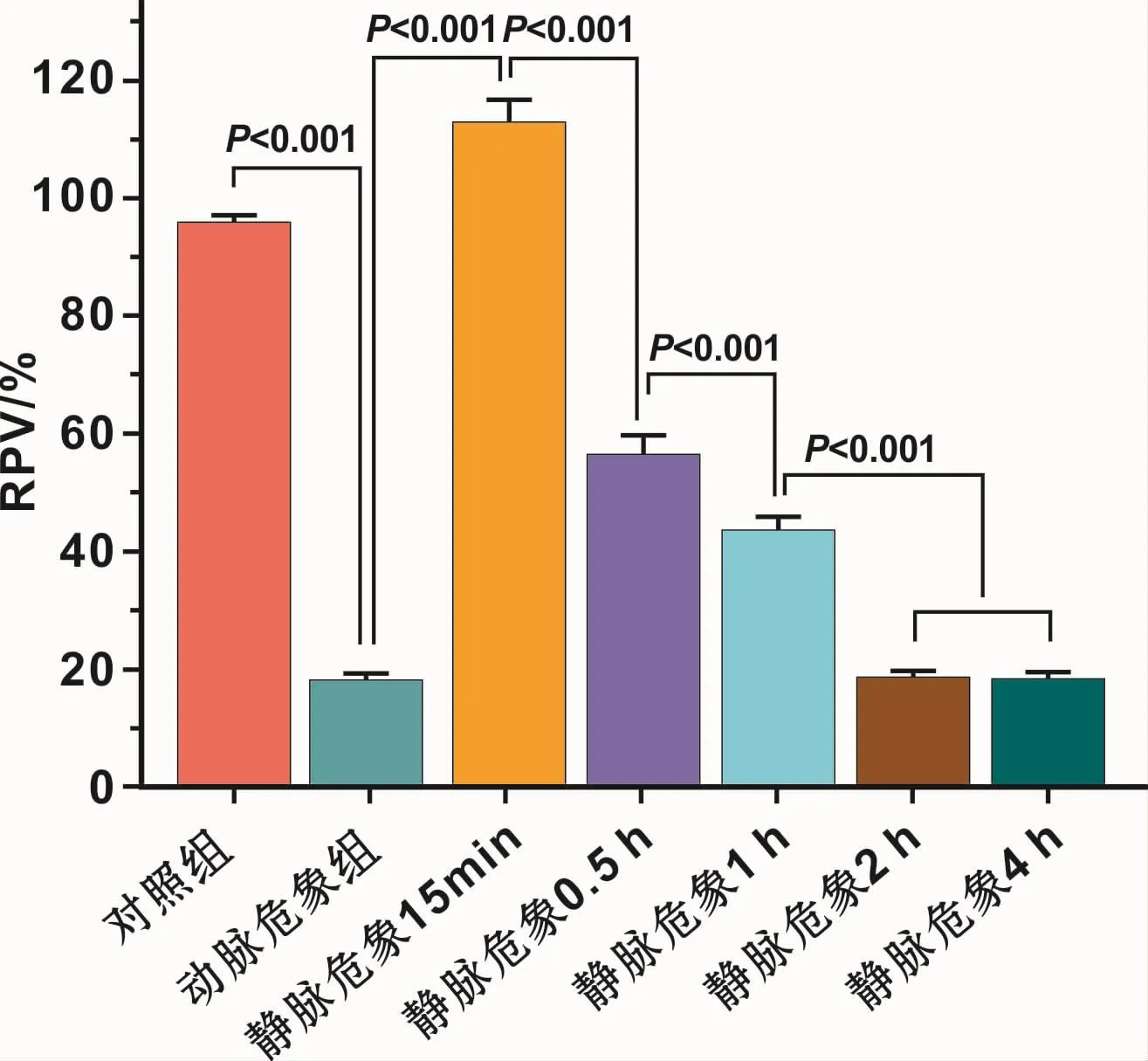
图6 注射ICG 30 s时皮瓣相对灌注分析Fig 6 Relative perfusion analysis of flaps at 30 s after injection of ICG
3 讨 论
游离皮瓣已成为口腔颌面部组织缺损修复重建的主要手段。虽然游离皮瓣移植成功率已达95%以上,但发生皮瓣坏死仍是灾难性事件[8]。血管危象作为皮瓣术后最常见的并发症,其可能导致二次手术、皮瓣坏死等后果,不仅增加患者身心痛苦及延长住院时间,延误后期放疗,甚至危及生命[9]。皮瓣手术成功不仅取决于显微外科吻合技术,还与术后监测密切相关。早期发现皮瓣危象与皮瓣挽救成功率直接相关[10-11]。术后24~48 h内是监测关键时期,血管危象多发生于此期间,且此类患者的皮瓣挽救成功率高于危象48 h后的患者。有研究报道,出现血运障碍后6 h内,皮瓣挽救成功率较高;随时间延长,血管内膜受损,组织瓣微循环将发生不可逆改变,超过6 h血管危象挽救成功率低至14.3%。马小睦等[12]回顾分析指出大部分血管危象可在发现后3 h内经手术探查解除。因此,早期识别并准确处理血管危象,是进一步提高游离皮瓣移植成功率的关键。目前皮瓣术后血运监测主要有临床监测法、激光多普勒血流仪、近红外光谱仪、植入式多普勒超声、组织氧分压测定和微量渗析等方法[13]。临床观察法简单易行,但有赖于医师个人经验。目前尚没有一种方法能达到理想的评估标准:实时、准确、无创、可定量、反应快捷,简单方便[2]。以ICG为示踪剂的近红外荧光成像系统接近满足这些标准[14]。对于发生过皮瓣危象探查术后的皮瓣,尤其是静脉危象探查术后的皮瓣,其因淤血原因往往颜色较深,临床评估往往不可靠,而ICGA评估血运不受组织形态色泽等因素干扰。ICG静脉注射后,快速与血红蛋白结合,被限制在血管内而无法短时间渗入组织间隙,被激发后发出波长700~900 nm荧光,具有更好的组织穿透性,在可见光下比其他染料更清晰显示血液循环情况,通过测定研究区域荧光强度客观准确反映组织灌注量。本文的实验方法也适用于手术探查后的皮瓣监测。本实验首次将FLI-10B用于穿支皮瓣血管危象监测的动物研究。以往研究多集中在ICGA结合动态指标如动脉流入指数、静脉回流指数、荧光达峰时间等参数监测术后游离皮瓣[12]。Hitier等[13]研究发现,ICGA比临床观察法更早发现皮瓣术后微循环障碍(皮瓣危象患者荧光曲线斜率和振幅异常),证实其在预测血管危象的可行性和安全性。ICGA结合FLOW 800分析系统[14]、针刺实验[15]可提高其检测血管病变的灵敏度和特异度,在预测皮瓣坏死有着潜在价值。但运用动态指标需多次注射,无法持续监测血流灌注情况。并且不是所有堵塞类型都能被检测出来[12]。Mucke等[16]研究发现 ICGA仅可检测到堵塞程度≥85%的静脉回流不畅,≤75%时无显著性差异。总体来说,动态指标还不够灵敏,并且在不同患者和不同皮瓣间无统一标准。
本实验对测量指标加以改进,使用静态指标如平均荧光强度和相对灌注值在不同时间点比较皮瓣和周围组织荧光强度随时间的变化,更能体现自身对照原则。并且单次注射,避免多次注射残留造影剂对实验造成影响。本研究结果表明,根据定性或定量指标并结合其他监测手段可推断血管危象的类型和大致时间(图7)。对照组皮瓣灌注有明显灌注分期,并且皮瓣MFI变化与周围组织保持同步变化,30 s时RPV接近100%,说明正常皮瓣血液灌注量和周围组织相当,皮瓣内微循环正常。若皮瓣MFI在观察期始终处于基线水平,并且30 s RPV较小(20%左右)则是动脉发生堵塞或者是静脉危象时间过长导致皮瓣不可逆改变,血供中断致造影剂无法流经皮瓣。动脉危象一般发生在术后24 h内,比静脉危象发生时间早,而动脉危象表现不典型多无颜色改变,行ICGA有助于及早检出动脉危象。若图像显示皮瓣在观察期有荧光亮区,且MFI不下降则提示静脉危象,静脉回流不畅所致;静脉危象发生率远高于动脉危象,静脉危象常常是术后皮瓣坏死的主要原因[17]。通过前期预实验,当大鼠髂腰穿支静脉阻断4 h,所有皮瓣大体观均已发黑坏死,当阻塞解除后,血液无复流,皮瓣无好转,已发生不可逆坏死。静脉危象超过4 h,皮瓣已无抢救成功的可能性。并且临床上大部分静脉危象主要静脉引流不畅逐渐形成,很少出现完全阻塞情况,可能造成此实验大鼠皮瓣静脉危象抢救窗口期时间较短。所以认为静脉阻断4 h是关键时间节点,对大鼠皮瓣影响较大,大部分皮瓣无法生存。在0~4 h内,通过设置不同的阻断时长,表示不同的静脉危象程度。当静脉危象程度较浅(15min)时,动脉流入正常,30 s RPV高于100%,ICG流入该区域无法及时通过静脉排空,皮瓣内ICG代谢减缓,荧光强度高于周围组织。随着程度加深,皮瓣荧光峰值比周围组织低并且峰值变钝,30 s RPV逐渐减小,提示静脉回流障碍使毛细血管床阻力增加,动脉压增大,血液灌注减少所致,皮瓣内荧光强度低于周围组织。当皮瓣静脉危象至终末阶段(2~4 h),静脉危象时间过长导致皮瓣动脉不可逆损伤,皮瓣整体发生缺血,30 s RPV表现和动脉危象组一致,此时皮瓣荧光图像“混沌”,无法显示血管形态,血管通透性增大,ICG渗透到组织间隙混淆了血管亮度。
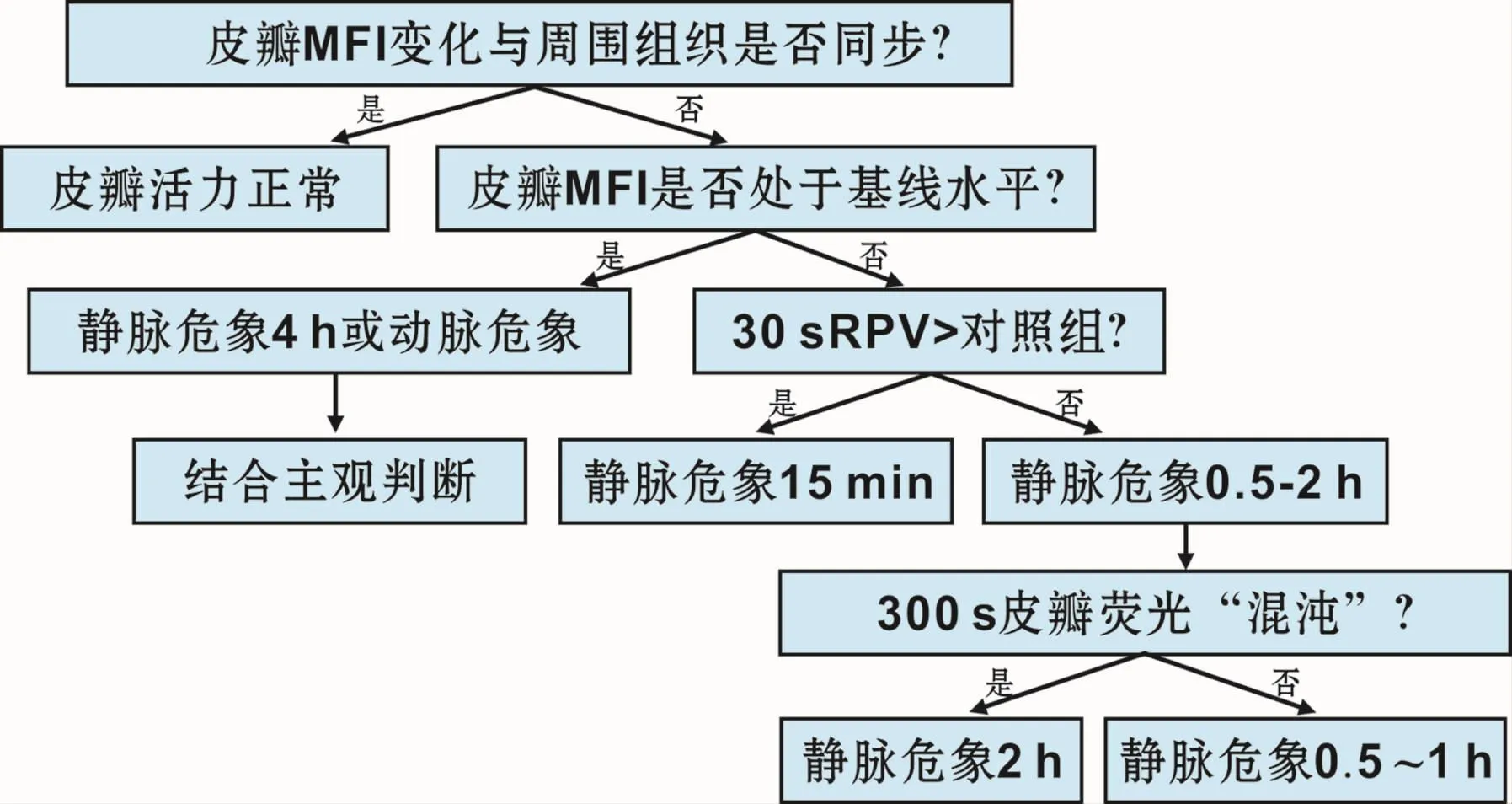
图7 血管危象荧光显像判定决策图Fig 7 Suggested algorithm for decision making assisted by ICGA in regard to vascular crisis
本研究为动物实验,存在一定的局限性。此研究采用结扎血管的方式模拟血管危象,但临床上栓塞多逐渐形成,很少出现短时间完全堵塞的情况,大多为吻合质量不佳、组织或者积液压迫、血管扭曲弯折等问题。如何更好的模拟临床情况,还需要对模型进一步改善。目前本实验是选取代表性时间点观察,如何持续动态监测,第一时间发现血管危象还需进一步研究。大鼠与人的皮瓣生理不同,下一步本课题研究将在体借助Real-IGSFLI-10B研究ICGA在术后穿支皮瓣监测中的可行性,在临床上给予验证。
4 结 论
此实验可表明ICGA可用于穿支皮瓣术后血运监测,根据荧光显像模式和动态定量分析可鉴别血管危象类型和判断危象发生时间,从而及时采取挽救措施,提高皮瓣挽救成功率。

