高血压脑出血不同手术方式对血清MMP-9、TNF-α表达的影响
许真,穆振欣,吴桂美,孙国庆,陈祥涛,孟令新,时峰,崔维刚,杨允学
高血压脑出血(hypertensive intracerebral hemorrhage,HICH)是神经外科常见疾病之一,致残率高,61%~88%的患者有重度残疾,而急性期病死率高达30%~40%[1]。相关研究发现,ICH发病后血肿周围水肿(perihematoma edema,PHE)是患者神经功能恢复及预后的主要影响因素之一[2]。目前对PHE的病理及生理变化研究正在不断深入,多项研究证实基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症因子在PHE发生发展过程中起到了极其重要的作用[3],而HICH患者不同手术方式对术后的炎症反应有着不同的影响,对继发性脑损伤、PHE程度也有不同的影响,并最终影响患者术后的神经功能恢复及预后。本研究回顾性分析2018年1月—2019年12月日照市人民医院神经外科及日照市中心医院神经外科收治的166例HICH患者的临床资料,通过对比锁孔内镜及开颅血肿清除两种不同手术方式术后血清MMP-9、TNF-α水平及PHE的动态变化,来探讨不同手术方式对术后MMP-9、TNF-α水平变化与PHE的影响。现报告如下。
1 资料与方法
1.1 一般资料 共纳入166例HICH患者,入院后通过采用随机数字表的方法,以及随机数余数分组法,分为两组:一组锁孔内镜组,一组大骨瓣开颅组,均发病24 h以内接受手术治疗。锁孔内镜组83例,其中男47例,女36例;年龄37~76岁,平均(48.3±5.2)岁;术前血肿量为(42.2±5.1)mL,GCS评分为(7.8±1.8)分。大骨瓣开颅组83例,其中男44例,女39例;年龄38~77岁,平均(47.9±6.2)岁;术前血肿量为(43.8±5.1)mL,GCS评分为(7.6±2.1)分。入组标准:幕上血肿且量大于30 mL HICH患者,排除颅内动脉瘤、颅内动静脉畸形、血液系统疾病或肿瘤等其他原因导致的出血,排除脑疝患者,排除有心脏、肺脏、肝脏及肾脏等基础疾病患者。另选同期健康体检者30例作为对照组,其中男16例,女14例;年龄39~75岁,平均(49.36±5.14)岁。对三组患者术前的一般情况进行比较,两组间差异无统计学意义(P>0.05),具有可比性。
1.2 手术方法
1.2.1 锁孔内镜组 锁孔定位,铣刀开颅,骨瓣2~2.5 cm,脑穿针穿刺后,专用鞘置入血肿腔,形成柱状工作通道,在内镜引导下应用吸引器清除血肿,双极电凝止血。清除血肿时采用一人双手操作,术者左手内镜,右手吸引器吸除血肿;电凝止血时采用二人三手操作,助手持镜,术者左手吸引器,右手双极电凝止血。缝合硬脑膜,连接片固定骨瓣。
1.2.2 大骨瓣开颅组 基底节区脑出血采用扩大翼点入路,骨窗大小约(7~8)cm×(9~12)cm,显微镜下分离外侧裂,岛叶皮质造瘘,进入血肿腔,脑压板牵拉清除血肿,双极电凝止血。枕叶、额叶等脑叶表面出血,根据血肿定位的马蹄形或冠状切口,皮质造瘘达血肿腔,脑压板牵拉清除血肿,关颅时缝合硬膜或行减张修补,根据患者情况决定是否行去骨瓣减压术。
1.3 术后脑水肿观察 两组手术患者术后1 d、3 d、7 d、14 d时复查CT横断位扫描,选择水肿的最大层面测量水肿的最大径(D)。水肿程度分级:0级无水肿D=0;1级水肿,D<2 cm;2级水肿2 cm≤D≤4 cm;3级水肿D>4 cm。水肿程度评分,0~1级者为轻度水肿,2~3级者为重度水肿。计算二组患者术后1 d、3 d、7 d、14 d 的重度水肿率。
1.4 炎性因子MMP-9、TNF-α水平检测 两组手术患者入院时、术后1、3、7、14 d时,对照组体检时抽取静脉血3 mL,以3 000 r/min离心处理10 min,取上层清液置于冷藏室内待检,应用全自动蛋白测定仪(美国Beckman Array 360)采用酶联免疫吸附法检测MMP-9、TNF-α水平。

2 结 果
2.1 术后脑水肿情况 两组手术组患者重度水肿率均在术后逐渐增加,在术后3 d达到高峰,后逐渐下降。二组间相比较,锁孔内镜组在术后第1 d、3 d、7 d、14 d 重度水肿率分别为9.6%、15.7%、7.2%、0%,明显低于大骨瓣开颅组术后第1 d、3 d、7 d、14 d 的31.3%、42.2%、26.5%、9.6%重度水肿率,二组之间有显著差异P<0.05(表1)。

表1 两组术后不同时间重度水肿率比较
2.2 术后MMP-9表达 术前两手术组血清MMP-9质量浓度与对照组相比明显升高(P<0.05),但二组间无明显差异,无统计学意义(P>0.05)。两组患者MMP-9表达均在术后逐渐增加,在术后3 d达到高峰,后逐渐下降,大骨瓣开颅组14 d时仍维持一个较高水平。两组相比较,锁孔内镜组在术后第1 d、3 d、7 d、14 d 的MMP-9分别为(182.32±12.67)μg/mL、(294.32±16.25)μg/mL、(164.32±11.56)μg/mL、(96.65±9.57)μg/mL,明显低于大骨瓣开颅组术后第1 d、3 d、7 d、14 d 的(315.24±18.56)μg/mL、(412.59±15.42)μg/mL、(289.26±14.45)μg/mL、(135.56±11.85)μg/mL的MMP-9表达,两组之间有显著差异P<0.05(表2)。

表2 3组受试者血清MMP-9水平比较
2.3 术后TNF-α表达 术前两手术组血清MMP-9质量浓度与对照组相比明显升高(P<0.05),但两组间无明显差异,无统计学意义(P>0.05)。两组患者TNF-α表达均在术后逐渐增加,在术后3 d达到高峰,后逐渐下降,大骨瓣开颅组14 d时仍维持一个较高水平。两组相比较,锁孔内镜组在术后第1 d、3 d、7 d、14 d MMP-9分别为(2.54±0.49)ng/mL、(2.84±0.52)ng/mL、(1.87±0.32)ng/mL、(1.32±0.26)ng/mL,明显低于大骨瓣开颅组术后第1 d、3 d、7 d、14 d (4.86±0.54)ng/mL、(5.45±0.65)ng/mL、(4.34±0.57)ng/mL、(2.45±0.32)ng/mL的TNF-α表达,两组之间有显著差异(P<0.05)。见表3。
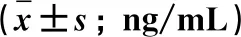
表3 3组受试者血清 TNF-α水平比较
3 讨 论
HICH具有高发病率、高病死率、高致残率的特点[5-8],常见原因是出血对神经功能区及神经传导束的损伤[9],而PHE也是常见原因之一。PHE是指脑出血血肿增大后压迫周围脑组织,在血肿与周围脑组织中形成压力差,使脑组织移位(图1A),使周围血管循环受阻,引发血管自身调节障碍,脑组织缺血、缺氧,从而导致脑内血肿周围水分增加进而促使脑容积增大的一种病理现象,可以引起颅内压的急剧升高,严重者压迫脑干导致脑疝的发生,危及患者的生命[10-11]。
目前PHE的发生及发展基础机制仍未完全阐明,但研究表明[12],在PHE的发生、发展过程中,炎症介质可能起了极其重要的作用。脑出血后脑血肿占位效应能够迅速引发炎症细胞表达浸润,导致VEGF、 MMP-9、TNF-α等炎症因子及氧自由基大量释放,血管内皮细胞受损,引发细胞毒性脑水肿[13],而缺血缺氧及血肿分解产物毒性反应引起继发性血脑屏障破坏,导致血管通透性增加,最终引发血管源性脑水肿的发生[14]。脑出血后血肿附近组织内MMP-9、MMP-2表达水平明显上升,能够水解胶原纤维、层粘连蛋白,直接破坏细胞间连接及细胞外基质分子,引起血脑屏障通透性增加,促进血管源性脑水肿的形成[15]。TNF-α可促使T细胞产生多种炎症因子,引发炎性反应等多效级联反应,同时引起神经细胞的凋亡、血脑屏障的破坏、局部脑血流下降及炎症反应等继发性脑损伤,导致混和性脑水肿的发生。研究表明各种炎性因子的表达与脑出血预后有明显相关性,血清中细胞炎性因子水平变化可能有助于提示患者病情[16]。而脑出血不同治疗方式,患者脑出血手术过程及术后病理生理均出现不同程度的变化,这也会引起不同炎性因子的变化方式,直接影响到 PHE的发生、发展及不同的程度变化。
锁孔内镜技术能够快速开颅,在最短时间高效率地清除脑内血肿,解除血肿压迫,使神经损伤降到最低[17-19]。小骨孔最大程度减少了脑组织的暴露,柱状内镜通道向周围脑组织均匀传递压力,形成多方向支撑,对脑组织没有明显牵拉,利用持续较高并缓慢下降的“脑-血肿”压力差[4],使血肿自动涌向内镜通道(图1B),血肿易于清除,内镜的多角度观察,也更易于高效率的清除血肿,所以对脑组织破坏轻微,术后就不会产生严重的脑水肿,术后患者的神经功能恢复良好。本组术后患者的脑水肿情况明显较开颅组轻,术后重度水肿率明显低于大骨瓣开颅组,锁孔内镜组在术后第1 d、3 d、7 d、14 d MMP-9、TNF-α等炎症因子表达明显低于开颅组术后第1 d、3 d、7 d、14 d 表达,两组之间有显著差异(P<0.05)。锁孔内镜的手术方式能够在最短时间高效率地清除脑内血肿,对脑组织破坏少,解除血肿占位效应,并清除血肿后防止了血红蛋白等物质吸收引起的毒性作用,能够明显减少MMP-9、TNF-α等炎症因子的释放,充分表明锁孔内镜手术方式可以明显降低术后MMP-9、TNF-α等炎症因子表达,打断了PHE的发生发展进程,更有利于HICH患者术后神经功能的恢复。
大骨瓣开颅后,脑组织首先向颅外膨隆,形成较小的“脑-血肿”压力差,使脑组织向回移位压力小,血肿不容易回缩,不易清除(图1C),只能通过脑压板牵拉脑组织,来显露血肿进行清除,导致手术时间长,血肿清除率相对低,术中出血多、往往需要输血治疗,并且脑压板过度的牵拉容易造成脑组织损伤,引起术后重度脑水肿,导致术后神经功能恢复差[20-21]。本组患者术后脑水肿情况明显较锁孔内镜组重,术后重度水肿率明显高于锁孔内镜组,大骨瓣开颅组在术后第1 d、3 d、7 d、14 d MMP-9、TNF-α等炎症因子表达明显高于锁孔内镜组术后第1 d、3 d、7 d、14 d 表达,两组之间有显著差异(P<0.05)。开颅手术方式虽然解除血肿占位效应,减少了血红蛋白等物质吸收引起的毒性作用,能够降低MMP-9、TNF-α等炎症因子的释放,但由于清除脑内血肿时间相对较长,广泛牵拉对脑组织破坏较重,术后细胞毒性脑水肿及血管源性脑水肿仍然存在,术后MMP-9、TNF-α等炎症因子表达会长时间维持一个相对较高水平,充分表明开颅手术方式可以降低术后MMP-9、TNF-α等炎症因子表达,但相对锁孔内镜组下降程度较小,PHE的缓解程度较慢,术后仍有长时间的脑水肿有较高重度水肿率,不利于HICH患者术后神经功能的恢复。
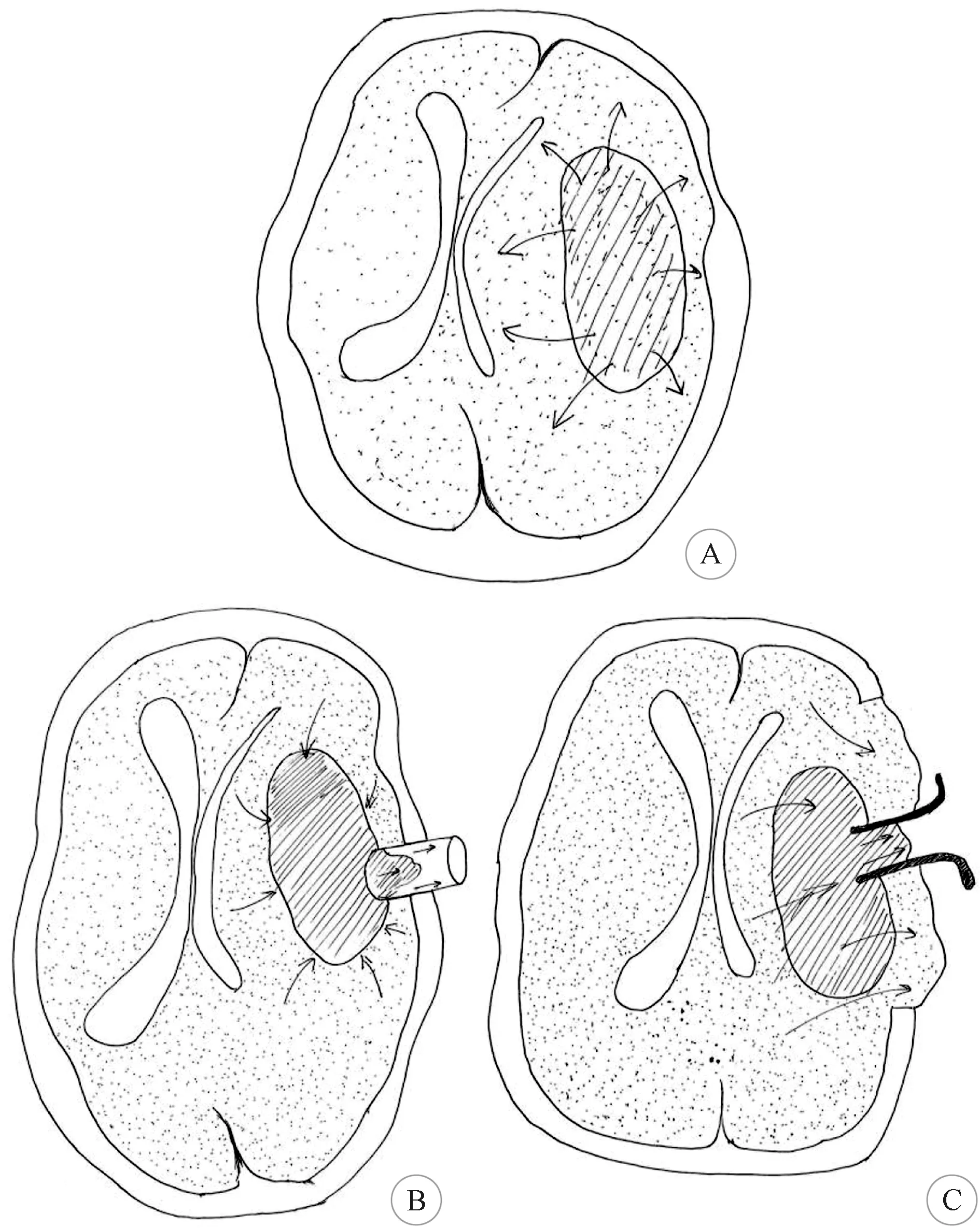
A:脑出血后血肿占位效应使血肿压高于脑组织压,使周围脑组织移位,最终血肿压与脑组织压达到平衡后,移位停止; B:内镜辅助下锁孔入路血肿清除手术时,内镜工作通道处血肿相对于其它部位血肿以及周围脑组织相对负压状态,形成“脑组织-血肿-内镜通道”压力梯度差,使脑组织的进一步回缩,促使血肿向内镜工作通道内涌入,不需要特殊显露就可以在吸引等综合作用下清除血肿; C:大骨瓣开颅手术时,去除骨瓣打开硬脑膜后,因为“远处脑组织-血肿腔-骨窗处脑组织”压力差,使局部脑组织在脑组织压及血肿压力的共同作用下向骨窗外膨出,脑组织压明显下降,在清除血肿时,“脑-血肿”压力差小,血肿不回缩,不易清除,只能通过脑压板的牵拉脑组织,来显露血肿进行清除,过度的牵拉易造成脑组织损伤;箭头方向代表脑组织及脑内血肿随压力改变移位方向[4]
综上所述,HICH患者PHE的发生、发展过程中,血肿占位效应引起炎症细胞表达浸润,导致VEGF、 MMP-9、TNF-α等炎症因子及氧自由基大量释放,导致血管内皮细胞受损,引发细胞毒性脑水肿及血管源性脑水肿的发生。而手术治疗可以清除颅内血肿,解除血肿占位效应,并清除血肿,防止血红蛋白等物质吸收引起的毒性作用,能够明显减少MMP-9、TNF-α等炎症因子的释放,打断了PHE的发生发展进程,有利于患者术后神经功能恢复。不同手术方式发挥的作用明显不同,锁孔内镜手术更为微创、血肿清除效率更高,术后MMP-9、TNF-α等炎症因子的释放能够更为迅速地下降,PHE的程度更低,更有利于HICH患者术后神经功能的恢复。
利益冲突:所有作者均声明不存在利益冲突。

