磷酸甘油酸激酶1通过调控β-catenin表达促进胶质瘤细胞侵袭性生长
阎华,刘宇阳,陈永严,肖红,刘宏毅
胶质瘤起源于神经上皮组织,约占原发脑肿瘤的45.2%[1],恶性脑肿瘤的80%[2]。胶质瘤侵袭性极高,在脑内沿白质纤维呈三维不规则浸润生长,甚至可在有限范围内见到多中心生长。目前国内采用的胶质瘤的主流治疗方案由Stupp教授在2005年提出,包括安全前提下最大程度地切除肿瘤,随后6周的同步放化疗及6周期的替莫唑胺(temozolomide,TMZ)辅助化疗[3]。即使如此,胶质母细胞瘤(glioblastoma,GBM)患者的中位生存期也仅仅14.6个月[4]。
由于脑组织的特殊性限制了手术的切除范围,侵犯至周边组织的胶质瘤细胞将成为点燃复发的火种,因此探寻胶质瘤局部浸润侵袭机制,对患者治疗有着重大意义。在本研究的前期工作中,筛选出磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)可能参与了胶质瘤的恶性生物学行为,体现在高级别、易复发、放射抵抗的胶质瘤中表达明显升高[5-6],提示在胶质瘤中PGK1可能与促进胶质瘤细胞侵袭浸润相关。为此,本研究设计了一系列实验,探寻PGK1对胶质瘤侵袭生长的影响极其作用机制。
1 材料与方法
1.1 材料 U87细胞(武汉普诺赛生命科技有限公司),胎牛血清(GIBCO),完全培养基(HyClone),细胞裂解液(碧云天),PMSF(碧云天),PVDF膜(Millipore公司),PGK1一抗(novus,1∶1 000),β-catenin一抗(Affinity,1∶800),p-β-catenin(S552)一抗(Affinity,1∶1 000),p-β-catenin(Y142)一抗(abcam,1∶500),p-β-catenin(Y333)一抗(abcam,1∶1 000),p-β-catenin(Y654)一抗(abcam,1∶1 000),p-β-catenin(S675)一抗(Affinity,1∶2 000),GADPH(杭州贤至生物有限公司,1∶1 000),羊抗小鼠IgG(武汉博士德生物工程有限公司,1∶100),抗荧光淬灭剂封片液(southernbiotech公司)Human PGK1 cDNA质粒(北京义翘神州科技有限公司,HG11114-M),BamH I及Not I(TAKARA),Trizol试剂(Ambion公司),martigel(BD公司),Lipofectamine 2000试剂盒(Invitrogen公司),β-catenin抑制剂(XAV 939)(targetmol公司)。
1.2 PGK1,β-catenin表达情况检测 U87细胞用含10%胎牛血清的完全培养基悬浮细胞,接种到培养皿中,轻轻吹打混匀,37 ℃、5% CO2、饱和湿度条件下培养。PBS(0.01 M pH 7.2~7.3)洗涤细胞,重复以上操作两次。以含PMSF的裂解液(按1 mL裂解液加10 μL PMSF)冰上裂解30 min,4 ℃下12 000 rpm离心5 min。将离心后的上清分装转移到0.5 mL的离心管。将提取的蛋白上清与5×蛋白上样缓冲液放入沸水中进行沸水浴10 min,变性完后冷却至室温。将制备好的胶固定到电泳槽上,储液池中倒入电泳液。用微量加样器将制备好的蛋白样品和marker(北京全式金生物技术有限公司,DM111)加入上样孔,各样品总蛋白量为40 μg。在12%聚丙烯酰胺凝胶中电泳2 h,湿法转移蛋白质到PVDF膜上。用含5%脱脂奶粉的TBST浸泡PVDF膜封闭2 h。用封闭液稀释一抗,4 ℃孵育过夜。TBST充分洗涤PVDF膜5~6次,5 min/次。用封闭液稀释相应的HRP标记二抗(1∶5 000稀释),孵育2 h。重复洗膜过程。化学发光法检测并暗室曝光,X胶片显影。以β-actin为内参,将目的蛋白条带灰度与内参进行比较,获得比值,定量蛋白表达程度。
1.3 细胞生长、迁移及侵袭能力检测
1.3.1 CCK-8检测细胞增殖 按分组进行细胞转染和药物处理72 h后,每孔加入10 μL CCK8,37 ℃培养4 h;酶标仪测定各孔吸光值光密度(optical delnsity,OD)450。
1.3.2 Transwell-martigel检测细胞侵袭 消化细胞,按2.5×104cell/mL浓度接种在含martigel的Tranwell小室上室,37 ℃,5% CO2培养箱培养12 h,按分组进行细胞转染和药物处理;转染72 h后取出transwell,用PBS小心清洗小室一遍,用干净的棉球将上室一侧的未迁移细胞擦干净,用10%甲醇溶液固定细胞30 min;小心切下膜,在膜上滴一滴5%结晶紫染液,室温中放置20 min,PBS清洗后显微镜下观察拍照。
1.3.3 Transwell检测细胞迁移能力 消化细胞,按2.5×104cell/mL浓度接种在含不含martigel的Tranwell小室上室,37 ℃,5% CO2培养箱培养12 h,按分组进行细胞转染和药物处理;转染72 h后取出transwell,用PBS小心清洗小室一遍,用干净的棉球将上室一侧的未迁移的细胞擦干净,用10%甲醇溶液固定细胞30 min;小心切下膜,在膜上滴一滴5%结晶紫染液,室温中放置20 min,PBS清洗后显微镜下观察拍照。
1.4 免疫荧光双标检测 在培养板中将已爬好细胞的玻片用PBS浸洗3 min×3次,4%的多聚甲醛固定爬片15 min,PBS浸洗玻片3 min×3次,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min。吸水纸吸掉封闭液,不洗,每张玻片滴加稀释好的PGK1(1∶50)并放入湿盒,4 ℃孵育过夜。PBS浸洗爬片3 min× 3次,吸水纸吸干爬片上多余液体后滴加稀释好的荧光(FITC)标记羊抗小鼠IgG(1∶100),湿盒中37 ℃孵育1 h,PBS浸洗切片3 min×3次,吸水纸吸干液体,在玻片上滴加正常山羊血清,室温封闭30 min。吸水纸吸掉封闭液,不洗,然后滴加稀释好的β-catenin(1∶200),于4 ℃湿盒中避光孵育过夜。PBS 浸洗爬片3 min× 3次,吸水纸吸干爬片上多余液体后滴加稀释好的荧光(Cy3)标记羊抗兔IgG(1∶100),湿盒中37 ℃孵育1 h,PBS浸洗切片3 min× 3次,滴加 DAPI避光孵育5 min,对标本进行染核,PBS 5 min×4次洗去多余的DAPI。用吸水纸吸干爬片上的液体,用抗荧光淬灭剂封片液封片,然后在荧光显微镜下观察采集图像。
1.5 PGK1过表达载体构建、效果验证及PGK1 siRNA合成、效果验证
1.5.1 PGK1过表达载体的建立 以NM_000291.3基因序列为模板设计引物,Human PGK1 cDNA质粒为模版扩PCR得到目的片段。用BamH I和Not I双酶切质粒pLVX-PGK-Puro和胶回收产物homo PGK1。将回收纯化的目的片段Homo PGK1与回收纯化的载体pLVX-PGK-Puro连接,连接产物命名为pLVX-PGK-Puro-homo-PGK1。连接产物转化DH5α感受态细胞,涂布LB AMP平板,37 ℃温箱培养过夜。挑取单个菌落,接种于LB AMP液体培养基中,37 ℃ 250 rpm培养过夜。取相应菌液做菌落PCR,送鉴定正确菌液测序。
1.5.2 PGK1 siRNA合成及细胞转染 设计合成针对人源PGK1的siRNA序列3条及1条对照siRNA。PGK1 siRNA1-Sense(5′-CCAAGUCGGUAG-UCCUUAUTT-3′),PGK1 siRNA1-Antisense(5′-AUA-AGGACUACCGACUUGGTT-3′),PGK1 siRNA2-Sense(5′-GCUUCUGGGAACAAGGUUATT-3′),PGK1 siRNA2-Antisense(5′-UAACCUUGUUCCCAGAAGCTT-3′),PGK1 siRNA3-Sense(5′-CCUGGAAGGUAAAGUCCU-UTT-3′),PGK1 siRNA3-Antisense(5′-AAGGACUUU-ACCUUCCAGGTT-3′),Control siRNA-Sense(5′-UUC-UCCGAACGUGUCACGUTT-3′),Control siRNA-Antisense(5′-ACGUGACACGUUCGGAGAATT-3′)。
取生长状态良好的U87细胞,以5×105/孔接种到六孔板中,37 ℃、5% CO2细胞培养箱24 h。待细胞贴壁后,按照Lipofectamine 2000试剂盒的转染步骤准备转染试剂:一只EP管(A管)用250 μL Opti-MEM稀释5 μL Lipofectamine 2000,室温静置5 min;一只EP管(B管)用250 μL Opti-MEM(Gibco)稀释2 μL siRNA或2 μg质粒。将A、B两管的溶液轻轻混匀后,室温静置20 min;将Lipofectamine 2000混合液加入到含有1.5 mL 完全培养基的6孔板中。转染4~6 h后更换培养基,转染60 h时加入5 μM XAV 939,再培养12 h。
1.6 qRT-PCR检测 收集细胞,加入Trizol试剂,用枪吹打混匀,移至无RNase的EP管中,裂解10 min。加入200 μL氯仿,剧烈颠倒混匀数次,室温放置5 min。在4 ℃,12 000 rpm下离心15 min,可见分成上(RNA)/中(蛋白)/下(DNA)三相。转移上层水相于另一新EP管中,加入异丙醇,混匀后室温静置10 min。4 ℃,12 000 rpm,离心10 min,管底可见白色的RNA沉淀。弃上清,加入无RNase的75%乙醇,涡旋混匀后,4 ℃,10 000 rpm,离心5 min,重复此步骤一次。弃上清,空气中干燥RNA沉淀5~10 min,将沉淀溶于DEPC水中。取溶解后的RNA用微量分光光度计测定OD260、OD280以及OD260/OD280值,计算RNA的纯度和浓度。根据OD260/OD280比值,估测RNA质量,比值在1.8~2.0之间满足实验要求。配制逆转录反应体系,逆转录成cDNA,25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min。cDNA做8倍稀释,配制实时荧光定量PCR反应体系,50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40 cycles。引物由擎科生物技术公司合成:Homo PGK1-Forward(5′-ACGCCAAGACGTTCAAGCGCAGCTA-3′),Homo PGK1-Reverse(5′-GGGGAGCGTGCCACCTTGACG-AAGC-3′),Homo GAPDH-Forward(5′-TGCGCC-CCAGTGTTTAGACTATC-3′),Homo GAPDH-Reverse(5′-TCAAAGGTGGAGGAGTGGGT-3′)。
2 结 果
转染siRNA序列后对U87细胞中PGK1的表达有抑制作用,PGK1过表达载体可增加胶质瘤细胞中PGK1表达量。PGK1过表达载体测序比对达到100%,且经PCR验证显示高表达PGK1 mRNA,说明载体构建成功。设计合成的3个PGK1 siRNA转染后,均低表达PGK1 mRNA,选择干扰效果最好的PGK1 siRNA1进行后续实验(siRNA抑制PGK1表达数据统计采用单因素方差分析,过表达载体增加PGK1表达数据统计采用t检验)。见图1。
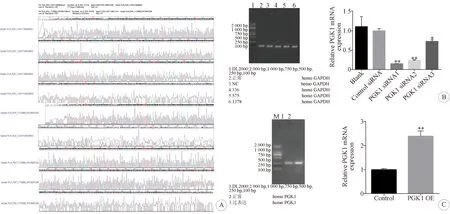
PGK1过表达载体构建成功,PGK1表达量增加,PGK1 siRNA合成成功,U87细胞中PGK1表达受到抑制; A:测序结果; B:PGK1 siRNA转染后抑制PGK1表达;**表示P<0.01 vs. Control siRNA,误差线表示SD(Blank表示U87细胞未经过任何处理,Control siRNA表示转染空白siRNA,PGK1 siRNA表示转染PGK1 siRNA); C:PGK1过表达载体转染后高表达PGK1;**表示P<0.01 vs. Control,误差线表示SD(Control表示转染空白载体,PGK1 OE表示转染PGK1过表达载体)
PGK1表达增加可导致U87细胞活性增加,侵袭能力及迁移能力增加;PGK1表达抑制可导致U87细胞活性减弱,侵袭能力及迁移减少。PGK1可对β-catenin表达进行调控。通过前期构建的PGK1过表达载体和PGK1 siRNA进行U87细胞转染,结果显示经过PGK1 siRNA或PGK1过表达质粒转染后,U87细胞生长活性出现相应降低及增加,使用β-catenin抑制剂(XAV 939)处理细胞,细胞生长活性降低,并且可导致过表达PGK1的U87细胞生长活性下降(图2),细胞侵袭能力和迁移细胞数也出现相应增加或减少(图3-4)。

与对照组相比,转染了siRNA的U87细胞细胞活性均下降,转染PGK1质粒高表达PGK1的U87细胞活性明显增高;进一步在高表达PGK1的U87细胞基础上,使用β-catenin抑制剂XAV 939能一定程度上降低PGK1对细胞增殖活性的影响;数据统计采用单因素方差分析,误差线表示SD;**表示P<0.01

与对照组相比,U87细胞Transwell上室细胞侵袭数统计结果(5%结晶紫染色,×200);细胞侵袭能力随着PGK1表达量的增减出现相应增加或减少,XAV 939抑制β-catenin表达可削弱PGK1对细胞侵袭能力的影响;数据统计采用单因素方差分析,误差线表示SD;**表示P<0.01
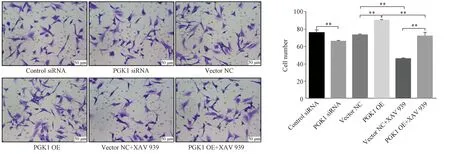
与对照组相比,U87细胞Transwell上室细胞迁移数统计结果(5%结晶紫染色,×200);随着PGK1表达量的增减,细胞迁移细胞数也出现相应增加或减少,β-catenin抑制剂XAV 939可削弱PGK1对U87细胞迁移能力的影响;数据统计采用单因素方差分析,误差线表示SD;**表示P<0.01
荧光双染结果显示,PGK1干扰处理后,细胞PGK1和β-catenin荧光表达均明显降低,共定位区域减少;过表达PGK1后,细胞PGK1和β-catenin荧光表达均明显增加,共定位区域增加。β-catenin抑制剂(XAV 939)对上游蛋白质PGK1荧光表达无明显影响,对β-catenin有明显的抑制作用,PGK1和β-catenin共定位区域减少(图5)。

图5 PGK1与β-catenin在U87细胞中表达的荧光双染检测
Western Blot检测显示,PGK1干扰处理后,细胞PGK1、β-catenin、p-β-catenin(S552)、p-β-catenin(Y142)、p-β-catenin(Y333)、p-β-catenin(Y645)、p-β-catenin(S675)蛋白质表达均明显降低;过表达PGK1后,各蛋白质表达均明显增加。β-catenin抑制剂(XAV 939)对上游蛋白质PGK1表达无明显影响,对β-catenin、p-β-catenin(S552)、p-β-catenin(Y142)、p-β-catenin(Y333)、p-β-catenin(Y645)、p-β-catenin(S675)的表达均有明显的抑制效果(图6)。

Control siRNA表示U87细胞经过空白siRNA转染72 h;PGK1 siRNA表示U87细胞经过PGK1 siRNA转染72 h;Vector NC表示U87细胞经过空白质粒转染72 h;PGK1 OE表示U87细胞经过PGK1过表达质粒转染72 h;Vector NC+XAV 939表示U87细胞经过空白质粒转染60 h后,加入5 μM β-catenin抑制剂(XAV 939)处理12 h;PGK1 OE+XAV 939表示U87细胞经过PGK1过表达质粒转染60 h后,加入5 μM β-catenin抑制剂(XAV 939)处理12 h
p-β-catenin(S675)磷酸化位点为Ser675,磷酸化后可促进β-catenin与转录因子结合,p-β-catenin(S552)磷酸化位点Ser552,p-β-catenin(Y142)磷酸化位点为Tyr142,两者参与破坏细胞间粘附及连接;p-β-catenin(Y333)磷酸化位点Tyr333,p-β-catenin(Y654)磷酸化位点位于Tyr645,两者参与质核运输,促进入核;PGK1可能不仅调控β-catenin的表达水平,并且直接参与了后者的磷酸化,这些磷酸化的活性蛋白同样可以作用于胶质瘤细胞,促进肿瘤生长、增强肿瘤侵袭及迁移能力,最终导致患者的不良预后。
3 讨 论
尽管胶质母细胞瘤在人群中发病率仅为3.2/10万人[2],但由于肿瘤恶性度极高,且各种方案的治疗效果一般,导致胶质母细胞瘤仍然是目前治疗难度最大的恶性肿瘤。因为肿瘤导致的高致残率及高病死率,不仅威胁患者生命安全,对个人和家庭造成严重的伤害,带来的社会经济负担更是不可估量。
长久以来,研究人员不断探索,各种新兴治疗手段如靶向治疗、免疫治疗和肿瘤电场治疗等均涉猎胶质瘤治疗领域,然而患者的生存期延长有限。因此,从胶质细胞瘤的发生机制、生长过程及环境、对不同治疗方式的敏感性等方面寻找突破点显得尤为迫切。
以前期研究为基础,本研究进一步探讨了PGK1在胶质瘤中的作用。PGK1最广为人知的身份是糖酵解过程的关键酶,其存在对生物体代谢具有极重要的意义。但在越来越多的研究中,揭示了PGK1不仅是一种代谢相关酶,与肿瘤的发生发展也密切相关。有观点认为,糖酵解途径可以为肿瘤增殖提供合成大分子所需的底物,即碳源。Hu等[7]指出在肝癌细胞中,PGK1对肿瘤细胞增殖及成瘤能力有重要影响, PGK1的异常上调表达广泛存在于胃癌、肺癌、乳腺癌、结肠癌、前列腺癌、胰腺癌等多种高侵袭性肿瘤,被视作不良转归的标志[8-11],但在癌周组织中的含量则接近正常,提示这种异常表达具有一定的肿瘤特异性。在这些非中枢系统肿瘤中,PGK1参与的病理生理过程涉及细胞代谢、基因转录及影响肿瘤细胞微环境等各个方面。
本研究结果提示PGK1的表达水平与胶质瘤的侵袭能力相关,并且可能激活β-catenin的表达。β-catenin通过介导基因转录过程,可以影响肿瘤细胞增殖、侵袭及转移等行为[12-14],下游靶点可能有趋化因子受体4(CXCR4)、转录因子4(TCF4)等[15-18],通过影响肿瘤新生血管形成及改变细胞粘附能力,促进肿瘤细胞经血液广泛转移[19]。一方面β-catenin表达活跃可促进肿瘤转移、浸润生长等恶性进程[20-23],另一方面当β-catenin活性被抑制时,肿瘤的生长将被削弱[24]。本研究结果证实了在胶质瘤中PGK1可能通过影响β-catenin的作用,促进肿瘤生长及侵袭过程,但其中的具体机制目前尚不十分明确。但本研究发现β-catenin的几种磷酸化形式:p-β-catenin(S552)、p-β-catenin(Y142)、p-β-catenin(Y333)、p-β-catenin(Y645)、p-β-catenin(S675)均出现了与PGK1表达同向的变化,β-catenin的磷酸化是其重要的活化形式,提示或许PGK1通过对β-catenin的磷酸化来完成调控过程。根据磷酸化位点的不同,β-catenin参与了与转录因子的结合(S675),破坏细胞间粘附及连接(S552及Y142),质核运输,促进入核(Y333及Y645)等过程。这些作用对于肿瘤细胞的增殖、侵袭至关重要。深入研究PGK1对β-catenin的调控机制将是今后的重要探索方向。
综上所述,PGK1的过表达对胶质瘤细胞的增殖、侵袭和迁移均有促进作用,其机制可能与调控β-catenin表达及对后者的磷酸化相关。在2016新版WHO中枢神经系统肿瘤分类中,将分子分型对肿瘤的诊断提升到了非常重要的位置,为科研、临床及肿瘤流行病学提供了确实的指导,同时显示出今后肿瘤学中,分子标志物必将有广阔而光明的应用前景。进一步求证PGK1在胶质瘤中的未解之谜,评估其作为分子标志物的可能性,或许终有一日,可为胶质瘤的多元化、个性化治疗方案提供选择。
利益冲突:所有作者均声明不存在利益冲突。
——一道江苏高考题的奥秘解读和拓展

