脂多糖刺激对断奶仔猪空肠形态结构、炎症反应和程序性坏死信号通路相关基因表达的影响
徐启龙 汪 洋 李先根 肖 勘 肖世平 魏伟群 刘玉兰*
(1.武汉轻工大学动物营养与饲料科学湖北省重点实验室,武汉 430023;2.江西天佳生物工程股份有限公司,南昌 330200)
肠道不仅是消化和吸收营养物质的重要场所,也是机体重要的屏障器官,能够抵御内源性和外源性有害物质进入机体内环境[1]。许多因素如应激、感染和炎症等能导致肠黏膜损伤和功能障碍[2],但是肠道损伤的机制尚未阐明。
肠道损伤与细胞死亡密切相关。目前公认的主要细胞死亡类型有3种,即坏死、凋亡和自噬。凋亡又称“程序性死亡”,在生物体发育过程中普遍存在,是一种由基因控制的、主动的、有序性的细胞死亡方式。坏死则是由一种由物理、化学或生物等因素导致的细胞死亡方式,传统上,坏死被认为是无序的、被动的、不可逆和不可调控的[2-3]。近年来,一种新鉴定的细胞死亡方式——程序性坏死,因有别于传统的细胞死亡方式——坏死、凋亡及自噬,而成为生命医学领域的研究热点[3]。研究表明,程序性坏死是一种由基因决定的细胞主动有序的死亡方式,不依赖于半胱氨酸天冬氨酸蛋白酶(Caspase)途径,一般在凋亡被抑制的情况下发生,可最终引发邻近细胞的免疫应答[4];死亡细胞具有典型的坏死细胞的形态学特征,细胞和细胞器体积肿大,线粒体扩大崩解,溶酶体膜破坏,酶类释放到周围组织,核膜破裂,核溶解,碎核涌出细胞,会引起周围组织的炎症反应[5]。
程序性坏死信号通路的关键调控因子有受体相互作用蛋白激酶1(RIP1)、受体相互作用蛋白激酶3(RIP3)、混合系列蛋白激酶结构域样蛋白(MLKL)[6]。研究表明,程序性坏死在缺血再灌注和炎症反应等多种因素导致的组织损伤中发挥重要作用。抑制程序性坏死对这些因素诱导的组织损伤具有重要的预防和治疗作用[7]。然而,程序性坏死在脂多糖(LPS)注射诱导的仔猪肠道损伤中的作用尚未被阐明。因此,本试验采用腹膜注射LPS构建仔猪肠道损伤模型,来探究LPS刺激对断奶仔猪肠道形态及程序性坏死信号通路的影响,为揭示程序性坏死在肠道损伤中的作用奠定初步基础,最终为寻求缓解肠道损伤的措施提供新的理论依据。
1 材料与方法
1.1 试验材料
LPS:大肠杆菌血清型055∶B5,购于Sigma公司;RNA提取、反转录及实时定量PCR所用试剂盒信息参见黄菲菲等[8]。
1.2 试验设计
选取12头平均体重为(7.07±0.57)kg的28日龄杜×长×大三元断奶仔猪,随机分为2组,分别为对照组和LPS刺激组,每组6头。所有仔猪自由饮水、采食,预饲9 d,仔猪状态良好,体重达到(8.96±0.54)kg。LPS刺激组腹腔注射100 μg/kg BW的LPS,对照组注射等量的生理盐水。注射LPS 4 h后将仔猪麻醉屠宰,取空肠中部置于冰上,用生理盐水清洗后,剪取3 cm固定于4%多聚甲醛溶液中用于制作组织切片;另取相近肠段10 cm沿纵向剪开刮取肠黏膜后存放在液氮中,最后再转移到-80 ℃超低温冰箱保存待测。
1.3 测定指标与方法
1.3.1 空肠组织形态学分析
首先将空肠组织样品进行包埋,制成5 μm的切片,然后进行苏木素-伊红(HE)染色、树脂胶封片等处理,之后在Olympus光学显微镜下观察空肠组织形态,测量绒毛高度、隐窝深度,并计算两者比值。具体方法参照陈逢[9]。
1.3.2 空肠黏膜DNA、RNA、蛋白质含量测定
取空肠黏膜制备成匀浆液,然后稀释为1%匀浆液后测定DNA、RNA、蛋白质含量。蛋白质含量采用南京建成生物工程研究所生产的考马斯亮蓝试剂盒测定,DNA和RNA含量采用参照Johnson等[10]使用分光光度计法测定。根据蛋白质、DNA和RNA含量计算RNA/DNA、蛋白质/DNA值。
1.3.3 空肠炎性细胞因子和程序性坏死信号通路相关基因mRNA相对表达量测定
提取空肠黏膜总RNA,然后按照Prime Script RT Reagent Kit试剂盒步骤将RNA逆转录成cDNA,荧光定量聚合酶链式反应采用SYBR®Premix Ex TaqTM(Tli RNaseH Plus)real-time PCR试剂盒。以3-磷酸甘油醛脱氢酶(GAPDH)作为参比基因,采用Livak等[11]的2-ΔΔCt法计算目的基因——炎性细胞因子[环氧合酶2(COX2)、热休克蛋白70(HSP70)、白细胞介素-6(IL-6)]和程序性坏死信号通路相关基因[RIP1、自杀相关因子死亡结构域(FADD)、Caspase8、RIP3、MLKL、磷酸甘油酸变位酶5(PAGM5)、动力相关蛋白1(Drp1)、高迁移率族蛋白1(HMGB1)]的mRNA相对表达量。引物序列见表1。

表1 引物序列
1.4 统计分析
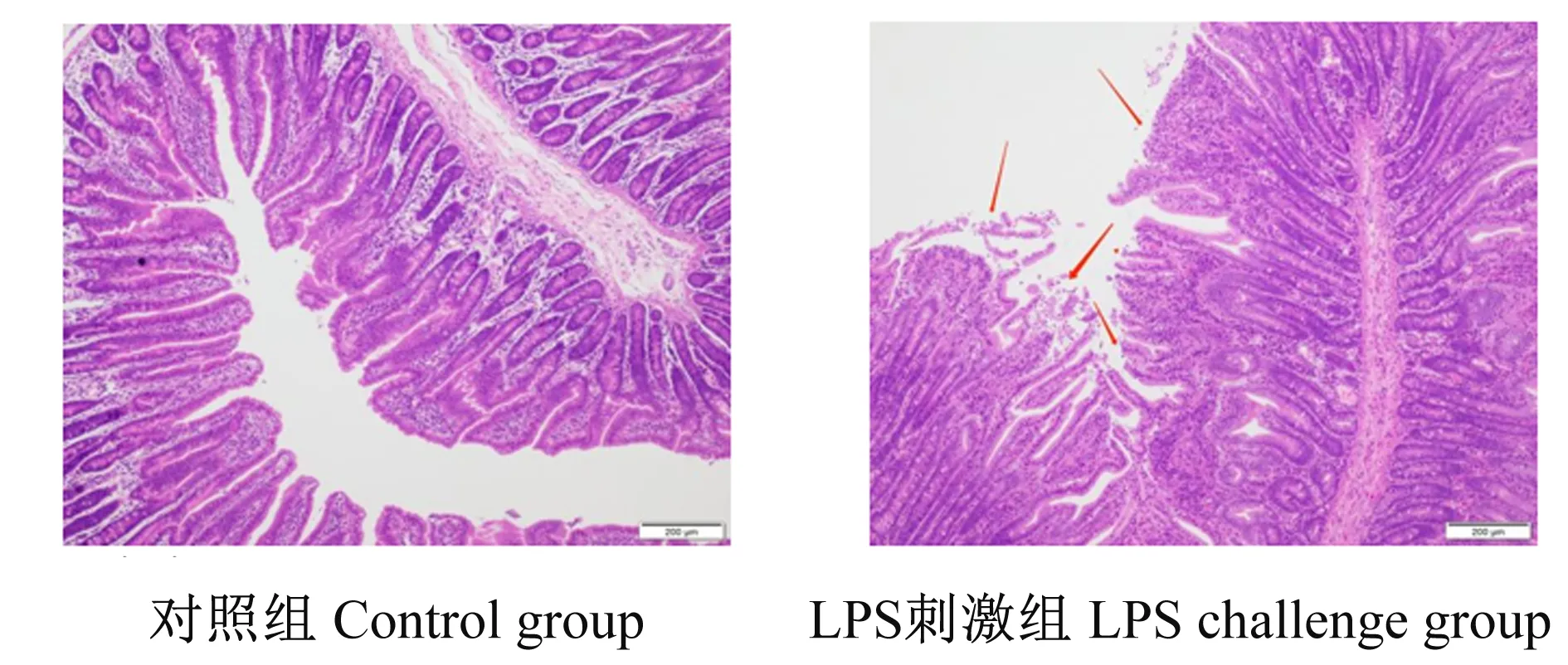
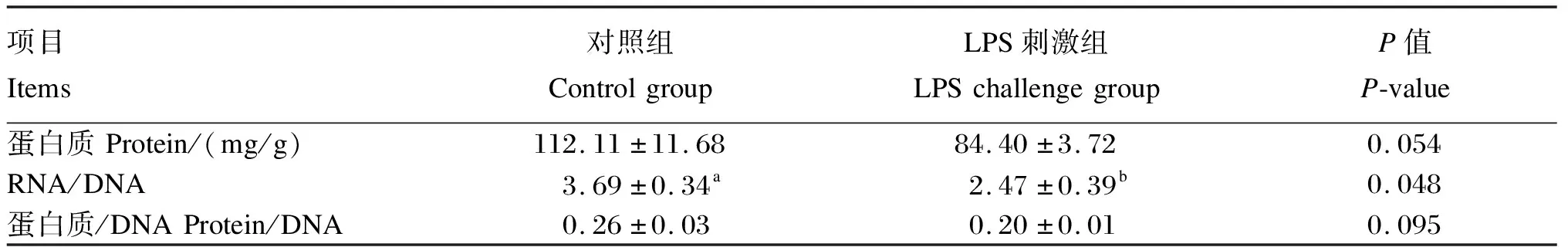
试验数据采用SPSS 22.0软件进行独立样本t检验,结果以平均值±标准误来表示。以P≤0.01为差异极显著,P≤0.05为差异显著,0.05 由图1可知,对照组空肠绒毛形态结构完整,绒毛较长;LPS刺激后空肠绒毛严重萎缩,并大量脱落。由表2可知,与对照组相比,LPS刺激导致空肠绒毛高度和隐窝深度显著降低(P<0.05)。 表2 LPS刺激对断奶仔猪空肠形态结构的影响 图1 空肠组织切片 由表3可知,与对照组相比,LPS刺激显著降低了空肠黏膜RNA/DNA(P<0.05),同时蛋白质含量和蛋白质/DNA有显著下降趋势(P=0.054、P=0.095)。 表3 LPS刺激对断奶仔猪空肠黏膜蛋白质含量以及RNA/DNA和蛋白质/DNA的影响 由表4可知,与对照组相比,LPS刺激后导致空肠HSP70和IL-6的mRNA相对表达量显著升高(P<0.05),COX2的mRNA相对表达量极显著升高(P<0.01)。 表4 LPS刺激对断奶仔猪空肠炎性细胞因子mRNA相对表达量的影响 由表5可知,与对照组相比,LPS刺激后导致空肠程序性坏死信号通路相关基因RIP1的mRNA相对表达量显著升高(P<0.05),RIP3的mRNA相对表达量极显著升高(P<0.01)。 表5 LPS刺激对断奶仔猪空肠程序性坏死信号通路相关基因mRNA相对表达量的影响 LPS存在于所有革兰氏阴性细菌的细胞膜中,对宿主有毒性。LPS能诱导肠道形态学损伤,如黏膜下水肿、出血、黏膜坏死,并导致黏膜通透性增加和细菌移位[12]。因此,通过在猪腹膜或静脉注射一定剂量的LPS是构建仔猪肠道损伤模型的经典方式[13]。本试验采用LPS刺激仔猪,探究其对仔猪空肠形态结构、炎症反应和程序性坏死信号通路的影响。 肠道绒毛高度、隐窝深度、绒毛高度/隐窝深度常被用来评估肠道形态和结构的完整性[14]。蛋白质、RNA和DNA含量是反映肠道生长发育及损伤修复的指标,蛋白质/DNA、RNA/DNA可表明蛋白质合成能力[15]。本试验中,LPS刺激导致断奶仔猪肠道绒毛形态结构发生了显著变化,表现为绒毛萎缩、脱落;同时,LPS刺激导致空肠绒毛高度和隐窝深度显著降低,并显著降低了空肠黏膜RNA/DNA,同时蛋白质含量、蛋白质/DNA有显著下降趋势,表明LPS刺激导致断奶仔猪空肠结构和功能受损。Liu等[16]的研究结果也表明LPS刺激会导致断奶仔猪空肠和回肠黏膜结构损伤,与本研究结果一致。 研究表明,炎性细胞因子COX2、HSP70和IL-6等在炎症性肠病中起着重要作用[17]。COX2在炎症的发生和消退过程中都起到了重要作用:在炎症发生期通过合成前列腺素E2(PGE2)诱导炎症细胞释放趋化因子发挥促炎作用,在炎症消退期以合成前列腺素D2(PGD2)、15-脱氧前列腺素J2(15ΔPGJ2)发挥拮抗炎症和抑制氧化应激的作用[18]。HSP70在机体抵御各种有害刺激中发挥重要作用,可抗细胞凋亡、抗氧化,参与机体的先天免疫反应和细胞免疫[19]。IL-6则能通过加强炎性细胞因子的级联反应,促使炎性细胞因子大量产生,最终引起局部炎症反应[20]。Lang等[21]的研究结果表明,在大鼠肠道中LPS刺激会提高炎性细胞因子COX2和HSP70的mRNA相对表达量,并促使其在短时间内(1~2 h)达到峰值。本试验中,LPS刺激导致断奶仔猪空肠COX2、HSP70和IL-6的mRNA相对表达量显著提高,表明LPS刺激导致空肠炎症反应激活并使空肠受损加重。 在病理条件下,细胞程序性坏死和炎症互相影响[22]。目前,研究较为广泛的是肿瘤坏死因子(TNF)与死亡受体肿瘤坏死因子受体1(TNFR1)结合所介导的程序性坏死信号通路。TNF与TNFR1结合可引起后者构象变化,随后募集胞内的TNF受体相关信号分子肿瘤坏死因子受体相关死亡域蛋白(TRADD)、RIP1等形成复合体Ⅰ。随后,复合体Ⅰ上的TRADD和RIP1会解离并发生磷酸化且提供新的结合位点,这些结合位点又会募集FADD、Caspase8、RIP1形成新的复合体Ⅱ[23-25]。当Caspase8活性被抑制时,复合体Ⅱ上的RIP1、RIP3、MLKL发生磷酸化,执行程序性坏死功能。本试验检测了程序性坏死信号通路相关基因的mRNA相对表达量变化,结果表明,LPS刺激显著提高了断奶仔猪空肠程序性坏死信号通路相关基因RIP1、RIP3的mRNA相对表达量,说明LPS刺激导致程序性坏死信号通路激活。因此,我们推测,仔猪空肠的损伤和炎症反应与程序性坏死信号通路激活密切相关。 LPS刺激损伤了断奶仔猪的空肠形态结构,激活了炎症反应和程序性坏死信号通路。2 结 果
2.1 LPS刺激对断奶仔猪空肠形态结构的影响

2.2 LPS刺激对断奶仔猪空肠黏膜蛋白质含量以及RNA/DNA和蛋白质/DNA的影响
2.3 LPS刺激对断奶仔猪空肠炎性细胞因子mRNA相对表达量的影响

2.4 LPS刺激对断奶仔猪空肠程序性坏死信号通路相关基因mRNA相对表达量的影响

3 讨 论
4 结 论

