抗BVDV Erns蛋白单克隆抗体制备及生物学特性鉴定
陈文龙,米晓钰,张阳阳,张生英,张玉珺,邢小勇,胡永浩
(甘肃农业大学动物医学院 传染病学试验室,兰州 730070)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是黄病毒科瘟病毒属单链RNA病毒[1],主要以牛腹泻病、呼吸道疾病、生产性能下降等临床症状为主[1-2]。BVDV有一种血清型(Serotype),三种基因型:BVDV-1、BVDV-2和BVDV-3,两种生物型:细胞病变型(Cytopathic biotype, CP)和非细胞病变型(Noncytopathic biotype, NCP)[2-3]。而怀孕母牛在妊娠期120 d内感染BVDV NCP型毒株后,产出的免疫耐受牛(Persistent infection, PI)为该病最主要的传染源[3],而检测PI牛存在很大的难度,导致牛病毒性腹泻病的防控及消除有很大问题。同时BVDV还严重影响牛源经济产品,例如感染牛的冻精、血清、抗体、疫苗均会受到出口限制[3-4],给以畜牧业为主国家造成严重的经济损失。
Erns蛋白是BVDV结构蛋白中最为保守的蛋白,其结构中含有一个高度保守的结构域[5],对于制备抗体和研发疫苗来讲必不可少;而Erns无跨膜区,有信号肽,有利于蛋白的表达[6];再者Erns蛋白具备良好的免疫原性,可诱导机体产生中和抗体[7,10],最重要的是Erns蛋白可被直接分泌到细胞外[8,12],具有重要的检测价值。目前针对BVDV检测试剂盒较多,但国内尚没有针对Erns蛋白的商品化BVDV检测试剂盒[9],本试验使用的制备单克隆抗体的Erns蛋白抗原为优化基因序列后,得到大小为17 kDa的His-Erns重组蛋白,更有利于刺激小鼠机体产生高效分泌抗体的免疫细胞,制备的抗原和抗体为建立检测BVDV试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物材料 6周龄Balb/c雌鼠、8周龄昆明小鼠(Kunming mice, KM小鼠)购自甘肃兰州大学。
1.1.2 细胞、菌种 BVDV C24V参考毒株购自兰州民海生物公司;小鼠骨髓瘤细胞(SP2/0 Cell)、MDBK(Madin-Darby bovine kidney, MDBK)细胞;13种病原微生物:牛支原体PG45株(Mycoplasma bovis PG45 strain)、牛支原体武威株(Mycoplasma bovis Wuwei strain)、肺炎克雷伯菌(Klebsiella pneumoniae)、沙雷氏菌(Serratia)、巴氏杆菌(Pasteurella)、沙门菌(Salmonella)、链球菌(Streptococcus)、波氏杆菌(Bordetella)、金黄色葡萄球菌(Staphylococcus aureus)、牛源大肠杆菌(Bovine E. coli)、传染性鼻气管炎病毒(Infectious rhinotracheitis virus, IBRV)、兔瘟病毒(Rabbit plague virus)、小反刍兽疫病毒(Peste des petits ruminants virus, PPRV)均由甘肃农业大学传染病学教研室保存;重组His-Erns蛋白由作者构建、表达且已发表文章。
1.1.3 主要试剂 弗氏完全、不完全佐剂购自美国Sigma公司;HAT(50×)、HT(50×)、聚乙二醇(PEG-4000)均购自美国赛默飞公司;BAC蛋白定量试剂盒、辣根过氧化氢酶标记的羊抗鼠IgG购自南京碧云天生物技术有限公司;高糖DMEM基础培养液、胎牛血清、二甲基亚砜购自美国HyClone公司;鼠单抗Ig类/亚类/亚型鉴定ELISA试剂盒购自洛阳佰奥通试验材料中心。
1.2 小鼠免疫淋巴细胞制备 以Erns蛋白为免疫原,选取健康Balb/c小鼠6只;首次免疫使用重组蛋白(100 μg/只)和等体积的弗式完全佐剂,背部多点注射免疫小鼠;第一次免疫14 d后,每隔7 d重组蛋白(50 μg/只)和等体积弗式不完全佐剂免疫小鼠,共免疫4次;间接ELISA测定小鼠血液抗体效价,若抗体效价高于1∶20 000,即腹腔注射重组蛋白(200 μg/只)加强免疫;3 d后取3只加强免疫后的小鼠,尾静脉采集血液并分离血清,以重组蛋白为抗原,ELISA测定抗体效价,选取最高效价小鼠作为试验动物(注:以未免疫小鼠血清为阴性对照,按照阳性值等于阴性值×2.1倍计算结果)。
1.3 BVDV抗原最佳包被量测定
1.3.1 BVDV增殖、收集 将解冻的病毒液,按细胞维持液20%的体积,接种于铺满细胞瓶底70%的MDBK细胞,共吸附4 h,每隔30 min晃动培养液,使病毒吸附均匀;弃病毒液;加入2%维持液,间隔12 h观察,待产生病变(与不感染病毒细胞比较),记录时间,直至细胞不再产生病变时,将细胞反复冻融4次,1000×g离心30 min,收集上清液,0.22 μm滤器过滤,-80℃保存备用。
1.3.2 测定抗原最佳包被量 设置11个病毒体积梯度:5、10、20、30、40、50、60、70、80、90、100 µL,病毒液混合包被液加入96孔酶标板,4℃包被12 h;洗板后,5%的脱脂奶粉4℃封闭12 h;洗板,-20℃保存备用;采用方阵滴度法结合间接ELISA确定BVDV最佳抗原包被量,设置阴性对照和空白对照组;以倍比稀释的E0多克隆抗体为一抗,ELISA测定结果;取OD450值在1.0左右,且P/N值最大的抗原和抗体浓度作为最佳工作浓度;测定最佳抗原浓度后,按上述方法将病毒抗原大量包被酶标板,-20℃保存备用。
1.4 建立杂交瘤细胞
1.4.1 SP2/0细胞培养 融合前30 d取液氮冻存SP2/0复苏,连续传代培养,使细胞在融合前形态良好,密度适中,达到最佳生长状态。
1.4.2 饲养细胞制备 融合前24 h,取1只健康昆明鼠,参考文献[4]及单克隆抗体制备试验手册[7],取其腹腔细胞并计数,将细胞稀释约2×105个/mL,按每孔100 µL加入96孔板中(注:因杂交瘤细胞培养耗时长,为防止板内液体蒸干,96孔板最外一圈孔加入200 µL PBS),置于培养箱中培养。
1.4.3 小鼠脾细胞制备 参照文献[4]及单克隆抗体制备试验手册[7],无菌操作取小鼠脾脏,分离免疫B淋巴细胞,计数备用。
1.4.4 细胞融合 首先无血清培养制液备SP2/0细胞悬液,计数备用;SP2/0细胞与脾细胞按1∶5混合,使用1 mL预热的50% PEG-4000诱导细胞融合,将融合后细胞重新制备为悬液,按每孔100 µL加入铺好饲养细胞的96孔板中,置于细胞培养箱中培养、观察。
1.5 阳性杂交瘤细胞筛选 96孔板中细胞使用核苷酸缺失培养基HAT、HT培养,经过共3次亚克隆筛选培养:首先细胞计数,按照每孔1个细胞进行稀释,加入96孔板;若孔内有多个细胞则进行2次亚克隆,单个细胞簇结合间接ELISA重复测定阳性细胞孔。
1.6 单克隆抗体腹水制备 提前7 d用灭菌液体石蜡(1 mL/只)注射昆明鼠腹腔;将稳定分泌抗体的杂交瘤细胞扩大培养,细胞计数并稀释为2×106个/mL,每只小鼠注射1 mL;观察小鼠腹腔,若腹部膨胀幅度小,可继续饲养;若小鼠腹部大幅膨胀,将小鼠处死,固定解剖台,剪开皮肤,剪开腹膜,若可见腹腔黏膜多处附着有白色细胞团块,则采集腹水,离心去除细胞碎片,编号分装,-20℃保存备用。
1.7 单克隆抗体生物学特性鉴定
1.7.1 抗体效价测定 用病毒、重组蛋白两种抗原检测腹水抗体效价,以SP2/0细胞上清液为阴性对照,腹水抗体从1∶100起倍比稀释,37℃孵育2 h,洗板;每孔加入100 µL稀释的HRP标记的羊抗鼠二抗(1∶3000),37℃孵育2 h,洗板;每孔加入100 µL TMB酶-底物显色液,37℃显色15 min;2 mol/L H2SO4终止显色,酶标仪在450 nm波长下测定结果(每组抗原设置3个平行组)。
1.7.2 抗体大小鉴定 腹水抗体混合Buffer,100℃煮沸制样,12% SDS-PAGE电泳分离,考马斯亮蓝法染色、脱色,观察并拍照。
1.7.3 抗体特异性鉴定
1.7.3.1 Western blot鉴定 病毒制样,经12% SDSPAGE电泳分离,半干法将病毒转至NC膜;5%脱脂奶粉4℃封闭12 h;洗膜后,1∶1000稀释的腹水抗体4℃孵育12 h;洗膜后,使用1∶6000稀释的HRP标记的羊抗鼠二抗37℃孵育2 h;洗膜,化学发光显色。
1.7.3.2 IFA鉴定 试验设置无病变细胞对照、细胞病变对照,阴性对照、多抗血清对照;6孔板(内置无菌载玻片)培养MDBK细胞,待细胞生长约70%接种病毒,待细胞产生大量病变且未脱落时,多聚甲醛固定10 min,洗板;5%脱脂奶粉37℃封闭1 h,洗板;腹水抗体1∶2000稀释,37℃孵育2 h;洗板;1∶500 HRP标记的羊抗鼠二抗室温避光孵育2 h;PBST避光充分洗涤,爬片置于滴有抗荧光淬灭剂的载物片,荧光显微镜观察、拍照。
1.7.3.3 间接ELISA鉴定 以13种病原微生物为抗原,参照包被BVDV方法,将其包被96孔板;以腹水抗体作一抗,按照1∶100倍比稀释,HRP标记的羊抗鼠抗体为二抗(1∶4000),间接ELISA方法测定抗体特异性结合。
1.7.4 抗体亚型测定 首先试剂盒由4℃恢复至室温;试验设置阳性对照8孔,阴性对照8孔,腹水抗体检测8孔;将腹水抗体检测孔先加入样品稀释液50 µL,再加入50 µL腹水抗体;阳性对照和阴性对照不加稀释液,加入样品100 µL,封板37℃温育30 min,弃去板内液体,洗板,拍干;在8孔阳性对照孔及腹水抗体孔分别加入8种酶标二抗100 µL,做标记,封板37℃温育30 min,弃去板内液体,拍干;每孔分别加入显色剂A和显色剂B各50 µL,封板37℃避光温育20 min;判定方法,将显蓝色的孔与相对应的酶标二抗对比可知抗体的亚型。
2 结果
2.1 Erns重组蛋白免疫小鼠效价测定 ELISA结果显示,3只小鼠5次免疫后抗体效价均高于105(表1),通过比较,2号小鼠效价趋势高于其他两只(图1),即选用2号小鼠为试验材料。
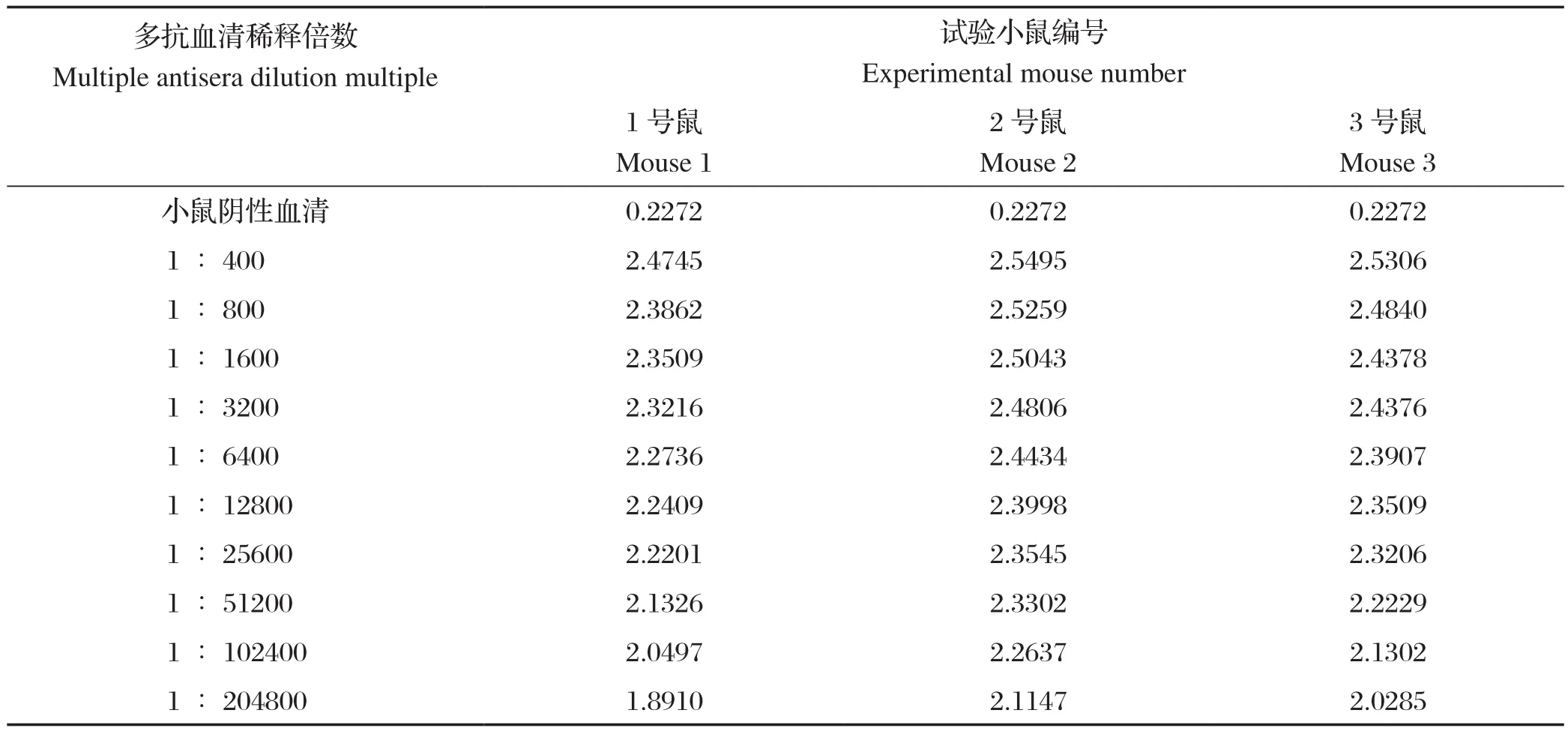
表1 试验小鼠抗体效价结果Table 1 Test mouse antibody titer results

图1 小鼠血清抗体效价比较Fig.1 Comparison of serum antibody potency of mice
2.2 病毒抗原最佳包被量测定 MDBK细胞感染病毒后与对照组(图2A)相比,感染病毒的细胞产生明显的细胞病变:空泡、脱落、圆缩(图2B),与预期相符,可收集病毒;ELISA测定结果显示当每孔包被80 µL病毒液时,一抗稀释度为1∶100时,阳性血清OD450值为0.8428,阴性血清为0.1433,P/N值为5.8810最佳值,即测出BVDV抗原最佳包被量为每孔80 µL病毒原液(表2)。

图2 MDBK细胞感染病毒后比较Fig.2 Comparison of MDBK cells after infection

表2 BVDV抗原最佳包被量测定结果Table 2 Results of determination of the best coating quantity of BVDV antigen
2.3 杂交瘤细胞生长结果 细胞融合完成后,将5块96孔板共计300孔细胞培养,隔日显微镜观察生长情况(图3),12~15 d后,出现80个明显细胞簇孔,占比为26.67%。

图3 单克隆抗体融合细胞Fig.3 Monoclonal antibody fusion cells
2.4 杂交瘤细胞上清液效价测定 标记的80孔细胞中,测定结果显示有10孔数值较大(表3),占比为12.5%,其中第2孔阳性值远高于其他孔(表3),2次标记待测。
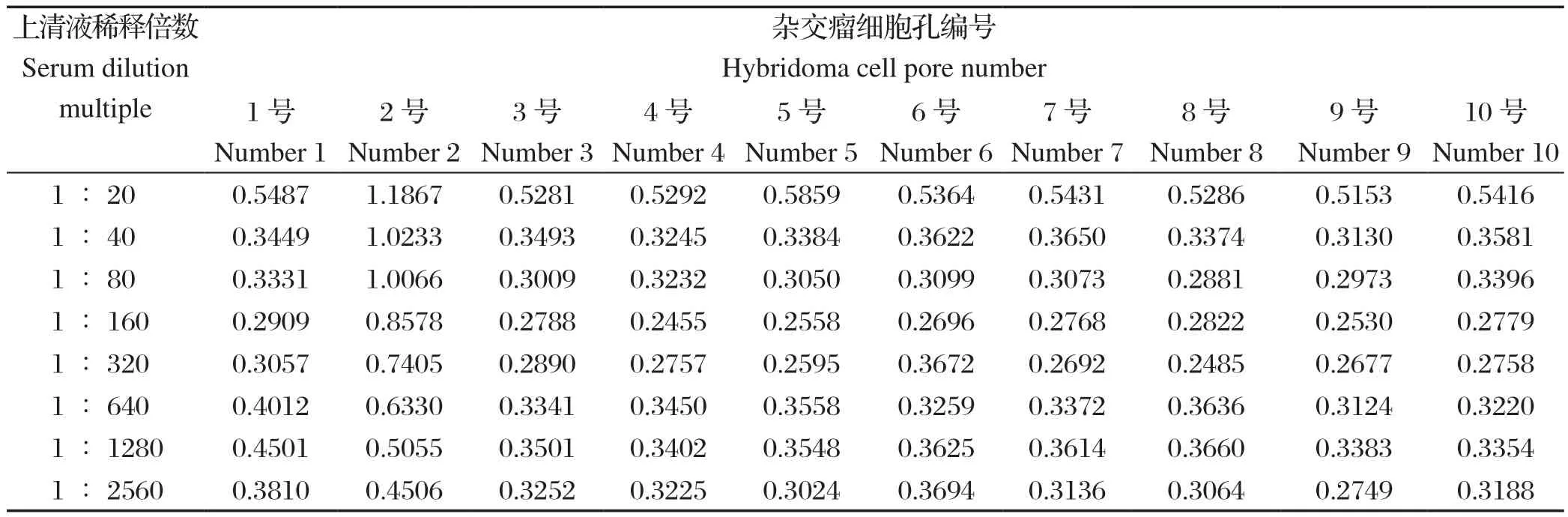
表3 杂交瘤细胞上清效价测定结果Table 3 Determination of the titer of hybridoma cells
2.4.1 杂交瘤细胞孔重复测定 每隔7 d按照相同的方法,重复测定阳性孔,结果表明2号孔杂交瘤细胞可稳定分泌抗体,将其作为阳性融合细胞进行亚克隆(表4)。

表4 杂交瘤细胞孔重复测定结果Table 4 Repeated determination of in hybridoma cell pores
2.5 单一杂交瘤细胞簇生长状况 经过3次亚克隆筛选后,出现了单一的细胞簇,通过显微镜观察,其形态良好,纯度高(图4),可扩大培养。

图4 单一杂交瘤细胞簇生长趋势Fig. 4 Growth trend of single hybridoma cell cluster
2.6 单克隆抗体生物学特性鉴定 如图5所示,在小鼠腹腔有明显的白色细胞簇,证明单克隆细胞株在小鼠腹腔培养成功,可采集腹水。
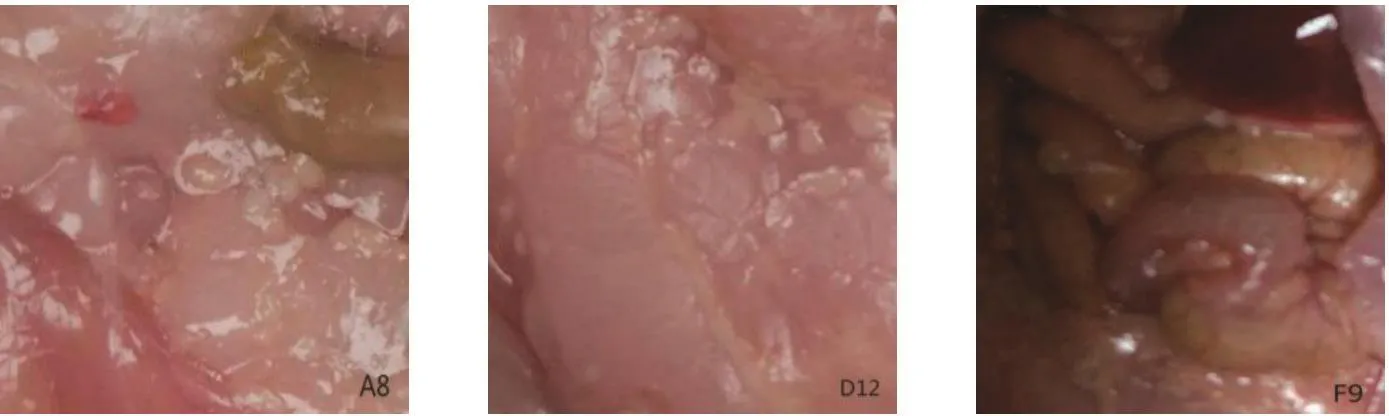
图5 杂交瘤细胞附着小鼠腹腔Fig. 5 Hybridoma cells attached to the abdominal cavity of mice
2.6.1 腹水单克隆抗体效价测定 如表5所示,三株单克隆抗体细胞株均可以稳定的分泌抗体,抗体效价约为105。

表5 ELISA测定腹水抗体效价结果Table 5 Results of determination of antibody titer in asciticfluid by ELISA
2.6.2 腹水抗体大小鉴定 SDS-PAGE电泳结果显示,重链大小55 kDa,轻链大小25 kDa(图6),符合免疫球蛋白重链、轻链大小。

图6 SDS-PAGE鉴定腹水抗体重链和轻链大小Fig. 6 SDS-PAGE identification of heavy chain and light chain size of asciticfluid antibody
2.6.3 腹水抗体生物学特性鉴定
2.6.3.1 Western blot 将病毒抗原转移至载体膜,使用单克隆抗体结合,化学发光后在17 kDa处出现预期的条带(图7),证明制备的单克隆抗体活性良好。
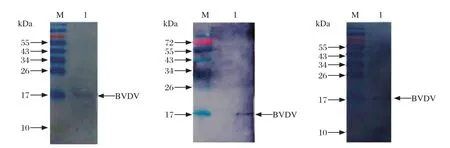
图7 腹水抗体Western blot检测Fig.7 Detection Western blot ascites antibody
2.6.3.2 间接免疫荧光检测 IFA结果显示,将病毒抗原感染细胞后,细胞出现稳定病变(图8A);空白对照、阴性对照均没有荧光(图8C、8D),阳性对照出现大范围荧光;A8、D12、F9均出现荧光反应(图8F、8G、8H),证明抗体活性良好,可特异性结合细胞内病毒。
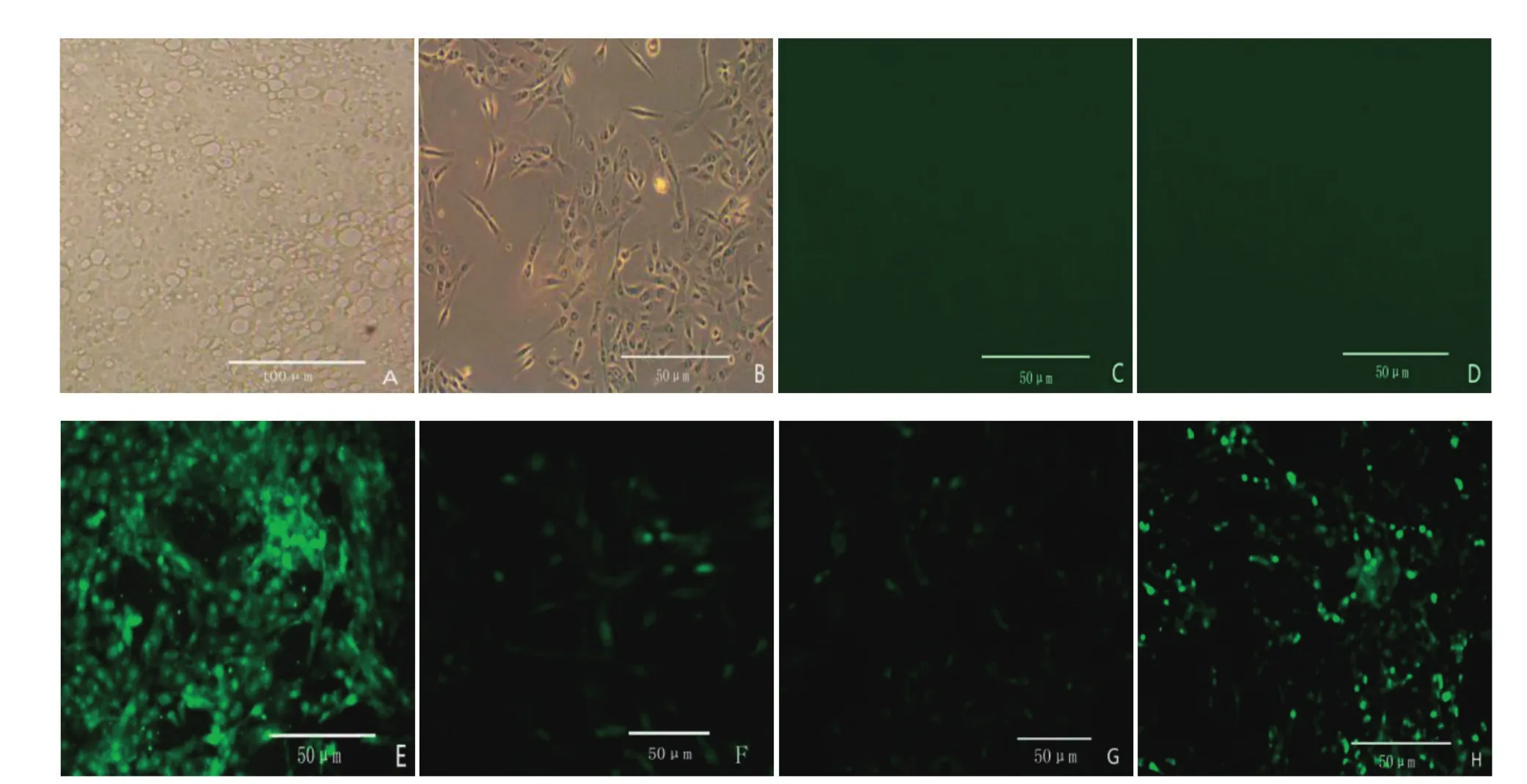
图8 腹水抗体IFA检测Fig. 8 Detection IFA ascites antibody
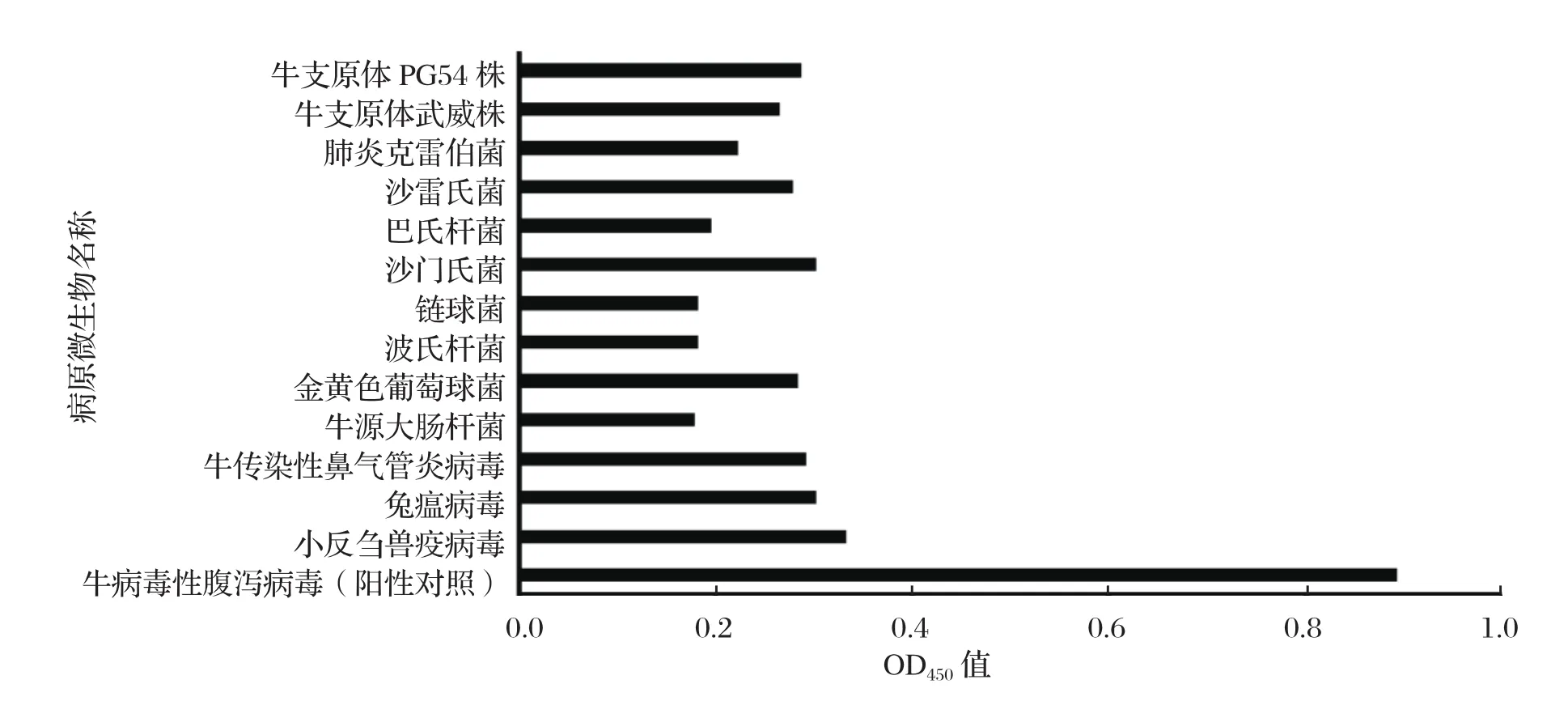
图9 A8株抗体特异性鉴定结果Fig. 9 Identification of antibody specificity of strain A8

图10 F9株抗体特异性鉴定结果Fig. 10 Identification of antibody specificity of strain F9

图11 D12株抗体特异性鉴定结果Fig.11 Identification of antibody specificity of strain D12
2.6.3.3 ELISA特异性鉴定 ELISA结果显示,腹水抗体与阳性对照的牛病毒性腹泻病毒特异性结合良好,OD450值大于0.8;而其他13种病原微与腹水抗体OD450值均小于0.4,去除细菌包被酶标板后本身对吸光度值得影响,ELISA实验证明抗体特异性较好。
2.6.4 单克隆抗体亚型鉴定 亚型鉴定试剂盒包含8种酶标二抗:Goat Anti-Mouse IgG1、IgG2a、IgG2b、IgG3、IgGM、IgGA、IgGκ、IgGλ,3种制备的单克隆抗体在TMB显色后,蓝色孔对应的酶标二抗孔均为IgG1,即三株抗体均为IgG1型。
3 讨论
单克隆抗体是由一株淋巴细胞分泌的针对单一抗原决定簇的抗体,具有专一性高、亲和力强、特异性好等特点[10],在蛋白质结构与功能研究中起到关键作用[11]。杂交瘤抗体技术自1975年诞生以来不断发展[12],近年来以噬菌体展示抗体技术、单个B细胞抗体技术为代表的新型技术在制备全人源性抗体方面取得重大成果。文献表明以牛病毒性腹泻病毒为抗原制备其单克隆抗体时,将产生抗其他成分的抗体,融合后筛选单一细胞株十分困难[13]。目前
发表的关于BVDV抗体的研究主要针对非结构蛋白NS3[14],而Erns蛋白是BVDV主要结构蛋白,也是BVDV强免疫原性蛋白之一,在BVDV及整个瘟病毒属都是极为重要的蛋白[15];Erns蛋白可直接分泌于细胞外,是BVDV最重要的诊断抗原[16];但目前在制备亚单位疫苗和诊断试剂盒方面,E0的研究还较少[17],所以选择E0蛋白作为制备单克隆抗体的抗原,可以填补缺少针对E0抗体的研究。
本试验使用His-Erns重组蛋白免疫动物,间接ELISA测定4次免疫后血清多克隆抗体效价高于1∶51 200,证明重组蛋白可有效刺激机体产生免疫反应,有利于得到高效率分泌抗体的免疫细胞,同时重组蛋白使用的His标签极短,只有6个组氨酸,不会影响重组蛋白的活性。再者本试验在融合试验前30 d开始复苏骨髓瘤细胞,通过不断地传代培养,在融合时形状规则整齐,圆润透亮。再者试验选用个体较大的昆明鼠制备腹腔巨噬细胞,采集的小鼠腹腔细胞密度较高,有利于制备融合细胞。试验采用最为成熟的PEG诱导杂交瘤细胞融合技术,制备单克隆抗体,该方法融合成本低、产生异核率高,不需特殊设备,在制备过程中不易出现差错;经过HAT、HT缺失培养基筛选阳性杂交瘤细胞,可以使其他双核细胞死亡,不易产生假阳性细胞。同时ELISA、Western blot、IFA方法重复对杂交瘤细胞筛选,相互佐证,使筛选的细胞存在假阳性概率极小。最终鉴定出3株可稳定分泌针对Erns蛋白的单克隆抗体A8、F9、D12,抗体特异性良好,重链为55 kDa,轻链为25 kDa,抗体效价1∶50 000以上且活性良好,为制备诊断牛病毒性腹泻试剂盒奠定基础。

