双通道微流控芯片的研制及在RNP抗体和SmD1抗体检测中的应用
袁榕晨 黄 钊,3钱纯亘, 吴力强 汤建新
1.湖南工业大学 生命科学与化学学院 生物医用纳米材料与器件 湖南省重点实验室 湖南 株洲 412007
2.深圳市亚辉龙生物科技股份有限公司 广东 深圳 518116
3. 湖南师范大学 化学生物学及中药分析 教育部重点实验室 湖南 长沙 410081
1 研究背景
自身免疫性疾病(autoimmune diseases,AD)是自身免疫系统T细胞和B细胞对自身成分进行攻击,导致局部或全身性损伤的疾病[1]。常见的自身免疫性疾病有系统性红斑狼疮(systemic lupus erythematosus,SLE)、类风湿性关节炎(rheumatoid arthritis,RA)、混合结缔组织病(mixed connective tissue disease,MCTD)、I型糖尿病等,此外有报道斑秃[2]、子宫内膜异位症[3]等疾病也与自身免疫系统异常有关。自身免疫性疾病的遗传学背景复杂,临床表现多种多样[4],在普通人群中的发病率约为3%~5%,但其发病机制尚不明确[5-6]。研究表明,自身免疫性疾病与遗传因素及细菌、病毒感染等环境因素有关,具有发病晚、治愈难度高及预后差的特点,会累及多器官受损,严重影响患者的生活质量,且目前尚无根治方法[7-8]。因此,为早发现、早诊断疾病,研究者们提出了检测血清学标志物的诊断方法,该方法能减轻或避免靶器官、靶组织的损伤。
核糖核蛋白(ribonucleoprotein,RNP)抗体和SmD1抗体为常见的自身免疫性疾病临床诊断指标[9-11]。研究表明混合结缔组织病患者的血清中存在高滴度RNP抗体[12],并几乎没有SmD1抗体[13];而系统性红斑狼疮患者的血清中存在高滴度的SmD1抗体[14-16],且患者血清中常伴有RNP抗体阳性[17]。因此,RNP抗体和SmD1抗体可作为临床诊断混合结缔组织病和系统性红斑狼疮的重要联检指标[18]。血清检测中RNP抗体阳性、SmD1抗体阴性为混合结缔组织病诊断的重要依据,而血清检测中RNP抗体和SmD1抗体均为阳性,可以作为系统性红斑狼疮诊断的重要依据。
目前,检测自身免疫性疾病抗体标志物的常用方法主要有间接免疫荧光法、酶联免疫吸附法和免疫印迹法等[19]。间接免疫荧光法是自身免疫性疾病检测的金标准,但操作复杂,对操作人员要求较高,检测结果多为定性或半定量。酶联免疫吸附法可以对抗体水平进行检测,但需要专业的技术人员。免疫印迹法操作简便,但只能做到定性检测[20]。上述常用检测方法灵敏度低,费时费力,需要专业的仪器和技术人员,且要在设备齐全的实验室才能完成。因此,发展快速便捷的多靶标检测方法可有效解决现存检测方法的缺陷,有利于自身免疫性疾病的早发现、疗效评价和预后跟踪。
微流控芯片技术将微升至亚纳升样品溶液的预处理、反应、分离和检测单元集成到一块微小的芯片上[21],在芯片中实现了微纳尺度的流体操控与集成,提高生物分子间的反应速度,缩短反应时间,简化操作过程,且试剂用量小,使用成本低,因而微流控芯片技术在生物分析与生物传感等领域的应用备受关注[22-23]。将微流控芯片技术应用于多种自身免疫抗体的快速联合检测,有望提高自身免疫性疾病临床诊断的准确度,减轻医疗负担,对自身免疫性疾病的筛查与管理具有重要意义。但是目前相关研究鲜有报道。
本研究拟设计一种基于免疫反应的微流控芯片,以用于对样本中的多个自身免疫性疾病标记物同时检测。通过优化微流控芯片结构设计和检测条件,制备出具备特斯拉阀的双通道微流控芯片,实现对自身免疫性疾病标志物中RNP抗体和SmD1抗体的快速便捷检测。
2 实验部分
2.1 试剂与仪器
1)试剂
KCl、KH2PO4、Na2HPO4·7H2O、NaCl、 吐 温20,化学纯,国药集团化学试剂有限公司;聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA),成都世化亚克力科技有限公司;RNP抗原、SmD1抗原、RNP校准品、SmD1校准品,深圳市亚辉龙生物科技股份有限公司;羊抗人IgG-FITC,美国Sigma-Aldrich公司;牛血清白蛋白(bovine serum albumin,BSA),瑞士罗氏公司;硝酸纤维素膜,德国沃特曼公司;9795R封板膜、9969医疗双面胶,美国3M公司;实验用水为二次蒸馏水。
溶液配制:用4.5542 g Na2HPO4·7H2O、0.8 g KH2PO4、32 g NaCl、0.8 g KCl配置 0.5 mol/L 的磷酸盐缓冲液(200 mL,pH值为7.4),使用时50倍稀释至0.01 mol/L的磷酸盐缓冲液;封闭液为1%BSA+0.01 mol/L磷酸盐缓冲液;清洗液为0.1%吐温20 +0.01 mol/L磷酸盐缓冲液;待测样本为用0.01 mol/L磷酸盐缓冲液配置成不同浓度的校准品;实验所用抗原、羊抗人IgG-FITC均用0.01 mol/L的磷酸盐缓冲液稀释至所需浓度。
2)仪器
激光雕刻机,VLS 3.50型,美国优利激光公司;真空热压机,TBS-200型,浙江扬清芯片技术有限公司;微流控注射泵,Pump 11 Elite型,美国Harvard Apparatus公司;IsoFlow平板式喷膜机,美国Imagene公司;涡旋振荡器,S0200-230V-EU,美国Labnet公司;鼓风干燥箱,DHG-9245A,上海一恒科学仪器有限公司;倒置荧光显微镜,DMi8型,德国徕卡;共聚焦显微镜,DCM 8型,德国徕卡;接触角测量仪,OCA 25型,德国DataPhysics公司;化学发光免疫分析仪,iFlash 3000型,深圳市亚辉龙生物科技股份有限公司。
2.2 微流控芯片的构建
2.2.1 微流控芯片结构组装
采用激光切割技术与真空热压相结合的加工工艺制备单通道微流控芯片。芯片的结构示意图和3D爆炸图分别如图1a和1b所示。芯片分为4层,从下到上依次为底板层、废液腔层、反应腔层和盖片层,其中,底板层、废液腔层和反应腔层采用PMMA板材,盖片层为9795R封板膜。整个单通道微流控芯片的功能结构区域分为加样孔、储存腔、特斯拉阀、混合区、反应腔、废液腔和流道。在反应腔层设置的特斯拉单向阀(见图1c),用于控制液体流向,确保从加样孔1加入的液体试剂无法进入储存腔,而从加样孔2加入的液体试剂复溶储存腔中的试剂后,可以通过特斯拉阀到达混合区。
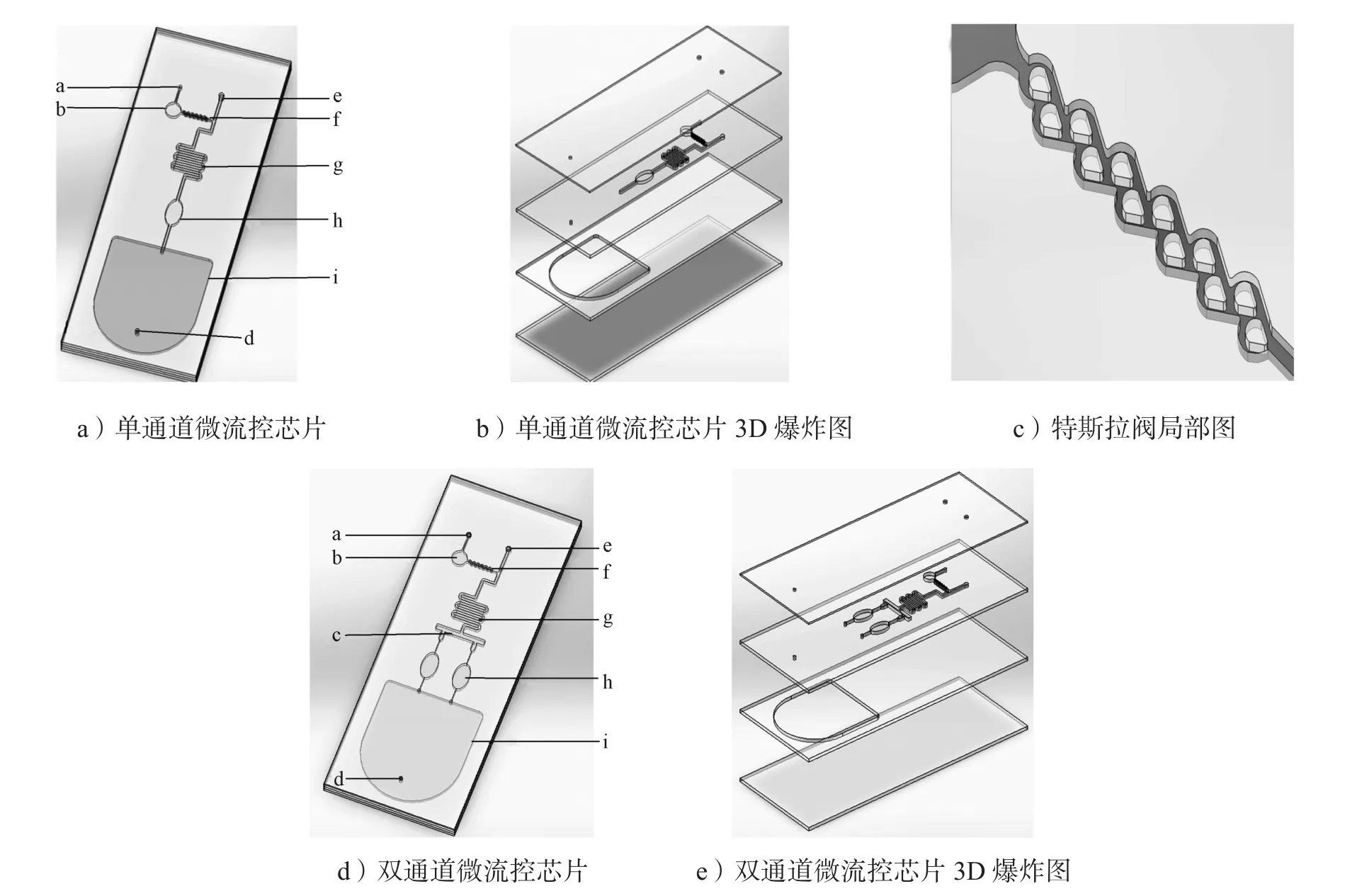
图1 微流控芯片示意图Fig. 1 Schematic diagram of the microfluidic chip
单通道微流控芯片的具体制备步骤如下:1)首先采用Auto CAD软件绘制芯片各层二维结构图,再设计和优化各层三维结构,得到如图1b所示的芯片各层功能结构区域示意图;2)以粘贴医用双面胶的PMMA板材和9795R封板膜作为芯片材料,将设计的芯片结构图导入激光雕刻机的配套软件,切割出如图1b所示的4层结构。其中,用激光雕刻位于反应腔层的储存腔表面时,只打出光栅,使反应腔层表面形成凹凸不平的粗糙结构,增大比表面积,便于后续反应试剂的修饰。3)按要求进行相关反应试剂的修饰,以确保芯片组装完成后可用于后续的样本测试。4)从下到上按图1b所示结构依次组装切割好的底板层、废液腔层、反应腔层和盖片层,再放入真空热压中,37 ℃热压键合5 min压合芯片,得到如图1a所示的微流控芯片。
2.2.2 反应试剂修饰
配置一定浓度的羊抗人IgG-FITC试剂,取10µL滴加在储存腔表面,再放入真空干燥器,室温下干燥24 h。将试剂修饰微流控芯片的储存腔表面,用于后续的芯片组装。
配置一定浓度的RNP抗原或SmD1抗原试剂,用平板式喷膜机将抗原试剂在硝酸纤维素膜上划线包被,在鼓风干燥箱中37 ℃下烘干24 h后,反面贴双面胶;用激光雕刻机将硝酸纤维素膜切割成反应腔形状,膜尺寸与反应腔一致,再将硝酸纤维素膜粘贴于反应腔中,用于后续的芯片组装。
双通道微流控芯片的组装步骤和反应试剂修饰步骤与单通道微流控芯片类似,只是双通道微流控芯片增加了一个分液区和反应腔,以实现对双标志物的同时检测。双通道微流控芯的结构示意图及3D爆炸图分别如图1d和1 e所示。
3 微流控芯片的检测原理与步骤
3.1 检测原理
微流控芯片的检测原理(见图2)是:先用封闭液封闭芯片内的非特异性吸附位点,封闭结束后用清洗液清洗;再加入待测样本,待测样本中抗体与硝酸纤维素膜上包被的抗原发生特异性结合,形成抗原-抗体复合物,随后清洗未被结合的抗体;然后,加入羊抗人IgG-FITC,与被结合的抗体发生特异性结合,形成抗原-抗体-标记抗体(羊抗人IgG-FITC)复合物,随后清洗未结合的羊抗人IgG-FITC;最后,在倒置荧光显微镜下观察FITC并拍照,所得图像用Image J软件处理分析,得到灰度值,实现对待测样本的定量检测。
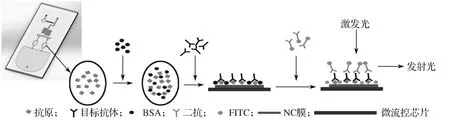
图2 检测原理示意图Fig. 2 Schematic diagram of detection principle

彩图
3.2 检测步骤
单通道微流控芯片和双通道微流控芯片的检测步骤类似,但双通道微流控芯片内的液体流速为单通道微流控芯片的2倍,这是因为在双通道微流控芯片中所有通道的截面积均相等,当液体通过双通道微流控芯片中的分液结构后,反应腔通道内的压强降低,为单通道微流控芯片反应腔通道内压强的1/2,因此,将双通道微流控芯片的液体流速加倍,才能确保相同时间内流经双通道微流控芯片反应腔的液体体积与单通道微流控芯片相同。
用双通道微流控芯片检测样本的具体过程如下:
过程1:从加样孔1以20 μL/min的流速通入清洗液以润湿芯片,待液体流入废液腔后,调整流速为5 μL/min,持续10 min浸润芯片,以改善芯片通道内的亲水性,促进液体分液均匀。
过程2(第1次孵育,封闭步骤):从加样孔1以4 μL/min的速度通入封闭液,孵育20 min,如图3a所示。封闭液从加样孔1(步骤1)到达混合区混匀(步骤2),再到反应腔对芯片内的非特异性反应位点进行封闭(步骤3),最后流入废液腔(步骤4)。

图3 双通道微流控芯片的孵育步骤Fig. 3 Incubation steps of dual-channel microfluidic chip

彩图
过程3:从加样孔1以10 μL/min的速度加入清洗液,清洗残留的封闭液试剂,清洗时间为10 min。
过程4(第2次孵育,捕获样本待测抗体步骤):从加样孔1以4 μL/min的速度加入待测样本,孵育30 min,如图3b所示。待测样本经过程2的流动路径,在反应腔与芯片内的对应抗原反应(步骤7)。
过程5:从加样孔1以10 μL/min的速度加入清洗液,清洗残留的待测样本试剂,清洗时间为10 min。
过程6(第3次孵育,标记抗体反应步骤):从加样孔2以4 μL/min的速度加入稀释液,孵育45 min,如图3c所示。稀释液从加样孔2(步骤9)到达储存腔,并与储存腔中的羊抗人IgG-FITC复溶,通过特斯拉阀(步骤10)后,经过程2的流动路径,在反应腔与芯片内被捕获的待测抗体发生特异性反应(步骤12)。
过程7:从加样孔1以10 μL/min的速度加入清洗液,清洗残留的标记抗体试剂,清洗时间为10 min。
过程8(信号检测):将芯片置于倒置荧光显微镜下观察并拍照,所得图像裁剪成相同大小后使用Image J软件处理,先用通道拆分功能(split channels)分离出绿色通道图像,然后调整阈值,对所有区域进行检测,得到灰度平均值,绘制灰度平均值与待测样本浓度的关系曲线。
4 结果与讨论
4.1 微流控芯片的结构和亲水性表征
4.1.1 微流控芯片结构表征
用共聚焦显微镜观察芯片的存储腔及通道,如图4所示。由图4可知,存储腔表面为不规则凹凸结构,通道为上宽下窄倒梯形结构,上端宽度为450 μm,下端宽度为150 μm,通道深度为450 μm,深宽比约为1:1,说明用激光切割工艺制备的微流控芯片较好。

图4 存储腔、通道的明场和三维示意图Fig. 4 Bright field and 3D schematics of the storage cavity and channel
4.1.2 微流控芯片亲水性表征
对微流控芯片进行表面改性,以提高PMMA亲水性。采用接触角评估微流控芯片表面的亲水性,结果如图5所示。由图5可知:改性前,PMMA表面与超纯水的接触角为64.9°,流体在双通道微流控芯片中的分液流动不均匀;使用清洗液浸润微流控芯片内部通道后,接触角减小至44.6°。改性后,双通道微流控芯片的亲水性增强,有助于改善通道内液体的流动性,促进分液均匀。

图5 材料表面的接触角测定Fig. 5 Measurement of material surface contact angle
4.2 单通道微流控芯片内检测条件优化
4.2.1 封闭时间与待测样本反应时间的优化
为了确定包被RNP抗原的单通道微流控芯片的最佳封闭时间和待测样本反应时间,在包被质量浓度为0.2 mg/mL的RNP抗原芯片中通入浓度为126.0 AU/mL的RNP抗体样本,固定羊抗人IgG-FITC二抗的孵育时间为45 min,测试不同封闭时间和待测样本反应时间下的检测效果,实验结果如图6所示。由图6可知,当封闭时间从10 min增加到20 min时,反应信号的灰度值升高,这是因为封闭液封闭了非特异性吸附位点,使得抗体及羊抗人IgG-FITC在反应腔中发生的非特异性吸附减少,降低了背景信号。当封闭时间达到30 min时,反应信号的灰度值下降,这可能是因为封闭液中的BSA占据了较多硝酸纤维素膜表面的反应位点。当封闭时间为20 min时,随着样本反应时间的增加,反应信号灰度值逐渐升高,并在30 min时达到饱和。
SmD1抗体与RNP抗体检测结果一致,故后续选择封闭时间为20 min,待测样本反应时间为30 min。
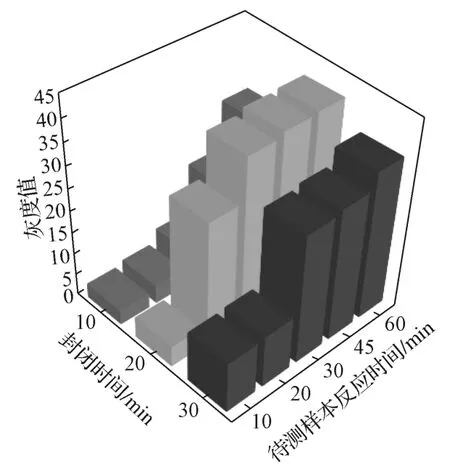
图6 单通道微流控芯片内反应时间的优化Fig. 6 Optimization of reaction time in single channel microfluidic chip
4.2.2 抗原包被浓度的优化
在硝酸纤维素膜上分别包被质量浓度为0.1, 0.2,0.3, 0.4, 0.5 mg/mL的RNP和SmD1抗原。芯片组装好后,加入样本进行反应,反应信号灰度值与RNP和SmD1抗原浓度的关系如图7所示。
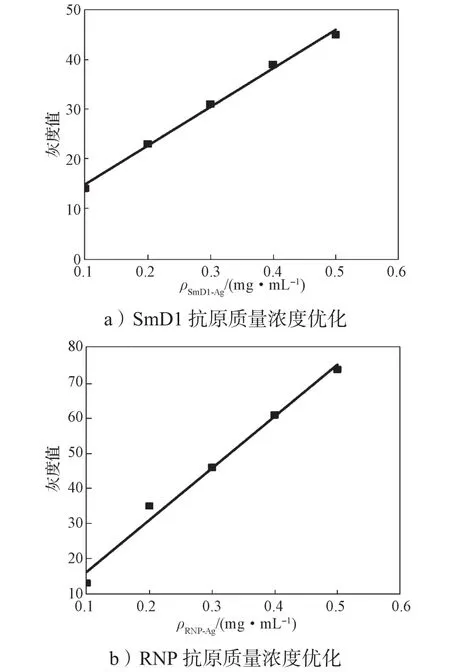
图7 反应信号灰度值与RNP和SmD1抗原质量浓度的关系Fig. 7 The relationship between the gray value of the reaction signal and RNP, SmD1 antigen concentration
由图7可知,随着抗原质量浓度的升高,反应信号灰度值随之升高,呈线性关系。但包被抗原浓度较高时,高浓度样本的信号值会超出数据处理软件的分析上限,并且芯片成本也随之上升。综合考虑芯片检测性能和制造成本,最终选择0.2 mg/mL作为最优抗原包被质量浓度。
4.2.3 检测范围
在包被抗原质量浓度为0.2 mg/mL的芯片中通入不同浓度的样本。RNP抗体的样本浓度分别为444.0,247.0, 126.0, 48.0, 9.6 AU/mL,SmD1抗体的样本浓度分别为424.8, 197.5, 94.7, 22.4, 12.5 AU/mL。根据结果绘制灰度值-样本浓度的四参数非线性拟合曲线(见图8),确定自制芯片的检测范围。

图8 RNP和SmD1抗体的灰度值-样本浓度拟合曲线Fig. 8 Gray value-sample concentration fitting curves of RNP and SmD1 antibodies
RNP抗体的拟合方程为

RNP抗体、SmD1抗体的检测范围分别为9.6~444.0,12.5~424.8 AU/mL,检测限分别为5, 6.25 AU/mL。如表1所示,自制芯片与亚辉龙iFlash 3000化学发光免疫分析仪的检测范围接近,可满足临床检测需求。

表1 微流控芯片的检测范围与化学发光法的检测范围比较Table 1 Comparison of detection range between microfluidic chip and chemiluminescence method AU/mL
4.3 双通道微流控芯片的性能测试
4.3.1 特异性
根据单通道微流控芯片的检测优化参数,制备了能同时检测RNP抗体和SmD1抗体的双通道微流控芯片。结果表明双通道微流控芯片对RNP抗体和SmD1抗体的检测性能与单通道微流控芯片的一致,双通道微流控芯片对RNP抗体和SmD1抗体的检测范围分别达到9.6~444.0, 12.5~424.8 AU/mL。在此基础上,进一步考察双通道微流控芯片对RNP抗体和SmD1抗体同时检测的特异性。将双通道微流控芯片用于检测混合样本,结果如图9所示。
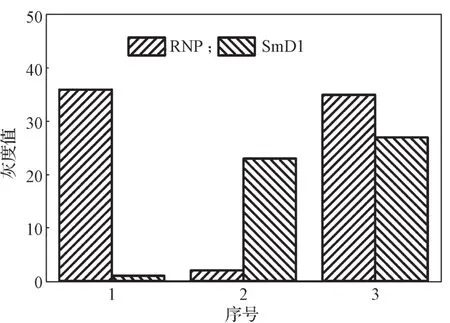
图9 双通道微流控芯片用于检测RNP抗体和SmD1抗体的特异性Fig. 9 The specificity of dual channel microfluidic chip for detection RNP antibody and SmD1 antibody
由图9可知,当RNP抗体样本为阳性,SmD1抗体样本为阴性时,在包被RNP抗原的反应腔中检测到荧光条带,而在包被SmD1抗原的反应腔中未检测到荧光条带;当RNP抗体样本为阴性,SmD1抗体样本为阳性时,在包被RNP抗原的反应腔中未检测到荧光条带,而在包被SmD1抗原的反应腔中检测到荧光条带;当RNP抗体样本为阳性,SmD1抗体样本为阳性时,在包被RNP抗原的反应腔中检测到荧光条带,在包被SmD1抗原的反应腔中也检测到荧光条带。以上结果说明自制芯片特异性良好。
4.3.2 重复性
用5个双通道微流控芯片检测相同的样本,以测试芯片重复性。RNP抗体和SmD1抗体检测的重复性结果如图10所示。由图10可知,自制芯片的检测相对标准偏差(relative standard deviation,RSD)分别为4.4%和3.5%,均不超过5%,说明自制芯片检测结果的重复性较好。
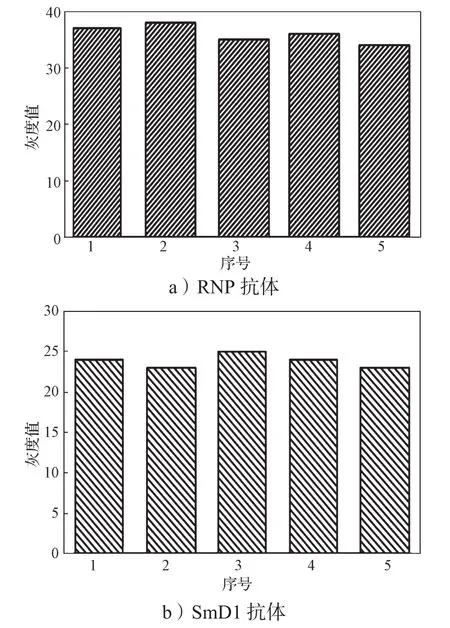
图10 双通道微流控芯片用于检测RNP抗体和SmD1抗体的重复性Fig. 10 The repeatability of dual channel microfluidic chip for detecting RNP antibody and SmD1 antibody
4.3.3 稳定性
为了研究双通道微流控芯片检测抗体的稳定性,将微流控芯片于4 ℃分别储存1, 20 d,分别检测浓度为126.0 AU/mL的RNP抗体样本和浓度为94.7 AU/mL的SmD1抗体样本。结果表明,储存20 d的芯片检测RNP、SmD1抗体样本的信号值分别为储存1 d的95.7%和96.0%。可见,自制双通道微流控芯片在20 d内检测性能无明显降低,稳定性较好。
5 结论
本研究设计和制备了一种双通道微流控芯片,应用光栅结构增大存储腔的比表面积,利用特斯拉单向阀控制液体流向,使反应按照所需步骤依次进行。双通道结构可以同时检测不同的标志物,且仅需微量样本即可实现快速灵敏的检测。基于免疫学方法同时检测样本中RNP抗体和SmD1抗体,无需大型仪器和繁琐的步骤,检测范围分别为9.6~444.0, 12.5~424.8 AU/mL,RSD分别为4.4%和3.5%,检测限分别为5,6.25 AU/mL,且特异性良好,未发生交叉反应。可见,本研究所设计的双通道微流控芯片可用于自身免疫疾病标志物联检,为研制高通量、多靶标、低成本的体外诊断用微流控芯片提供了新思路。

