参一胶囊辅助治疗原发性肝癌的系统评价
张金华,田园,杨晓萍
参一胶囊辅助治疗原发性肝癌的系统评价
张金华1,田园2,杨晓萍3
1.荆门市第一人民医院,湖北 荆门 448000;2.西南医科大学附属中医医院,中医药表型组学研究中心,四川 泸州 646000;3.上海市第七人民医院,上海 200003
系统评价参一胶囊辅助治疗原发性肝癌的临床疗效及安全性。计算机检索中国知识资源总库(CNKI)、中国学术期刊数据库(Wanfang Data)、中国生物医学文献数据库(CBM)、中文科技期刊数据库(VIP)、PubMed、Cochrane Library、Embase、Web of Science自建库至2020年12月参一胶囊辅助治疗原发性肝癌的临床随机对照试验。由2名研究者独立筛选文献,进行有效资料提取,并根据Cochrane偏倚风险评估工具进行质量评估。采用RevMan 5.3进行Meta分析。共纳入9篇文献,涉及患者788例。Meta分析结果显示,参一胶囊联合西医治疗在客观缓解率(=2.51,95%[1.65,3.83],<0.000 1)、疾病控制率(=2.76,95%[1.88,4.07],<0.000 01)、甲胎蛋白下降率(=2.60,95%[1.01,6.69],=0.05)、1年生存率(=2.34,95%[1.53,3.58],<0.000 1)、2年生存率(=2.33,95%[1.28,4.27],=0.006)、Karnofsky功能状态评分提高率(=2.91,95%[1.62,5.23],=0.000 4)、骨髓抑制发生率(=0.40,95%[0.23,0.68],=0.000 9)方面均显著优于单纯西医治疗。参一胶囊辅助治疗原发性肝癌可提高临床疗效、患者生存率,改善患者生存质量,降低骨髓抑制发生率,但尚需大样本、多中心、高质量的临床随机对照试验进一步验证。
参一胶囊;人参皂苷Rg3;原发性肝癌;随机对照试验;Meta分析
原发性肝癌是临床常见的严重危害患者生命健康的恶性肿瘤。《2018年全球癌症统计报告》表明,原发性肝癌在全球癌症发病率排第6位,病死率排第4位,2018年全球新增肝癌病例约一半在我国[1]。肝癌在我国癌症发病率排第4位,病死率排第2位[2]。目前原发性肝癌的治疗手段主要有手术切除、局部消融、肝动脉化疗栓塞(transcatheter arterial chemoem-bolization,TACE)、放射治疗、化疗、靶向治疗、免疫治疗、中医中药治疗等,每种治疗手段各有其优势和局限,临床中常根据患者个体情况,选择一种或多种治疗手段。原发性肝癌的西医治疗手段因适应证、不良反应、生存质量、治疗费用等影响其治疗效果,中医药作为辅助治疗手段在改善症状、提高免疫力、减毒增效、延缓肿瘤进展、提高生活质量、延长生存期等方面发挥了积极的作用。
以人参皂苷Rg3为主要成分的参一胶囊,在临床配合化疗使用,可提高原发性肝癌的疗效,改善气虚症状,提高免疫功能。近年临床研究[3-11]表明,TACE、手术、化疗联合参一胶囊治疗原发性肝癌,可提高临床疗效、患者生存率,改善患者生存质量,但尚缺乏相应的系统评价为其临床应用提供高级别循证医学证据。本研究对参一胶囊辅助治疗原发性肝癌的临床疗效及安全性进行Meta分析,以期为临床应用提供参考。
1 资料与方法
1.1 数据来源与检索策略
计算机检索中国知识资源总库(CNKI)、中国学术期刊数据库(Wanfang Data)、中国生物医学文献数据库(CBM)、中文科技期刊数据库(VIP)、PubMed、Cochrane Library、Embase、Web of Science,检索时间范围均为建库至2020年12月14日。中文检索词:参一胶囊、人参皂甙Rg3、人参皂苷Rg3、原发性肝癌、肝癌、肝恶性肿瘤;中文检索式以CNKI为例:(人参皂甙Rg3 OR人参皂苷Rg3 OR 参一胶囊)AND(原发性肝癌OR肝癌OR肝恶性肿瘤)。英文检索词:Shenyi Capsule、ginsenoside Rg3、Hepatocellular Carcinoma、Hepatocellular Carcinomas、Liver Cell Carcinomas、Liver Cell Carcinoma、Liver Cancers、Liver Cancer;英文检索式以PubMed为例:(ginsenoside Rg3 OR Shenyi Capsule) AND (Hepatocellular Carcinoma OR Hepatocellular Carcinomas OR Liver Cell Carcinomas OR Liver Cell Carcinoma OR Liver Cancers OR Liver Cancer)。检索日期为2020年12月15日。
1.2 文献筛选标准
纳入标准:⑴研究类型为随机对照试验(RCT);⑵研究对象为经影像学、病理或细胞学明确诊断的原发性肝癌患者[2];⑶干预措施为试验组采用参一胶囊联合西医治疗方法(TACE、手术、化疗),对照组采用西医治疗方法(TACE、手术、化疗);⑷结局指标:近期客观疗效按照实体瘤的疗效评价标准(RECIST)评价,包括客观缓解率(ORR)、疾病控制率(DCR)[12];甲胎蛋白(AFP)下降率、生存率、Karnofsky功能状态(KPS)评分提高率、不良反应发生率(Ⅱ度以上肝脏毒性发生率、恶心呕吐发生率、骨髓抑制发生率)。
排除标准:⑴非RCT;⑵基础实验或综述;⑶非观察参一胶囊治疗肝癌疗效;⑷无结局指标;⑸重复发表文献保留1篇。
1.3 文献筛选与资料提取
由2名研究者独立进行文献检索,再分别查阅文献的标题和摘要,严格按照标准进行初筛,继续查阅全文进行复筛,明确其纳入与否,如有不同意见,再请另外1名研究者做最后决定。提取内容包括:⑴研究的基本信息(第一作者、发表时间);⑵研究对象基线特征;⑶干预措施;⑷治疗时间;⑸结局指标。
1.4 方法学质量评价
由2名研究者对纳入文献的方法学质量进行独立评价并交叉核对结果。偏倚风险评价采用Cochrane系统评价手册5.1.0推荐的RCT偏倚风险评估工具。评价条目:随机分配方法、分配隐藏方案、盲法、结果数据完整性、选择性报告结果及有无其他偏倚。评价结果分为低偏倚风险、偏倚风险不确定及高偏倚风险。如有异议协商解决。
1.5 统计学方法
采用RevMan5.3对数据进行Meta分析。二分类变量采用比值比()及其95%可信区间()表示。检验水准=0.05。各研究间的异质性检验采用卡方检验,以I判断异质性大小。若>0.1、I<50%,为多个同类型的研究具有同质性,用固定效应模型进行Meta分析;若≤0.1、I≥50%,为多个同类型的研究具有异质性,用随机效应模型进行Meta分析。若3项及以上研究检验异质性显著,采用敏感性分析其原因。
2 结果
2.1 文献检索结果
初检检索出相关文献591篇,其中CNKI 150篇、Wanfang Data 208篇、CBM 20篇、VIP 57篇、PubMed 19篇、Embase 24篇、Web of Science 100
篇、Cochrane Library 13篇。排除重复后获得文献370篇,根据题目和摘要排除文献309篇,获得61篇文献全文。阅读全文后确定纳入9篇,其中8篇中文文献,1篇英文文献。文献筛选流程见图1。
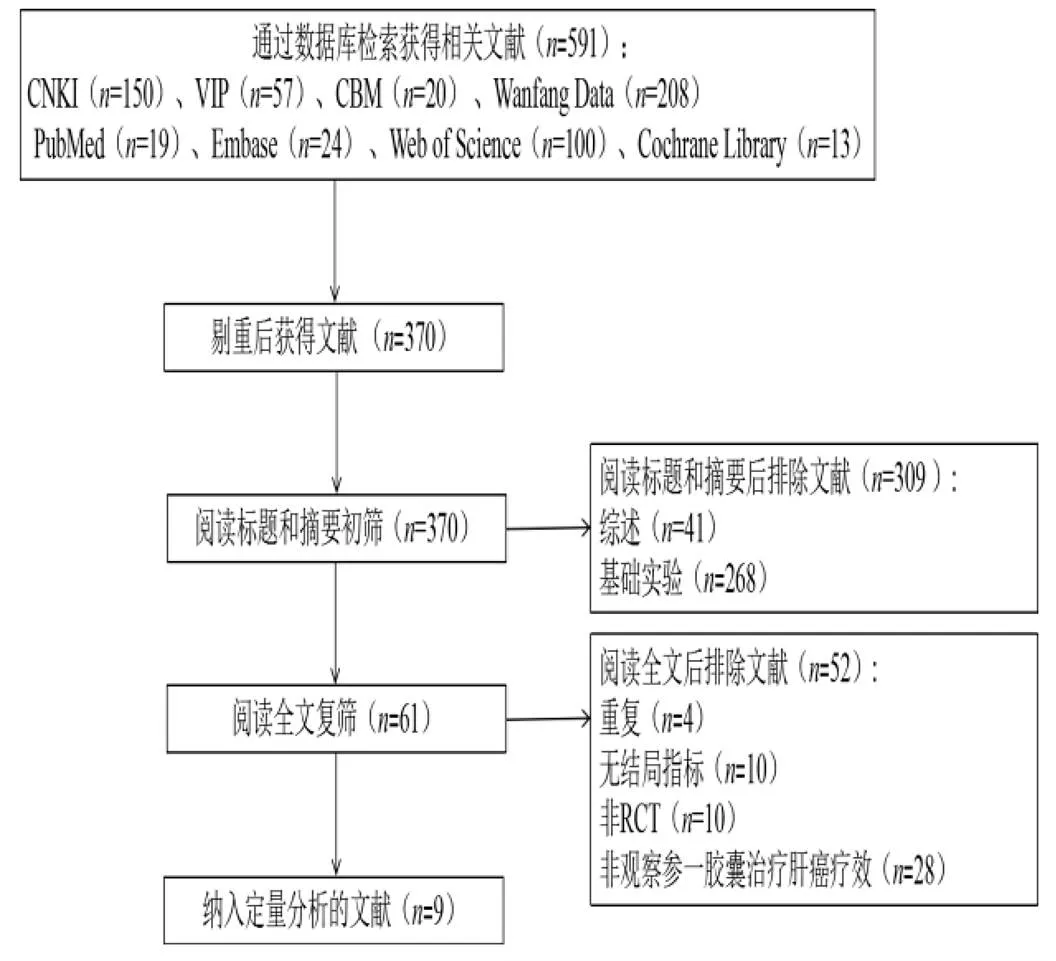
图1 文献筛选流程
2.2 纳入文献基本特征
共纳入9篇文献[3-11]。涉及患者788例,其中试验组433名,对照组355名。文献发表于2007-2019年,病例均来自中国,样本量61~228例。只有文献[6]提及病程,试验组与对照组病程分别为(11.34±2.64)、(12.67±3.49)月。纳入文献基本特征见表1。

表1 纳入文献的基本特征
注:T.试验组;C.对照组;“-”表示未提及;①ORR;②DCR;③AFP下降率;④6个月生存率;⑤1年生存率;⑥2年生存率;⑦KPS评分提高率;⑧Ⅱ度以上肝脏毒性发生率;⑨恶心呕吐发生率;⑩骨髓抑制发生率
2.3 方法学质量评价
2篇[10-11]采用随机数字表法,1篇[6]采用病历号抽签随机,其余文献仅提及随机。1篇[4]采用信封法,但未提及是否密封等,其余文献均未提及分配隐藏方案。所有文献均未提及盲法。1篇[10]结果数据不完整,其余文献结果数据完整。所有研究均不清楚有无选择性报告结果及其他偏倚来源。文献偏倚风险见表2、图2。
2.4 Meta分析结果
2.4.1 客观缓解率 6篇[4,6-7,9-11]报道了ORR。异质性检验显示异质性不显著(=0.66,I=0%)。固定效应模型Meta分析结果示:试验组ORR明显优于对照组(=2.51,95%[1.65,3.83],<0.0001),见图3。

表2 纳入文献方法学质量评价
注:H.高偏倚风险;U.偏倚风险不确定;L.低偏倚风险
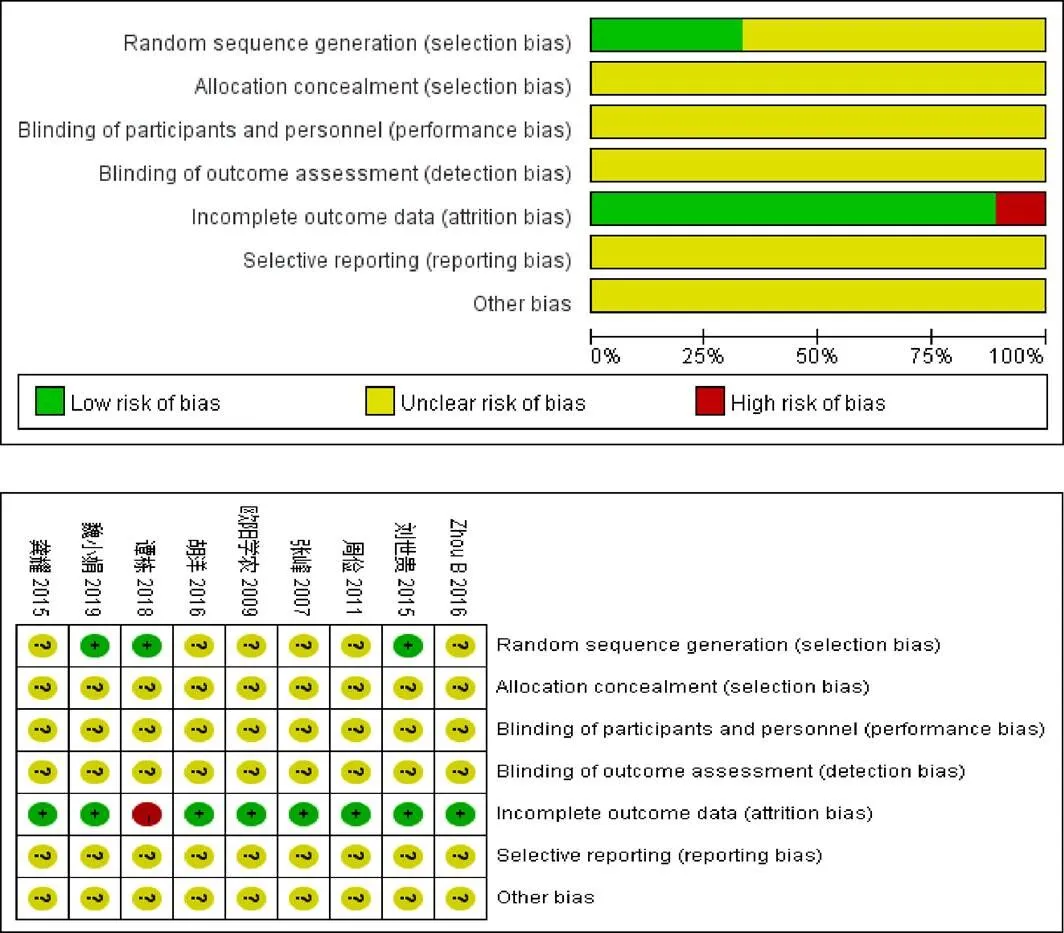
图2 纳入文献偏倚风险评估
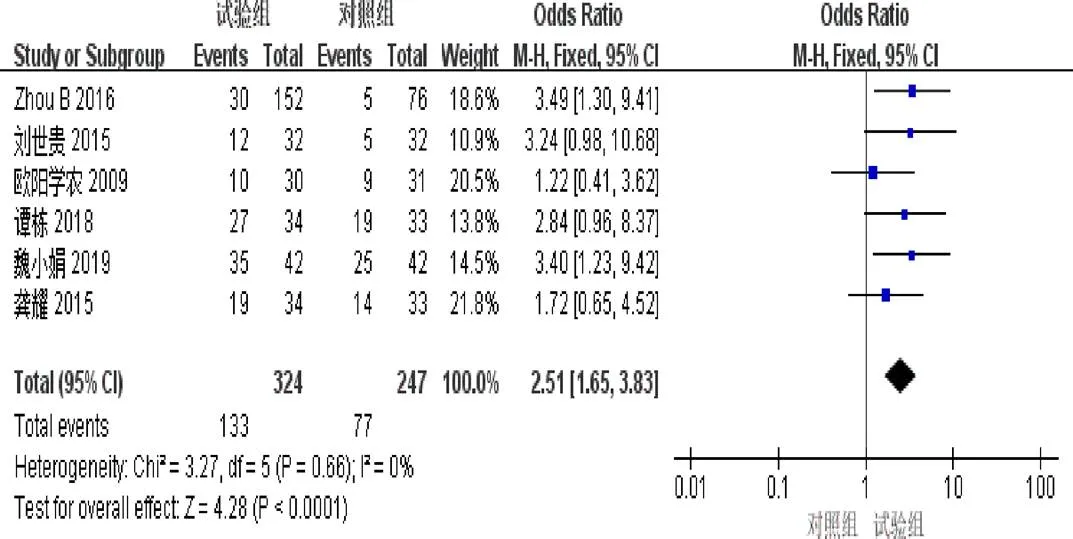
图3 参一胶囊联合西医方法治疗原发性肝癌患者客观缓解率森林图
2.4.2 疾病控制率 6篇[4,6-7,9-11]报道了DCR。异质性检验显示异质性不显著(=0.91,I=0%)。固定效应模型Meta分析结果示:试验组DCR明显优于对照组(=2.76,95%[1.88,4.07],<0.00001),见图4。
2.4.3 甲胎蛋白下降率 2篇[4,7]报道了AFP下降率。异质性检验显示异质性不显著(=0.19,I=42%)。固定效应模型Meta分析结果示:试验组AFP下降率高于对照组(=2.60,95%[1.01,6.69],=0.05),见图5。
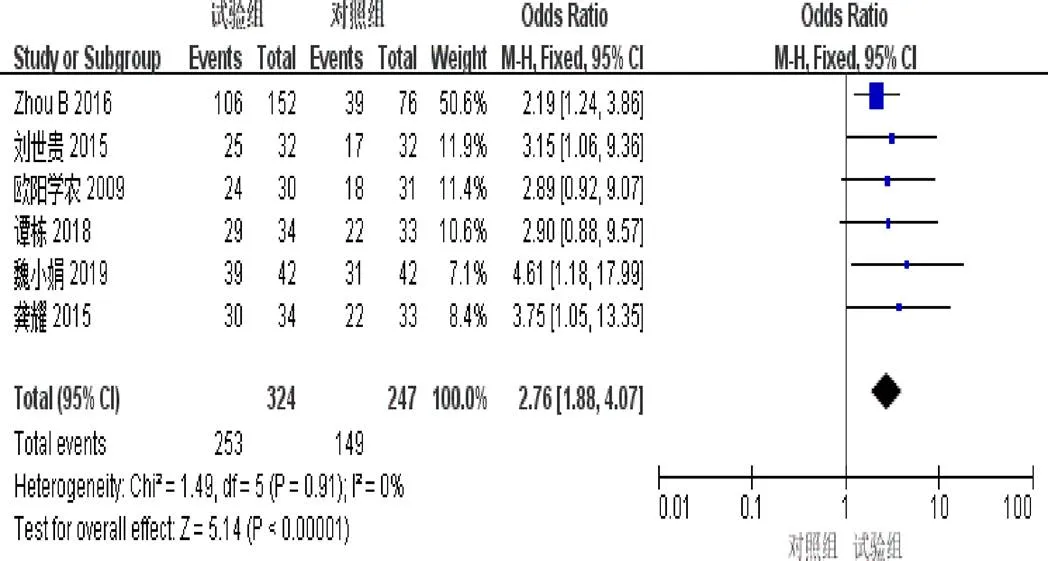
图4 参一胶囊联合西医方法治疗原发性肝癌患者疾病控制率森林图

图5 参一胶囊联合西医方法治疗原发性肝癌患者甲胎蛋白下降率森林图
2.4.4 6个月生存率 3篇[3-4,9]报道了6个月生存率。异质性检验示异质性不显著(=0.94,I=0%)。固定效应模型Meta分析结果示:2组6个月生存率差异无统计学意义(=1.70,95%[0.87,3.35],=0.12),见图6。
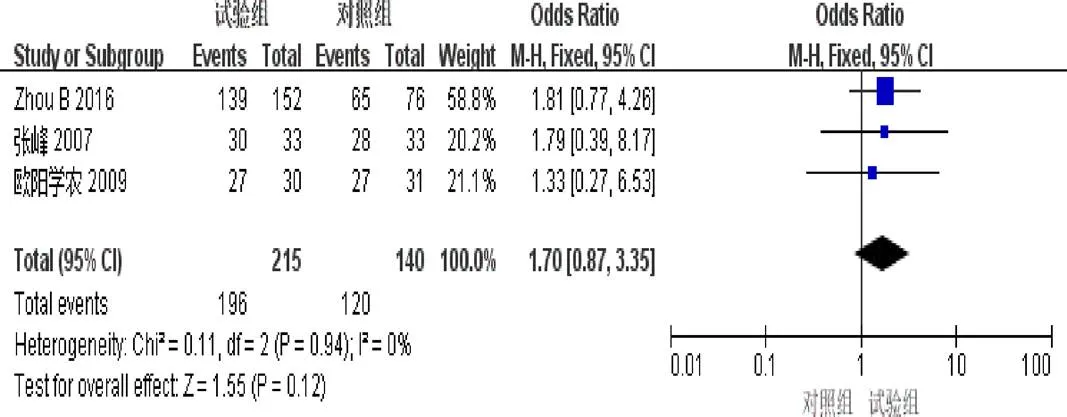
图6 参一胶囊联合西医方法治疗原发性肝癌患者6个月生存率森林图
2.4.5 1年生存率 4篇[3-4,7,9]报道了1年生存率。异质性检验示异质性不显著(=0.67,I=0%)。固定效应模型Meta分析结果示:试验组1年生存率明显优于对照组(=2.34,95%[1.53,3.58],<0.0001),见图7。

图7 参一胶囊联合西医方法治疗原发性肝癌患者1年生存率森林图
2.4.6 2年生存率 3篇[4,7,9]报道了2年生存率。异质性检验示异质性不显著(=0.80,I=0%)。固定效应模型Meta分析结果示:试验组2年生存率明显优于对照组(=2.33,95%[1.28,4.27],=0.006),见图8。
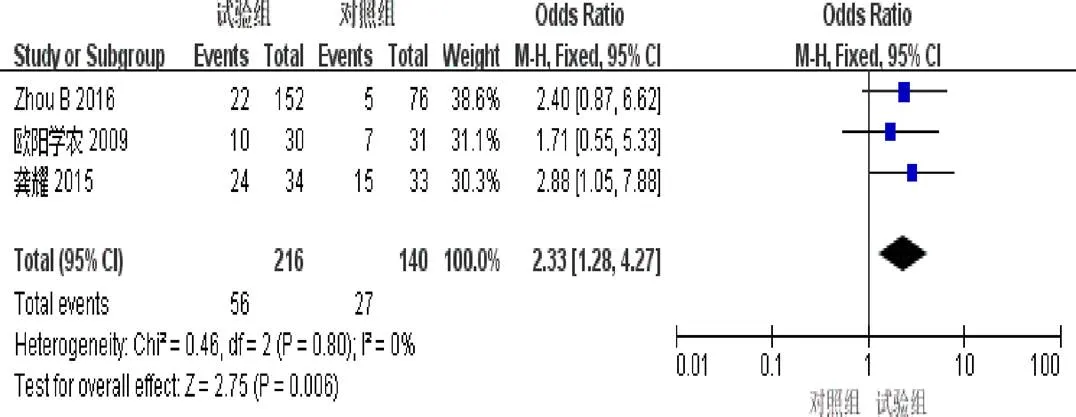
图8 参一胶囊联合西医方法治疗原发性肝癌患者2年生存率森林图
2.4.7 KPS评分提高率 3篇[4-5,8]报道了KPS评分提高率。异质性检验示异质性不显著(=0.93,I=0%)。固定效应模型Meta分析结果示:试验组KPS评分提高率明显优于对照组(=2.91,95%[1.62,5.23],=0.0004),见图9。
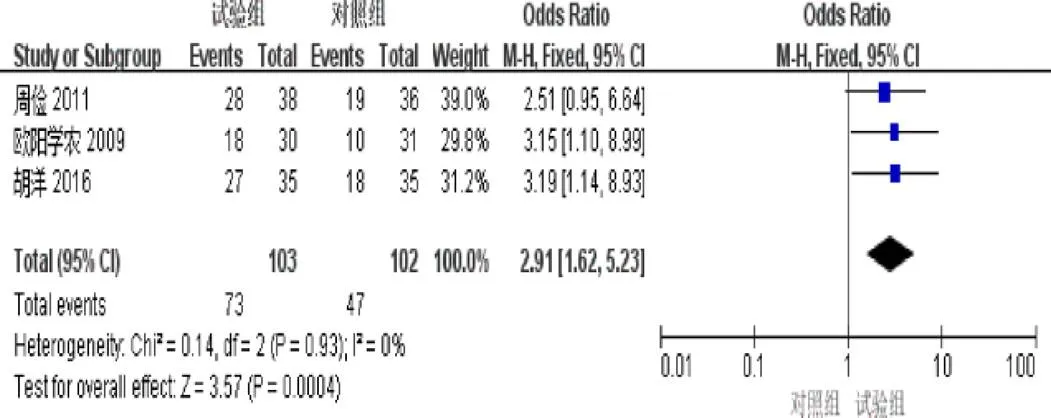
图9 参一胶囊联合西医方法治疗原发性肝癌患者KPS评分提高率森林图
2.4.8 Ⅱ度以上肝脏毒性发生率 2篇[4,11]报道了Ⅱ度以上肝脏毒性发生率。异质性检验示异质性不显著(=0.61,I=0%)。固定效应模型Meta分析结果示:2组Ⅱ度以上肝脏毒性发生率差异无统计学意义(=0.53,95%[0.22,1.28],=0.16),见图10。

图10 参一胶囊联合西医方法治疗原发性肝癌患者Ⅱ度以上肝脏毒性发生率森林图
2.4.9 恶心呕吐发生率 2篇[9,11]报道了恶心呕吐发生率。异质性检验示异质性不显著(=0.46,I=0%)。固定效应模型Meta分析结果示:2组恶心呕吐发生率差异无统计学意义(=0.72,95%[0.42,1.24],=0.24),见图11。
2.4.10 骨髓抑制发生率 4篇[5,7-8,11]报道了骨髓抑制发生率。异质性检验示异质性不显著(=0.67,I=0%)。固定效应模型Meta分析结果示:试验组骨髓抑制发生率明显低于对照组(=0.40,95%[0.23,0.68],=0.0009),见图12。
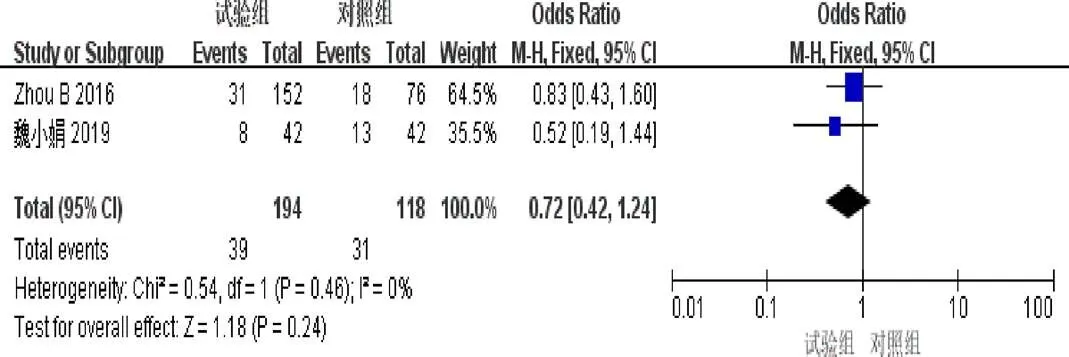
图11 参一胶囊联合西医方法治疗原发性肝癌患者恶心呕吐发生率森林图
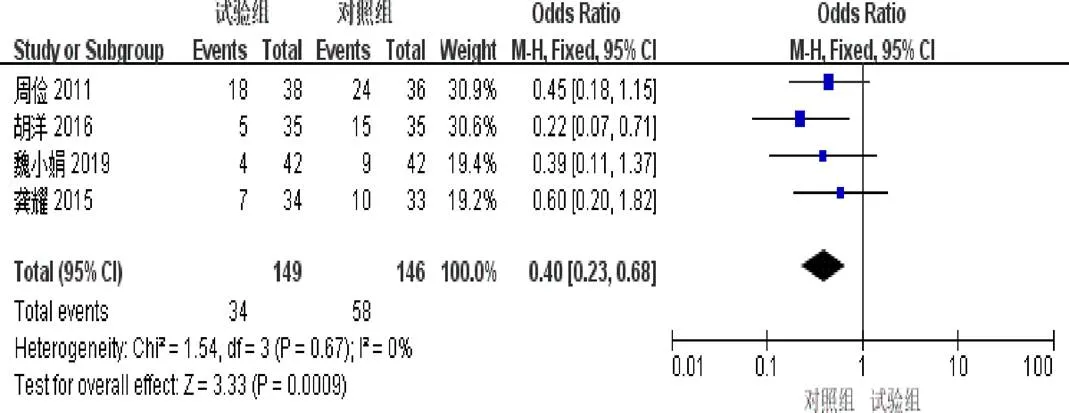
图12 参一胶囊联合西医方法治疗原发性肝癌患者骨髓抑制发生率森林图
3 讨论
原发性肝癌为常见消化系统恶性肿瘤之一,通常起病隐匿,早期无明显症状,大多数患者就诊时已发展到中晚期,错过治疗的最佳时期,导致预后较差,发病率与死亡率之比达到1∶0.9,在北美国家和地区5年生存率为15%~19%,在我国5年生存率仅为12.1%,严重威胁患者生命健康[13-16]。
人参皂苷Rg3是人参中的一种微量四环三萜皂苷,日本著名药学家北川勋首先鉴定了其分子结构,之后的研究又发现其具有选择性抑制肿瘤细胞浸润和转移的药理作用[17]。基础实验研究表明,人参皂苷Rg3可能通过下调岩藻糖基转移酶Ⅳ的表达抑制人肝癌HepG2细胞增殖、迁移、侵袭和上皮间质转化[18];通过抑制肝癌新生微血管及调节免疫,对小鼠肝癌移植瘤产生抑制作用[19];通过下调B淋巴细胞瘤-2(Bcl-2)和上调B淋巴细胞瘤-2相关X蛋白(Bax)表达,以及活化半胱氨酸蛋白酶-3(Caspase-3)诱导人肝癌细胞凋亡[20]。人参皂苷Rg3联合5-氟尿嘧啶可降低肿瘤微血管密度,抑制肝癌血管形成,抑制小鼠肝癌移植瘤的生长[21];通过上调Caspase-3表达水平、下调生存素表达水平,以及下调血管内皮生长因子表达水平,诱导小鼠移植性肝癌细胞凋亡,抑制小鼠移植性肝癌血管形成[22]。人参皂苷Rg3联合奥沙利铂及索拉非尼可加速人肝癌细胞凋亡[23]。临床研究表明,以人参皂苷Rg3为主要成分的参一胶囊联合TACE、手术、化疗治疗原发性肝癌,可提高临床疗效、患者生存率,改善患者生存质量,降低不良反应发生率。
本研究对参一胶囊联合西医治疗原发性肝癌的RCT进行系统评价,结果显示,试验组ORR、DCR显著优于对照组,差异有统计学意义(<0.0001,<0.00001),表明参一胶囊联合西医治疗可提高肝癌的近期临床疗效。AFP作为原发性肝癌特异性肿瘤标志物,可用于早期诊断、判断临床疗效及预后,在AFP下降率方面,Meta分析结果虽然=0.05,但根据=2.60,95%[1.01,6.69],考虑参一胶囊联合西医治疗AFP下降率大于单纯西医治疗但是居于统计学意义的临界附近,需要后续增加样本量进一步分析。在6个月生存率方面,2组6个月生存率差异无统计学意义;但在1年生存率、2年生存率方面,参一胶囊联合西医治疗明显优于单纯西医治疗,差异有统计学意义(<0.0001,=0.006),提示参一胶囊联合西医治疗可提高患者长期生存率。在KPS评分提高率方面,试验组明显优于对照组,差异有统计学意义(=0.0004),表明参一胶囊联合西医治疗可改善患者生存质量。在Ⅱ度以上肝脏毒性发生率、恶心呕吐发生率方面,2组差异无统计学意义;但在骨髓抑制发生率方面,试验组骨髓抑制发生率明显低于对照组,差异有统计学意义(=0.0009),表明参一胶囊联合西医治疗可降低骨髓抑制不良反应发生率,且不增加其他不良反应发生率。
本研究存在一定局限性:⑴纳入的9项研究对于盲法等未提及,大部分研究未描述具体的随机方法;⑵各结局指标所纳入的研究均少于10项,故没有对发表偏倚进行分析;⑶各结局指标所纳入的研究较少,各研究的样本例数少,Meta分析的总样本例数偏少。⑷缺少总生存期(OS)、无进展生存期(PFS)的报道或无可提取的有关OS、PFS的结局指标,无法分析参一胶囊联合西医治疗原发性肝癌的OS、PFS。⑸缺少参一胶囊联合西医靶向治疗、免疫治疗原发性肝癌的临床研究。
综上所述,参一胶囊联合西医方法(TACE、手术、化疗)治疗原发性肝癌可提高临床疗效、生存率,改善患者生存质量,降低骨髓抑制不良反应发生率。但由于纳入研究质量普遍不高,需要更多高质量、多中心、大样本的RCT进一步证实。
[1] Ferlay J,Colombet M,Soerjomataram I,et al. Estimating the global cancer incidence and mortality in 2018: GLOBOCAN sources and methods[J]. International Journal of Cancer, 2019,144(8):1941-1953.
[2] 中华人民共和国国家卫生健康委员会医政医管局.原发性肝癌诊疗规范(2019年版)[J].中国实用外科杂志,2020,40(2):121-138.
[3] 张峰.人参皂甙对肝癌介入前后VEGF、AFPh的影响[J].山东医药,2007,47(13):39-40.
[4] 欧阳学农,余宗阳,杜建.人参皂甙Rg3胶囊联合肝动脉化疗栓塞术治疗中晚期肝癌的临床观察[J].临床肿瘤学杂志,2009,14(2):150-153.
[5] 周俭.肝动脉化疗栓塞术配合参一胶囊治疗原发性肝癌临床观察[J].实用中医药杂志,2011,27(11):762-763.
[6] 刘世贵,李欣.参一胶囊联合肝动脉栓塞治疗中晚期肝癌随机平行对照研究[J].实用中医内科杂志,2015,29(2):98-100.
[7] 龚耀,殷晓娟,刘长龙,等.参一胶囊联合肝动脉栓塞化疗治疗晚期原发性肝癌疗效观察[J].现代医药卫生,2015,31(23):3625-3627.
[8] 胡洋,王晶,李晶红,等.全肝介入化疗加参一胶囊联合治疗中晚期原发性肝癌效果分析[J].黑龙江医药科学,2016,39(2):35-36.
[9] ZHOU B, YAN Z P, LIU R, et al. Prospective study of transcatheter arterial chemoembolization (TACE) with ginsenoside Rg3 versus tace alone for the treatment of patients with advanced hepatocellular carcinoma[J]. Radiology, 2016,280(2):630-639.
[10] 谭栋,何盟国,沈乃营,等.参一胶囊联合腹腔镜解剖性肝段切除术治疗老年原发性肝癌的临床研究[J].中国中西医结合外科杂志,2018,24(1):21-26.
[11] 魏小娟,郭艳,王云溪.参一胶囊联合SOX方案治疗原发性肝癌的临床研究[J].中华中医药学刊,2019,37(11):2758-2761.
[12]丁婕,戴旭,孟宪运,等.实体瘤疗效评价标准的研究进展[J].中国肿瘤临床与康复,2015,22(9):1150-1152.
[13] ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990 - 2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. The Lancet,2019,394(10204):1145-1158.
[14] Allemani C,Weir H K,Carreira H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25 676 887 patients from 279 population-based registries in 67 countries (CONCORD-2)[J]. The Lancet,2015,385(9972):977-1010.
[15] Torre L A, Bray F, Siegel R L, et al. Global cancer statistics, 2012[J]. CA: A Cancer Journal for Clinicians, 2015,65(2):87-108.
[16] CHEN W Q, ZHENG R S, Baade P D, et al. Cancer statistics in China, 2015[J].CA:ACancer Journal for Clinicians,2016,66(2):115-132.
[17] 安宁,朱文.人参皂苷Rg3抗肿瘤作用机制研究进展[J].现代肿瘤医学,2008,16(4):648-652.
[18] 赵永军,李刚刚,孙治安.人参皂苷Rg3对肝细胞癌上皮间质转化的抑制作用机制研究[J].中国临床药理学杂志,2020,36(14):2066-2069.
[19] 方煊,李雅丽,陈新梅.人参皂甙单体Rg3抑制肝癌生长及其作用机制[J].中华中医药杂志,2016,31(9):3749-3751.
[20] 朴丽花,蔡英兰,张默函,等.人参皂甙Rg3在体外对肝癌细胞生长和凋亡的影响[J].中国临床药理学杂志,2012,28(9):659-661.
[21] 陈亚林.人参皂甙Rg3联合5-氟尿嘧啶对肝癌荷瘤小鼠的抑瘤作用[J].中国现代医学杂志,2012,22(19):29-31.
[22] 张金华.人参皂甙Rg3联合5-氟尿嘧啶对小鼠移植性肝癌细胞凋亡、血管形成作用的研究[D].石家庄:河北医科大学,2008.
[23] 张秀红.人参皂甙Rg3联合奥沙利铂、索拉非尼对于肝癌细胞凋亡的影响[J].临床医学研究与实践,2016,1(4):43,48.
Systematic Evaluation of Adjuvant Treatment of Primary Liver Cancer withCapsules
ZHANG Jin-hua1, TIAN Yuan2, YANG Xiao-ping3
(1. Jingmen First People’s Hospital, Jingmen 448000, China; 2. Center for Phenomics of Tradiional Chinese Medicine, Affiliated Hospital of Traditional Chinese Medicine of Southwest Medial University, Luzhou 646000, China; 3. Shanghai Seventh People’s Hospital, Shanghai 200003, China)
To systematically evaluate the efficacy and safety ofCapsules in the adjuvant treatment of primary liver cancer.RCTs ofCapsules combined with Western medicine in the treatment of primary liver cancer in CNKI, Wanfang Data, CBM, VIP, PubMed, Cochrane Library, Embase, and Web of Science were retrieved by computer from the establishment of databases to December 2020. Two investigators independently screened the literature, extracted valid data, and assessed the quality according to the Cochrane risk of bias assessment tool. Meta-analysis was conducted with RevMan 5.3 software.A total of 9 articles were included, involving 788 cases. Meta-analysis showed that compared with Western medicine,Capsules combined with Western medicine could improve the objective remission rate (=2.51, 95%[1.65, 3.83],<0.000 1), disease control rate (=2.76, 95%[1.88, 4.07],<0.000 01), AFP decline rate (=2.60, 95%[1.01, 6.69],=0.05),and 1-year survival rate (=2.34, 95%[1.53, 3.58],<0.000 1), 2-year survival rate (=2.33, 95%[1.28, 4.27],=0.006), the improvement rate of KPS score (=2.91,95%[1.62, 5.23],=0.000 4), and bone marrow suppression rate (=0.40, 95%[0.23, 0.68],=0.000 9).Capsules combined with Western medicine in the treatment of primary liver cancer can improve clinical efficacy, increase survival rate, improve life quality, and reduce bone marrow suppression rate. However, more large-scale, multi-center, and high-quality clinical RCTs are needed for further verification.
Capsules; Ginsenoside Rg3; primary liver cancer; RCTs; Meta-analysis
张金华,田园,杨晓萍.参一胶囊辅助治疗原发性肝癌的系统评价[J].中国中医药图书情报杂志,2022,46(3):7-13.
R273.57
A
2095-5707(2022)03-0007-07
10.3969/j.issn.2095-5707.2022.03.002
张金华,E-mail: okfrom@126.com
(2021-09-27)
(2021-10-20;编辑:魏民)

