无过渡金属条件下,高效、高度实践及环境友好的H2 O2/NaClO促进硫代酰胺转酰胺方法
许 莉,刘 迪,谭晶耀,罗 琼,王 锐,林治华
(重庆理工大学 药学与生物工程学院,重庆 400054)
0 引言
酰胺是一种重要的化学中间体,在肽和蛋白质的合成、材料科学以及化学生物学等领域有着广泛的应用[1-4]。一般来说,传统的酰胺合成包括活性的羧酸衍生物与化学计量的偶联剂进行的缩合反应[5-8]、Beckmann 重排反应[9-11]、Ritter 反应[12]和Ugi 型多组分反应[13-15]。而酰胺构建的非经典方法包括羧酸和胺直接催化形成酰胺。例如,胺作为亲核试剂与卤代芳烃的氨基羰基化反应、过渡金属催化醇和胺之间氧化偶联和C-C 键裂解[16-19]。但这些合成策略大多使用过渡金属,会产生大量危险废弃物,带来一系列的环境问题。因此,开发无过渡金属条件下,环境友好的合成工艺是非常必要的,尤其是痕量金属污染广受制药工业关注形势下。此外,开发以不同原料合成酰胺的多种合成方法是现代有机合成中一个非常重要的课题。
将硫代酰胺转化为氧类似物已成为合成酰胺的一种强有力的替代方法[20-25]。但这些方法目前都存在诸多不足,如使用过渡金属催化剂、反应条件苛刻、产率低、反应时间较长、部分试剂昂贵、使用环境有害的含卤素溶剂以及高沸点溶剂。因此,开发高效、经济,对环境友好的酰胺合成方法对制药领域具有重大意义。
从1963 年Paolo 等发现过氧化氢与次氯酸钠反应产生单线态氧(1O2)以来[26-27],1O2已成为一种非常有价值的试剂,广泛应用于有机合成中,通常以3 种主要途径实现反应:[2+2]环加成,[4+2]环加成和Ene 反应[28]。其中基态的染料敏化激发和通过化学反应产生的多种1O2方法已广为探索,包括过氧化钙[31]、芳烃类过氧化物[32]、亚磷酸盐臭氧化物[33-34]、硅氢三氧化二硅[35]、烷基氢三氧化二硅[36],甚至臭氧的分解[37]。相对而言,以ClO-氧化H2O2产生单线态氧,仍然是极实用、廉价且环境友好的方法,可以避免使用大容量的光反应器,避免光反应引起的环境污染和安全问题[38]。
意识到H2O2/NaClO 反应中单线态氧的潜力,本课题组尝试通过此法打破硫代酰胺转化为酰胺的一些局限,经过系列筛选及研究,开发出一种简便、绿色的酰胺合成途径:室温条件下,以乙醇为溶剂,无过渡金属条件下反应,得到几乎当量的酰胺类化合物,大多数酰胺类化合物经过简单过滤、离心、洗涤即可得到,无需进一步纯化。以硫代酰胺合成酰胺的方法见图1。
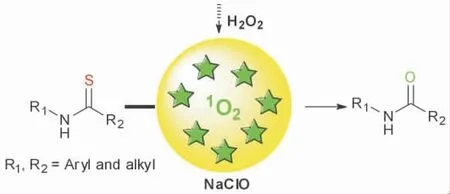
图1 H2O2/NaClO 催化硫代酰胺转酰胺
1 结果与讨论
1.1 反应条件的优化
为了优化反应条件,考察了氧化剂、引发剂、温度及溶剂等条件变化对反应的影响,相应的结果如表1 所示。以易得的N-苯基苯并硫酰胺1(其衍生物可从芳香族乙酸或肉桂酸、胺和单质硫三组分反应获得[39])作为模型反应物。首先,在无引发剂参与,氧气条件下不反应,(表1,序号1)。早期报道中通过增加钨灯的功率,可直接激发氧气产生单线态氧,原位转化硫代酮到相应酮,但该法对N-苯基硫酰胺类底物无效(表1,序号2);以36W LED 蓝光照射,或者加入光敏试剂,亦只有痕量反应(表1,序号3-4)。以化学方法H2O2/NaClO 原位产生的单线态氧可高效促进此类反应,尤其值得关注的是,反应在室温,3 min 内快速完成,近乎当量获得相应酰胺产物2,无任何副产物形成(表1,序号5)。进一步优化表明,H2O2量可降至10 当量(表1,序号6);进一步降低H2O2或NaClO 量将使反应收率降低(表1,序号7-8)。水作为溶剂,具有成本低、安全环保等优点。然而,原料硫代酰胺在水中溶解度较低,导致反应收率低于5%(表1,序号9),升高温度至60℃,反应收率仍然低于20%(表1,序号10)。显然,反应最佳溶剂为乙醇。
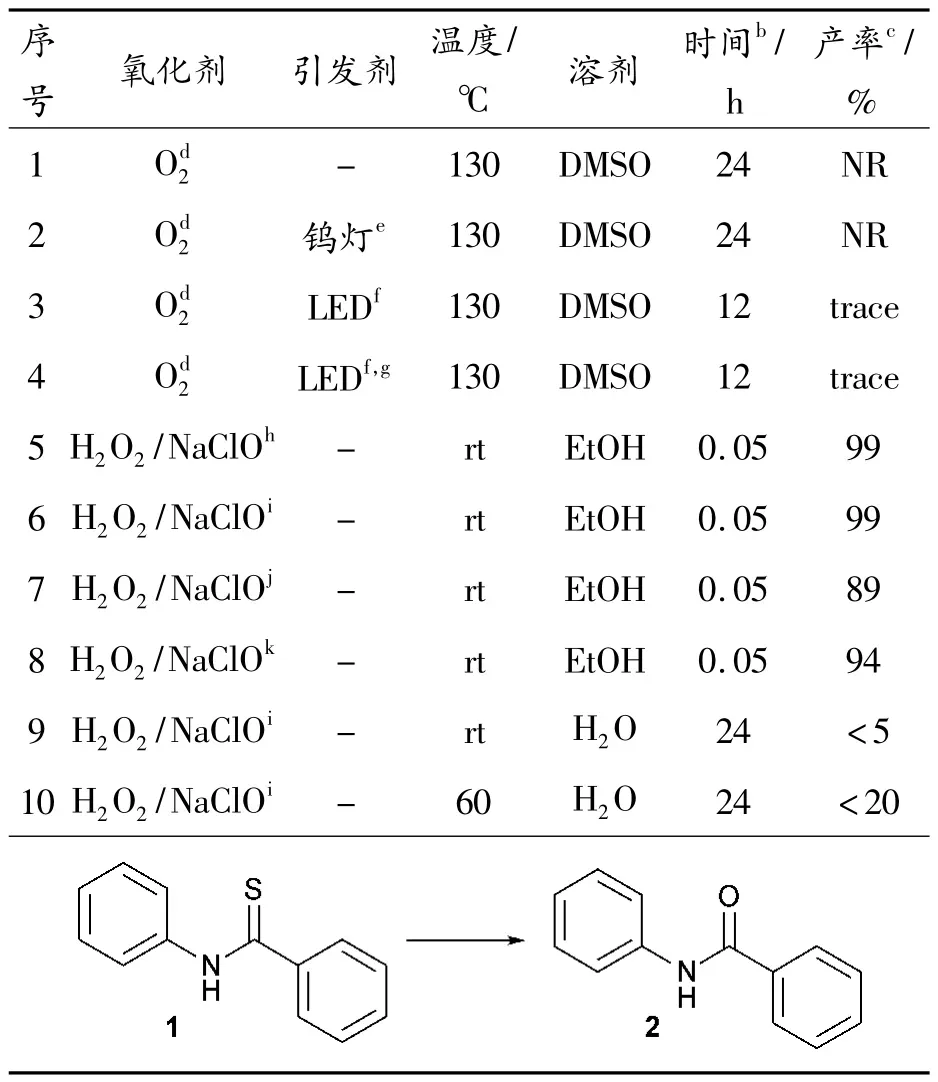
表1 反应条件的优化a
反应后处理过程可彰显其绿色及实践性。反应完成后,在反应混合物中加入15 mL 冰水,静置半小时,过滤,固体用冰水洗涤,真空干燥,酰胺收率高达99%。与其他文献报道的方法相比,该方法的后处理不需要使用有机溶剂,同时也避免了繁琐的柱层析及使用大量有机溶剂。
1.2 底物范围研究
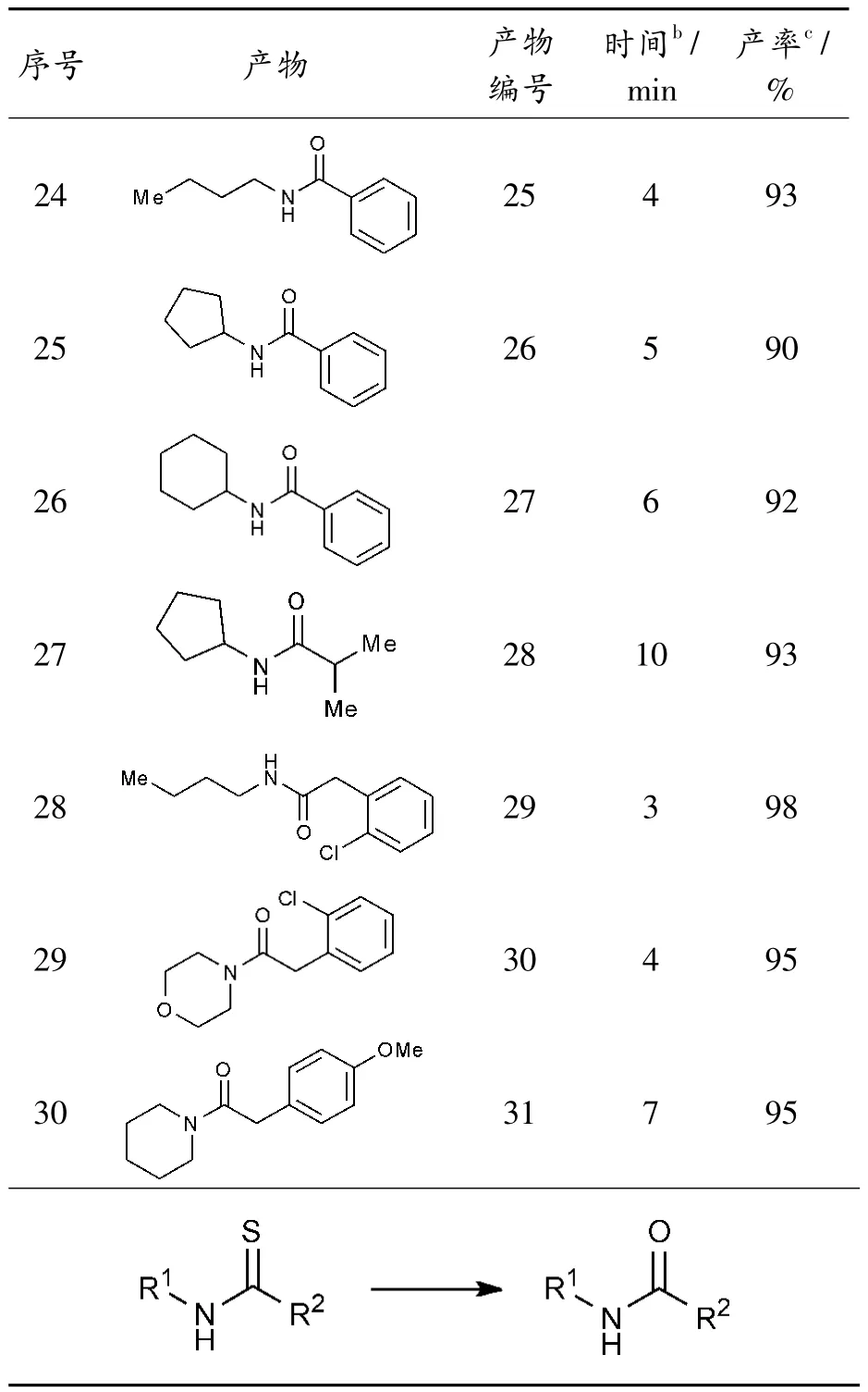
在优化反应条件下(10 当量H2O2/NaClO,溶剂乙醇,室温),研究了底物范围及官能团的兼容性。几乎在所有情况下,供电子基团和吸电子基团均能兼容,其中所有原料在10 min 内都能高效转化得到相应的酰胺(表2)。
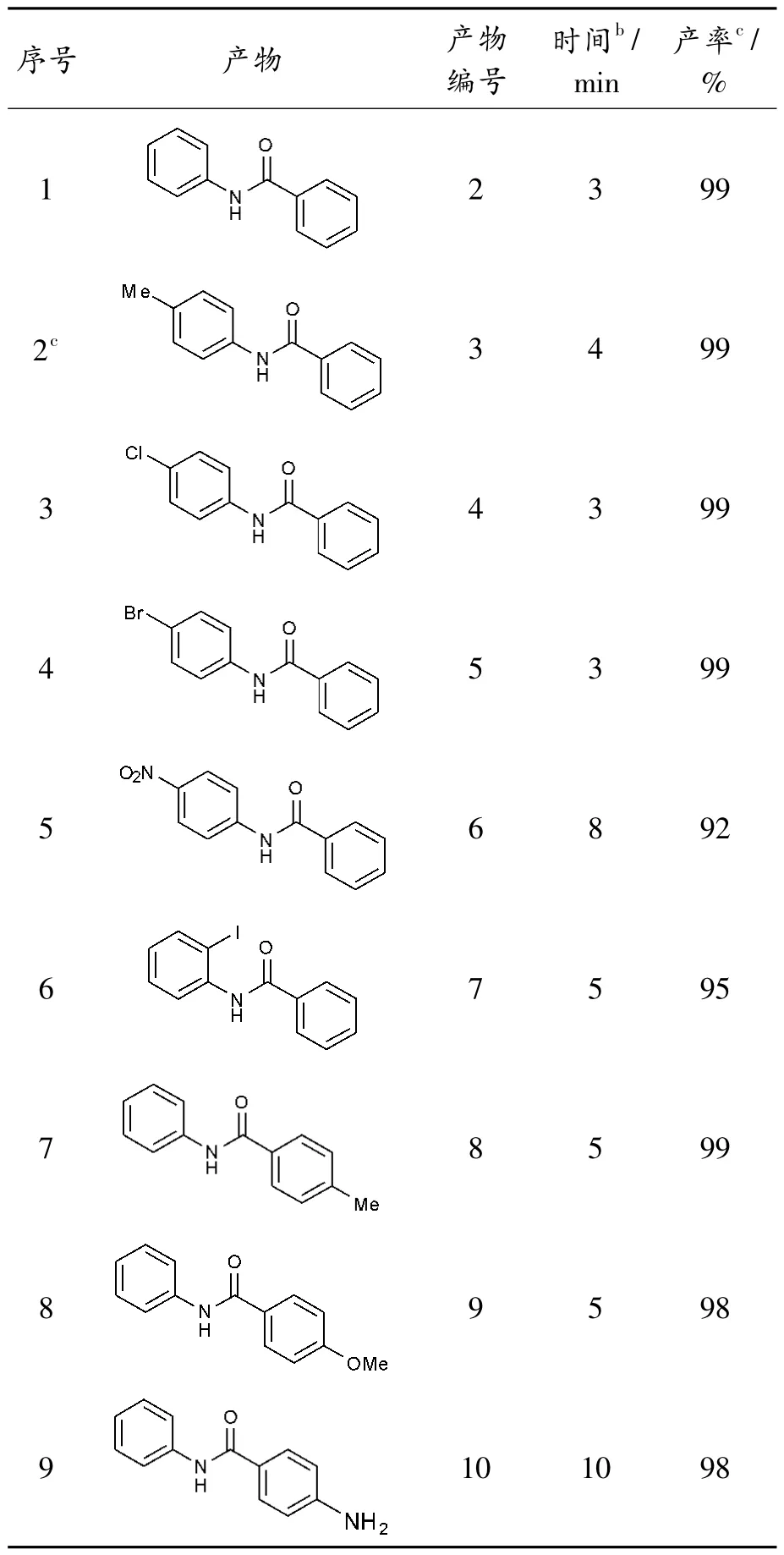
表2 底物范围研究a
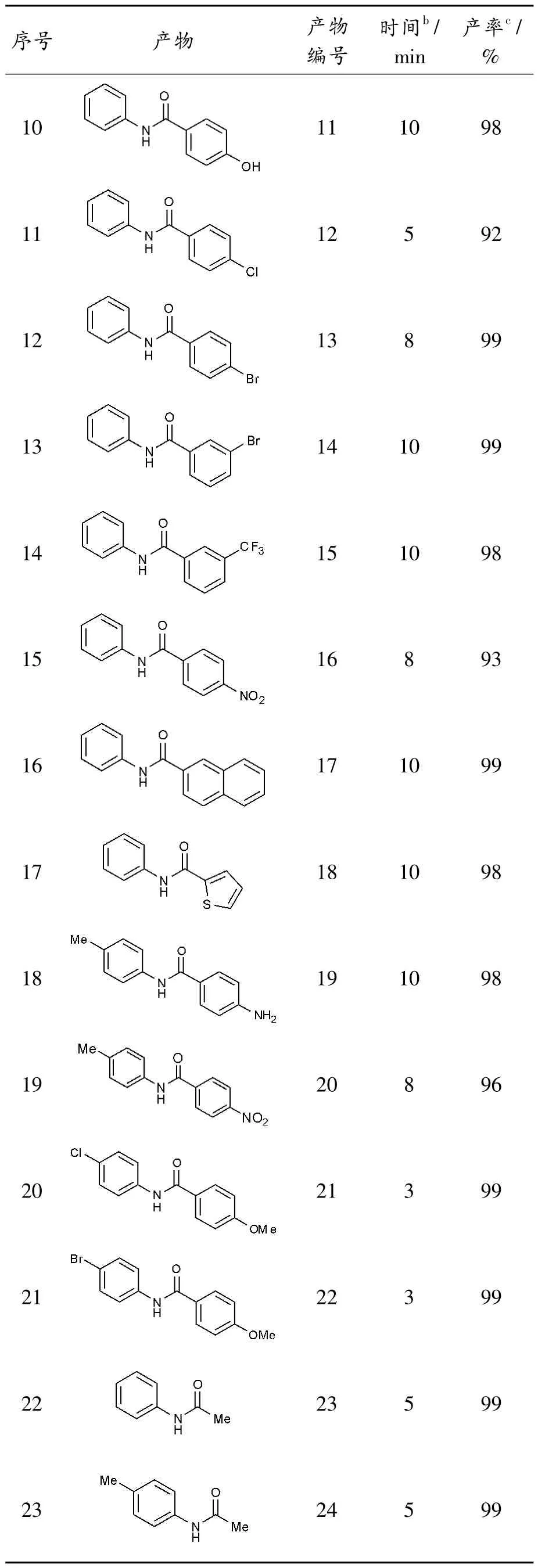
续表2
续表2
各种供电子取代基(甲基、甲氧基、羟基和氨基)、吸电子取代基(硝基、三氟甲基、氯、溴和碘)均能兼容,而且产率均在90%以上(表2,序号1-30);这些取代基可位于苯基上的间位、对位和邻位,其位置对产率影响较小。同时,胺基部分邻位取代基的空间位阻会影响反应的进行,但其影响并不显著,仍然可以高效地得到相应的酰胺(表2,序号6)。值得注意的是,底物的C-Br、C-Cl 和C-I 键在反应过程中保持完整,为产物的下一步功能化提供了可能(表2,序号3-4、6、11-13、20-21)。当R1为萘和噻吩时,反应收率分别为99%和98%(表2,序号16、17)。当R1和R2苯环上有2 种不同取代基时,底物也能很好兼容,高效反应得到相应的产物19-22(表2,序号18-21)。
同时,该方法可推广到脂肪族酰胺和N-烷基酰胺的制备。在本研究中,烷基R1或/和R2(包括环状R1和线性R1)都是转化过程中合适的反应底物,可高收率获得相应酰胺(表2,序号22-30)。然而,在相同的条件下,烷基R1和芳基R2的结果不如芳基R1和烷基R2理想(表2,如序号22-23 和24-26),相对较低产率获得目标产物。此外,该方法表现出良好的官能团兼容性,如表2所示,酚羟基和氨基均可耐受,未检测到相应的氧化产物(序号9-10)。
1.3 克级制备
为了探究该反应是否适合进一步放大,在标准反应条件下,以10.0 mmol 的规模进行反应,得到2.695 g 的产物14,产率达到98%。这说明该方法具备工业化的应用前景。
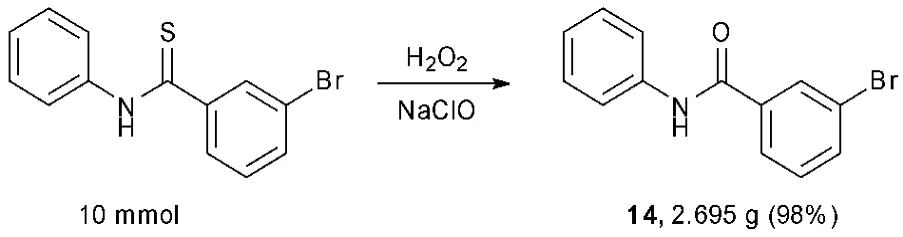
图2 H2O2/NaClO 催化硫代酰胺向酰胺的克级转化

图3 硫代酰胺转化为酰胺的现象
1.4 建议的反应机理
可能的反应机理如图4 所示,该机理类似于先前报道提出的机制:起初,单线态氧氧化基态硫代酰胺生成两性离子/双自由基[40]。随后自由基环化,伴随着SO 的释放,通过逐步反应机制高效得到相应的酰胺。目前,正在进一步探究更详细的反应机理。

图4 H2O2/NaClO 催化硫代酰胺转化为酰胺的推测机理
2 实验部分
2.1 仪器与试剂
实验中所用原料购自Adamas、Acros、TCI 购买,未经进一步纯化。1H NMR 和13C NMR 均由Bruker-400 型核磁共振仪测定,TMS(tetramethylsilane)为内标。高分辨质谱以Bruker Daltonics Bio-TOF-Q 型质谱仪测定,ESI 源(electron spray ionization)。采用薄层色谱法(薄层硅胶60 F254,玻璃板)监测所有反应。以黄海硅胶(50~75 μm)为固定相进行柱层析纯化。
2.2 酰胺的合成
在室温下将硫代酰胺(0.5 mmol)溶解于EtOH(4 mL)中,将其加入用气球密封的反应系统(注意:对于不溶性底物,可加入更多乙醇或少量DMSO 以提高溶解性)。随后加入H2O2(30%水溶液,5 mmol/0.51 mL)搅拌,通过恒压滴液漏斗在3~10 min 内缓慢滴加3.1 mL(12%有效氯,5 mmol)的NaClO。利用薄层色谱(TLC)监控整个反应进程,反应完成后,加入15mL 冰水进行淬灭,继续搅拌1 h,然后将其过滤,沉淀析出固体,并用2 mL 冰水洗涤,在真空下进行干燥。如需要,可进一步通过硅胶柱层析纯化,以得到所需纯品。
N-苯基苯甲酰胺(化合物2):产率99%,白色固体,Mp:160~161 ℃;1H NMR (DMSO-d6,400 MHz):δ=10.29 (s,1H),7.98 (d,J=7.6 Hz,2H),7.82 (d,J=8.0 Hz,2H),7.59-7.52 (m,3H),7.35 (t,J=7.6 Hz,2H),7.10 (t,J=7.2 Hz,1H);13C NMR (DMSO-d6,100 MHz):δ=165.6,139.2,135.0,131.5,128.6,128.3,127.6,123.7,120.4.HRMS (high resolution mass spectrum)calc.for C13H12NO[M+H]+198.0919;found 198.0916。
N-(4-甲苯基)苯甲酰胺(化合物3):产率99%,白色固体,Mp:157 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.19 (s,1H),7.97 (d,J=7.2 Hz,2H),7.68 (d,J=8.4 Hz,2H),7.61-7.53(m,3H),7.17 (d,J=8.0 Hz,2H),2.31(s,3H);13C NMR (DMSO-d6,100 MHz):δ=170.6,141.9,140.3,137.8,136.6,134.2,133.6,132.8,125.6,25.7.HRMS calc.for C14H14NO[M+H]+212.1075;found 212.1071。
N-(4-氯苯基)苯甲酰胺(化合物4):产率99%,白色固体,Mp:197 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.41 (s,1H),7.97 (d,J=7.2 Hz,2H),7.85 (d,J=8.8 Hz,2H),7.63-7.54(m,3H),7.42 (d,J=8.0 Hz,2H);13C NMR(DMSO-d6,100 MHz):δ=170.9,143.4,139.9,136.9,133.7,133.6,132.9,132.5,127.1.HRMS calc.for C13H11ClNO[M+H]+232.0529;found 232.0532。
N-(4-溴苯基)苯甲酰胺(化合物5):产率99%,浅白色固体,Mp:199.0~201 ℃;1H NMR(DMSO-d6,400 MHz):δ=10.39 (s,1H),7.97(d,J=7.2 Hz,2H),7.80 (d,J=8.8 Hz,2H),7.64-7.54 (m,5H);13C NMR (DMSO-d6,100 MHz):δ=170.9,143.8,139.9,136.9,136.6,133.6,132.9,127.4,120.5.HRMS calc.for C13H11BrNO[M+H]+276.0024;found 276.0027。
N-(4-硝基苯基)苯甲酰胺(化合物6):产率92%,白色固体,Mp:197~199 ℃;1H NMR(CDCl3,400 MHz):δ=8.29 (d,J=8.8 Hz,2H),8.10 (s,1H),7.90 (d,J=7.6 Hz,2H),7.87 (d,J=8.8 Hz,2H),7.64 (t,J=7.6 Hz,1H),7.56(t,J=7.6 Hz,2H);13C NMR (CDCl3,100 MHz):δ=165.80,143.75,134.01,132.66,129.07,127.13,125.20,119.43.HRMS calc.for C13H11N2O3[M+H]+243.0769;found 243.0765。
N-(2-碘苯基)苯甲酰胺(化合物7):产率95%,白色固体,Mp:133 ℃;1H NMR (DMSO-d6,400 MHz):δ=10.02 (s,1H),8.00 (d,J=7.2 Hz,2H),7.93 (d,J=7.6 Hz,1H),7.63-7.43(m,5H),7.05 (m,1H);13C NMR (DMSO-d6,100 MHz):δ=165.2,139.8,138.8,134.2,131.8,128.8,128.5,128.2,127.6,98.7.HRMS calc.for C13H11INO[M+H]+323.9885;found 323.9879。
4-甲基-N-苯基苯甲酰胺(化合物8):产率99%,白色固体,Mp:140~142 ℃;1H NMR(CDCl3,400 MHz):δ=8.00 (s,1H),7.79 (d,J=8.0 Hz,2H),7.68 (d,J=7.6 Hz,2H),7.39 (t,J=8.4 Hz,2H),7.28 (d,J=8.0 Hz,2H),7.18-7.14 (m,1H),2.43 (s,3H).13C NMR (CDCl3,100 MHz):δ=165.92,142.29,138.11,132.10,129.37,129.01,127.12,124.41,120.35,21.50.HRMS calc.for C14H14NO[M+H]+212.1075;found 212.1071。
4-甲氧基-N-苯基苯甲酰胺(化合物9):产率98%,白色固体,Mp:132 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.10 (s,1H),7.93 (d,J=8.8 Hz,2H),7.72 (d,J=8.0 Hz,2H),7.32 (t,J=7.6 Hz,2H),7.11-7.04 (m,3H),3.82 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=164.9,161.9,139.2,129.5,128.5,126.9,123.4,120.4,113.6,55.4.HRMS calc.for C14H14NO2[M+H]+228.1025;found 228.1028。
4-氨基-N-苯基苯甲酰胺(化合物10):产率98%,白色固体,Mp:134~135 ℃.1H NMR (DMSO-d6,400 MHz):δ=9.75 (s,1H),7.76-7.70(m,4H),7.32-7.28 (m,2H),7.05-7.02(m,1H),6.62 (d,J=8.4 Hz,2H),5.75 (s,2H).13C NMR (101 MHz,DMSO-d6):δ=165.76,152.60,140.25,129.82,128.91,123.34,121.58,120.58,113.01.HRMS calc.for C13H13N2O[M +H]+213.1028;found 213.1034。
4-羟基-N-苯基苯甲酰胺(化合物11):产率98%,黄色固体,Mp:212 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.12 (s,1H),10.0 (s,1H),7.87(d,J=7.6 Hz,2H),7.77 (d,J=8.0 Hz,2H),7.35 (t,J=7.6 Hz,2H),7.09 (t,J=7.2 Hz,1H),6.88 (d,J=7.6 Hz,2H).13C NMR (101 MHz,CDCl3):δ=165.58,160.99,139.92,130.18,128.99,125.88,123.74,120.73,115.36.HRMS calc.for C13H12NO2[M+H]+214.0868;found 214.0863。
4-氯-N-苯基苯甲酰胺(化合物12):产率92%,白色固体,Mp:201~202 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.32 (s,1H),8.01 (d,J=8.4Hz,2H),7.77 (d,J=8.4 Hz,2H),7.62 (d,J=8.8 Hz,2H),7.38 (t,J=7.6 Hz,2H),7.14(t,J=7.2 Hz,1H).13C NMR (DMSO-d6,100 MHz):δ=164.89,139.43,136.85,134.12,130.08,129.09,128.91,124.29,120.89.HRMS calc.for C13H11ClNO[M+H]+232.0529;found 232.0531。
4-溴-N-苯基苯甲酰胺(化合物13):产率99%,白色固体,Mp:200~202 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.32 (s,1H),7.93 (d,J=8.8 Hz,2H),7.79-7.74 (m,4H),7.38 (t,J=7.2 Hz,2H),7.14 (t,J=7.2 Hz,1H).13C NMR (DMSO-d6,100 MHz):δ=165.01,139.41,134.48,131.85,130.26,129.09,125.77,124.30,120.89.HRMS calc.for C13H11BrNO[M+H]+276.0023;found 276.0032。
3-溴-N-苯基苯甲酰胺(化合物14):产率99%,白色固体,Mp:142~143 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.36 (s,1H),8.15 (s,1H),7.97 (d,J=7.6 Hz,1H),7.81-7.76 (m,3H),7.53 (t,J=8.0 Hz,1H),7.39 (t,J=8.0 Hz,2H),7.14 (t,J=7.6 Hz,1H).13C NMR(DMSO-d6,100 MHz):δ=164.43,139.34,137.57,134.75,131.12,130.71,129.12,127.33,124.39,122.15,120.91.HRMS calc.for C13H11Br-NO[M+H]+276.0024;found 276.0017。
N-苯基-3-(三氟甲基)苯基苯甲酰胺(化合物15):产率98%,白色固体,Mp:150~152 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.48 (s,1H),8.30-8.27 (m,2H),7.98 (d,J=7.6 Hz,1H),7.81-7.78 (m,3H),7.40 (t,J=7.6 Hz,2H),7.14 (t,J=7.2 Hz,1H).13C NMR (DMSOd6,100 MHz):δ=164.50,139.26,136.28,132.29,130.18,129.14,128.60,128.56,124.73,124.69,124.50,121.02.HRMS calc.for C14H11F3NO[M+H]+266.0793;found 266.0788。
4-硝基-N-苯基苯甲酰胺(化合物16):产率94%,白色固体,Mp:204~205 ℃.1H NMR(DMSO-d6,400 MHz):δ=10.56 (s,1H),8.36(d,J=8.8 Hz,2H),8.18 (d,J=8.8 Hz,2H),7.77 (d,J=7.6 Hz,2H),7.36 (t,J=7.6 Hz,2H),7.13 (t,J=7.2 Hz,1H).13C NMR (DMSOd6,100 MHz):δ=163.9,149.1,140.6,138.7,129.2,128.7,124.2,123.5,120.5.HRMS calc.for C13H11N2O3[M+H]+243.0770;found 243.07695。
N-苯基-2-萘酰胺(化合物17):产率99%,白色固体,Mp:167~169 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.50 (s,1H),8.62 (s,1H),8.11-8.01 (m,4H),7.87 (d,J=8.0 Hz,2H),7.67-7.61(m,2H),7.40 (t,J=7.2 Hz,2H),7.15 (t,J=7.2 Hz,1H),13C NMR (DMSO-d6,100 MHz):δ=166.07,139.74,134.74,132.73,132.56,129.43,129.10,128.48,128.46,128.28,128.14,127.31,124.97,124.14,120.87.HRMS calc.for C17H14NO[M+H]+248.1075;found 248.1083。
N-苯基-2-酰胺噻吩(化合物18):产率98%,白色固体,Mp:136~137 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.23 (s,1H),8.04 (d,J=3.6 Hz,1H),7.87 (d,J=4.8 Hz,1H),7.74 (d,J=8.0 Hz,2H),7.38 (t,J=7.6 Hz,2H),7.24 (t,J=4.0 Hz,1H),7.13 (t,J=7.2 Hz,1H).13C NMR (DMSO-d6,100 MHz):δ=164.50,139.26,136.28,132.29,130.18,129.14,128.60,128.56,124.73,124.69,124.50,121.02.HRMS calc.for C11H10NOS[M+H]+204.0483;found 204.0477。
4-氨基-N-(4-甲苯基)苯甲酰胺(化合物19):产率98%,白色固体,Mp:165~166 ℃.1H NMR(DMSO-d6,400 MHz):δ=9.67 (s,1H),7.72 (d,J=8.8 Hz,2H),7.63 (d,J=8.4 Hz,2H),7.12(d,J=8.4 Hz,2H),6.61 (d,J=8.8 Hz,2H),5.72 (s,2H),2.26 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=13C NMR (101 MHz,DMSO),δ=165.59,152.49,137.69,132.20,129.73,129.31,121.69,120.63,113.01,20.93.HRMS calc.for C14H15N2O[M+H]+227.1184;found 227.1178。
4-硝基-N-(4-甲苯基)苯甲酰胺(化合物20):产率98%,白色固体,Mp:199~200 ℃.1H NMR(DMSO-d6,400 MHz):δ=10.49 (s,1H),8.35(d,J=8.8 Hz,2H),8.17 (d,J=8.8 Hz,2H),7.66 (d,J=8.4 Hz,2H),7.17 (d,J=8.4 Hz,2H),2.30 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=163.58,149.03,140.64,136.16,133.16,129.10,129.04,123.45,120.46,20.46.HRMS calc.for C14H13N2O3[M+H]+257.0926;found 257.0923。
N-(4-氯苯基)-4-甲氧基苯甲酰胺(化合物21):产率99%,白色固体,Mp:168~169 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.21 (s,1H),7.95 (d,J=8.8 Hz,2H),7.81 (d,J=8.8 Hz,2H),7.39 (d,J=8.8 Hz,2H),7.06 (d,J=8.8 Hz,2H),3.85 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=164.95,162.0,138.3,129.6,128.4,127.0,126.7,121.8,113.6,55.4.HRMS calc.for C14H13ClNO2[M+H]+262.0635;found 262.0639。
N-(4-溴苯基)-4-甲氧基苯甲酰胺(化合物22):产率99%,浅黄色固体,Mp:206~208 ℃.1H NMR (DMSO-d6,400 MHz):δ=10.21 (s,1H),7.97 (m,2H),7.78 (m,2H),7.54 (m,2H),7.08 (d,J=8.8 Hz,2H),3.84 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=165.45,162.48,139.23,131.82,130.11,127.14,122.63,115.51,114.10,55.91.HRMS calc.for C14H13BrNO2[M+H]+:306.0129;found 306.0134。
N-苯基乙酰胺(化合物23):产率99%,白色固体,Mp:114~115 ℃.1H NMR (DMSO-d6,400 MHz):δ=9.92 (s,1H),7.58 (d,J=7.2 Hz,2H),7.27 (t,J=7.6 Hz,2H),7.00 (t,J=7.6 Hz,1H),2.05 (s,3H).13C NMR (DMSO-d6,100 MHz):δ=168.2,139.3,128.6,122.9,119.0,24.0.HRMS calc.for C8H10NO[M+H]+136.0762;found 136.0767。
N-(4-甲苯基)乙酰胺(化合物24):产率99%,白色固体,Mp:149~150 ℃.1H NMR(CDCl3,400 MHz):δ=7.39 (s,1H),7.36 (s,2H),7.12 (d,J=7.6 Hz,2H),2.31 (s,3H),2.15 (s,3H).13C NMR (CDCl3,100 MHz):δ=168.33,135.30,133.98,129.48,120.07,24.51,20.86.HRMS calc.for C9H12NO[M+H]+150.0918;found150.0918。
正丁基苯甲酰胺(化合物25):产率93%,白色固体,Mp:40~41 ℃.1H NMR (CDCl3,400 MHz):δ=7.76 (d,J=7.6 Hz,2H),7.49-7.45(m,1H),7.42 (t,J=7.2 Hz,2H),6.33 (s,1H),3.46 (dd,J=6.8,13.2 Hz,2H),1.62-1.55 (m,2H),1.44-1.35 (m,2H),0.96 (t,J=7.2 Hz,3H).13C NMR (CDCl3,100 MHz):δ=167.61,134.85,131.28,128.51,126.86,39.83,31.73,20.17,13.79.HRMS calc.for C11H16NO[M +H]+178.1232;found 178.1236。
N-环戊基苯甲酰胺(化合物26):产率90%,浅黄色固体,Mp:159~160 ℃.1H NMR (DMSOd6,400 MHz):δ=8.25 (d,J=6.8 Hz,1H),7.82(d,J=7.2 Hz,2H),7.52-7.42 (m,3H),4.22(m,1H),2.51-1.53 (m,8H).13C NMR (DMSOd6,100 MHz):δ=165.9,134.8,130.9,128.1,127.2,50.9,32.1,23.6.HRMS calc.for C12H16NO[M+H]+190.1232;found 190.1236。
N-环己基苯甲酰胺(化合物27):产率92%,白色固体,Mp:151~153 ℃.1H NMR (CDCl3,400 MHz):δ=7.76 (d,J=7.6 Hz,2H),7.49-7.46(m,1H),7.43 (t,J=7.2 Hz,2H),6.07 (s,1H),4.01-3.94 (m,1H),2.04-1.18 (m,10H).13C NMR (CDCl3,100 MHz):δ=166.65,135.12,131.22,128.49,126.85,48.69,33.23,25.58,24.93.HRMS calc.for C13H18NO[M+H]+204.138 8;found 204.138 6。
N-环戊基异丁酰胺(化合物28):产率93%,浅黄色固体,Mp:79 ℃.1H NMR (CDCl3,400 MHz):δ=5.54 (br,1H),4.16(m,1H),2.28 (m,1H),2.00-1.32 (m,8H),1.13 (d,J=6.8 Hz,6H).13C NMR (CDCl3,100 MHz):δ=176.7,51.0,35.6,33.2,29.7,23.8,19.6,19.0.HRMS calc.for C9H18NO[M+H]+156.1388;found 156.1391。
正丁基-2-(2-氯苯基)乙酰胺(化合物29):产率98%,浅黄色固体,Mp:77~79 ℃.1H NMR(CDCl3,400 MHz):δ=7.41 (d,J=7.6 Hz,1H),7.35-7.33 (m,1H),7.26-7.23 (m,2H),5.54 (s,1H),3.68 (s,2H),3.24 (dd,J=6.4,12.8 Hz,2H),1.46-1.39 (m,2H),1.32-1.23 (m,2H),0.90 (t,J=7.6 Hz,3H).13C NMR (CDCl3,100 MHz):δ=169.54,134.40,133.22,131.71,129.78,128.90,127.36,41.56,39.47,31.51,19.96,13.70.HRMS calc.for C12H18NO[M+H]+192.1388;found 192.1386。
2-(2-氯苯基)-1-吗啉乙酮(化合物30):产率95%,白色固体,Mp:94~96 ℃.1H NMR (CDCl3,400 MHz):δ=7.39 (d,J=7.2 Hz,1H),7.32 (d,J=7.2 Hz,1H),7.28-7.19 (m,2H),3.81 (s,2H),3.67 (s,4H),3.59 (s,2H),3.47 (s,2H).13C NMR (CDCl3,100 MHz):δ=168.81,133.78,133.11,130.66,129.50,128.50,127.10,66.85,66.56,46.38,42.27,37.75.HRMS calc.for C12H15ClNO2[M+H]+240.0791;found 240.0796。
2-(4-甲氧基苯基)-1-哌啶乙酮(化合物31):产率95%,浅黄色固体,Mp:52~53 ℃.1H NMR(CDCl3,400 MHz):δ=7.24 (t,J=7.6 Hz,1H),6.84 (d,J=10.0 Hz,2H),6.79 (d,J=8.4 Hz,1H),3.79 (s,3H),3.70 (s,2H),3.57 (t,J=4.8 Hz,2H),3.37 (t,J=4.8 Hz,2H),1.58-1.52(m,4H),1.36 (m,2H).13C NMR (CDCl3,100 MHz):δ=169.11,159.83,136.92,129.60,120.93,114.06,112.27,55.21,47.29,42.89,41.25,26.19,25.50,24.42.HRMS calc.for C14H20NO2[M+H]+234.1494;found 234.1498。
3 结论
1)通过氧化剂、引发剂、温度及溶剂系列反应参数的筛选,得到最优反应条件:室温,乙醇作溶剂,以10 当量H2O2/NaClO 原位产生单线态氧为氧化剂,可高效促进硫代酰胺转酰胺反应。
2)在最优条件下,考察各种供电子取代基(烷基、烷氧基、羟基、氨基等)、吸电子取代基(卤素、硝基)、环状或线性烷基链以及官能团在不同位置对反应的影响,表明各种官能团均能兼容,立体电子影响较小,该方法底物范围广泛。
3)成功开发了一种高效、实践、环境友好的酰胺类衍生物的合成方法。该方法以廉价、环境友好的单线态氧作为理想的氧化剂,在较温和的条件下,可高效、高收率获得目标产物;反应背景干净,操作简便。上述优点使得新方法在学术和工业应用领域都将具有重要价值。

