阿萨尔基亚芽孢杆菌对大丽轮枝菌微菌核的抑制作用
高 畅,刘桂敏,曾 红,2
(1.塔里木大学 生命科学学院, 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆阿拉尔 843300;2.塔里木大学 生命科学学院,新疆阿拉尔 843300)
棉花黄萎病主要是由大丽轮枝菌(VerticilliumdahliaeKleb)引起的一种土传性植物病害,造成棉花等经济作物产量质量下降,经济损失严重。新疆是中国最大的棉产基地之一[1],近年来,棉花黄萎病在新疆地区危害日益加重,2000年,农5师0.67hm2棉田发病严重,发病率占总棉田的25%。棉花黄萎病在新疆主要植棉地区普遍发生,中度及以上病田占比达48.1%,严重发生病田占比为24.1%[2],危害严重,已成为阻碍新疆棉花生产可持续发展的主要障碍之一,而防治棉花黄萎病的生物菌剂有限,所以筛选棉花黄萎病高效拮抗菌株,研究其防病效果及机制对于棉花黄萎病的生物防治具有重要意义。
棉花黄萎病难以防治的根源是大丽轮枝菌的休眠体微菌核(microsclerotia,ms)具有耐寒耐旱等抗逆特性[3],可以在土壤中存活10a之久[4]。国内外关于棉花黄萎病防治采取的措施主要有抗性品种选育、改善栽培措施、施用化学农药等[5]。多菌灵、高锰酸钾、咪鲜胺是常用的防治棉花黄萎病的化学农药,能迅速抑制或杀死病原菌,但对土壤和宿主植物破坏性强。以甲基溴作为杀菌剂,利用烟熏法杀死微菌核[6],仅能缓解棉田地表病害,对于棉花黄萎病土传性病害防效有限,长期使用造成致病菌产生耐药性,不能有效抑制土壤中微菌核含量,且对环境污染严重,因此甲基溴逐渐被淘汰。传统化学农药难以控制微菌核,而生物防治作为一种环境友好型的方法则可以有效抑制微菌核的存活,降低其致病活性或抑制萌发,大量研究表明采用生物防治大丽轮枝菌是十分理想的选择。2004年Tjamos等[7]报道过一种植物根系促生细菌PaenibacillusalveiK165作为生物控制调节体(BCAS)杀死V.dahliae;2012年薛磊等[8]筛选出6株拮抗性链霉菌,通过离体试验利用其发酵液作用于大丽轮枝菌,结果表明6株拮抗菌的发酵液均对大丽轮枝菌微菌核有一定抑制作用,其中B49抑菌效果最好,其抑菌率高达69.70%;2020年张向月等[9]发现枝顶孢霉属内生真菌CEF-193对大丽轮枝菌生长及微菌核形成均有抑制作用。因此,可以通过微生物菌剂抑制大丽轮枝菌微菌核萌发,保障棉花增产、增收,实现棉花产业持续发展。
新疆棉区以连作为主,导致土壤微环境很难被改善,微菌核长期存活土壤中,使得黄萎病害日趋严重,同时缺乏有效防治棉花黄萎病的生物菌剂。在前期工作中从新疆生产建设兵团第1师12团连作棉田筛选出一株对棉花黄萎病有明显抑制效果的拮抗菌株,通过形态鉴定、生理生化试验、16S rDNA和gyrB基因序列分析,确定该菌株为TUBP1(Bacillusaxarquiensis),利用生长速率法和牛津杯法在离体条件下测定拮抗菌株TUBP1发酵液对棉花黄萎病菌抑菌活性,盆栽试验和小区生防试验结果均证明B.axarquiensis对棉花黄萎病生防效果显著[10]。后期又研究TUBP1对大丽轮枝菌拮抗活性,结果表明该菌株活性成分为蛋白,此类蛋白能够破坏大丽轮枝菌细胞膜,从而进入细胞引起线粒体细胞膜电位极化,促使其活性氧增加,破坏大丽轮枝菌细胞造成细胞凋亡[11];用TUBP1蛋白处理的大丽轮枝菌其孢子和菌丝出现凹陷萎缩[12]。本研究通过菌核萌发、共培养试验及盆栽试验检测TUBP1发酵液对微菌核的抑制作用,为研制和开发棉花黄萎病有效生防菌剂提供科学依据。
1 材料与方法
1.1 供试菌株
病原菌菌株:大丽轮枝菌VerticilliumdahliaeATCC36211。
生防细菌菌株:BacillusaxarquiensisTUBP1,由塔里木盆地生物资源保护利用重点实验室提供,分离于新疆第1师12团棉田土壤。
1.2 试剂及材料
抗生素(青霉素钠溶液与硫酸庆大霉素混合)、棉花种子、PMMA观察箱、营养土。
PDA培养基:去皮马铃薯200 g,葡萄糖 20 g,琼脂20 g,水定容至1 000 mL。
Czapek-Dox培养基:蔗糖30 g,NaNO32 g,K2HPO41.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.1 g,水定容至1 000 mL,pH 7.0~7.2。
NB培养基:葡萄糖20 g/L,蛋白胨10 g/L,NaCl 5 g/L,牛肉膏5 g/L,pH 7.0。
1.3 试验方法
1.3.1 制备大丽轮枝菌微菌核悬浮液及TUBP1无菌发酵液 将PDA平板中活化好的V.dahliae打成7 mm的菌饼(2~3个),接种到100 mL Czapek-Dox培养液中,每瓶培养液加入100 μL(0.05 g/L)抗生素,120 r/min、22 ℃培养3周,离心收集微菌核,无菌水重悬,重复3次,收集微菌核悬浮液置,4 ℃下保存,备用。
TUBP1接种到NB培养液中,180 r/min、 37 ℃培养48 h,离心收集上清液,0.22 μm微孔滤膜过滤2~3次,将无菌发酵液置于4 ℃下保存,备用[13]。
1.3.2 TUBP1发酵液活性测定 处理组(TM):100 mL灭菌后PDA培养基冷却至45 ℃左右,分别取原浓度、5倍和10倍稀释后的TUBP1发酵液25 mL加入 PDA平板中。对照组(CK):以等量无菌水代替处理组混合液中的发酵液,震荡混匀后倒板,得到对照组和处理组PDA平板。平板凝固12 h,取100 μL微菌核悬浮液均匀涂板,室温培养,每隔12 h观察微菌核萌发情况。
分别取上述对照组、处理组PDA平板,平板中央接入大丽轮枝菌菌饼,每隔5 d观察大丽轮枝菌生长状态,十字交叉法测量不同处理下菌落大小,根据菌落直径计算发酵液抑菌率( inhibition rate,IR) ,抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-7 )×100%。
1.3.3 扫描电镜观察TUBP1与大丽轮枝菌共培养对其形态影响 取TUBP1无菌发酵液与大丽轮枝菌共培养5 d、10 d、15 d菌体,参考电镜样品处理步骤[14]进行前处理,电镜观察。
1.3.4 盆栽试验检测微菌核萌发率 10 cm×10 cm(口径×高度)育苗袋育苗,自然土和营养土(含泥炭、椰糠、珍珠岩、蛭石、复合花肥等)按比例(1∶1)制成混合土壤,播种后保持土壤湿度,使种子有充足水分萌发。培养3周的棉苗移栽到PMMA观察箱(15 cm×15 cm×25 cm,L×W×H),每箱1株棉苗,设置对照组(CK)、处理组(TM)各5组。箱正面透明可活动的标为A面,箱底有孔保持水分流通,土壤同样采用育苗时的比例。10 d后棉苗恢复活性,处理组用TUBP1发酵液浇灌棉苗(每箱100 mL),对照组用等量无菌水浇灌,每隔2 d,重复以上操作。5 d后将微菌核菌悬液加入0.75%琼脂液中(温度控制在 45 ℃左右防治破坏微菌核活性),用磁力搅拌器混匀后倒至A面,凝固后取出,在室内晾置24 h,多余水分蒸发使琼脂层变成薄层,将A面组装回箱子。10 d后显微镜观察,微菌核的萌发数设为x未萌发数设为y,分别在A面根尖区域抽样,样方为20 cm2。

相对抑制率=
2 结果与分析
2.1 TUBP1对大丽轮枝菌微菌核萌发及形态的影响
微菌核萌发随时间不断增加,前12 h CK组和TM组均无明显变化,24 h时开始萌发,待 72 h CK组微菌核萌发率达到85.49%,TM组原发酵液处理的微菌核萌发率为62.52%(图1-A),5倍和10倍稀释发酵液的微菌核萌发率分别为70.10%(图1-B)、75.33%(图1-C)。

CK、TM分别指对照组和处理组;A.TUBP1原发酵液;B.TUBP1发酵液5倍稀释;C.TUBP1发酵液10倍稀释
2.2 TUBP1对大丽轮枝菌的形态影响
培养15 d后,与对照组相比,处理组菌丝生长旺盛且原浓度发酵液共培养的大丽轮枝菌菌丝较发达。施加原浓度发酵液共培养10 d大丽轮枝菌菌落不产微菌核(图2-B),共培养15 d时菌落边缘有极少微菌核产生(图2-C),由原来的菌核型转变成菌丝型。3个不同培养时期,处理组菌落直径随TUBP1发酵液浓度增加逐渐降低且始终小于对照组(图2-D)。
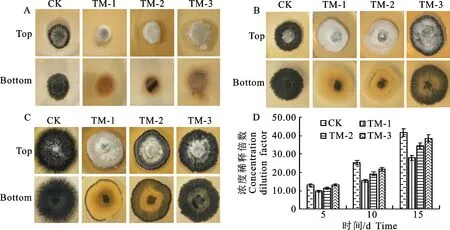
A~C.TUPB1发酵液与大丽轮枝菌共培养5~15 d菌落形态,D.不同处理菌落直径测量;A~D.CK为对照,TM-1表示原浓度发酵液、TM-2和TM-3表示5倍和10倍稀释发酵液,下同
2.3 TUBP1发酵液对大丽轮枝菌抑菌效果
TUBP1不同稀释浓度发酵液对大丽轮枝菌生长均有抑制作用,不同处理抑制率差异显著(表1);原浓度发酵液抑菌效果较好,共培养15 d,其抑菌率达到64.69%;5、10倍稀释发酵液,共培养5 d、10 d、15 d二者抑菌率均低于原浓度 TUBP1发酵液。
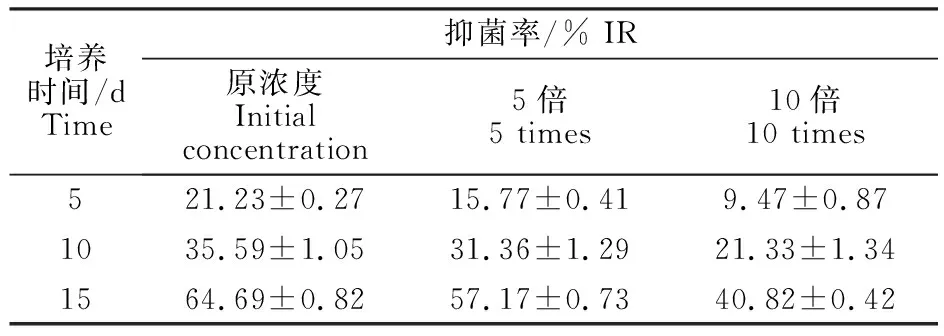
表1 TUBP1不同浓度发酵液对大丽轮枝菌抑菌率Table 1 Inhibition rate of TUBP1 against Verticillium dahliae
2.4 扫描电镜观察TUBP1发酵液对大丽轮枝菌形态结构的影响
通过扫描电镜观察(图3),施加不同浓度TUBP1发酵液对大丽轮枝菌表型均有影响。分生孢子及微菌核形成减少,且随培养时间延长菌丝发生膨胀、断裂,出现异型,大丽轮枝菌自身形态结构被破坏,说明该生防菌株TUBP1对棉花黄萎病菌有较显著的抑制效果。
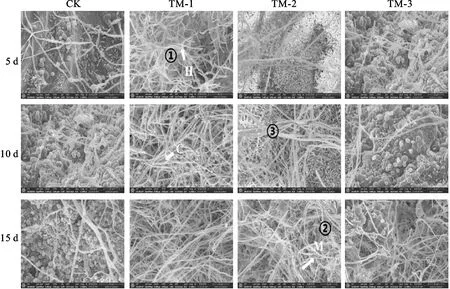
CK表示对照;C为分生孢子;H代表菌丝;M为微菌核;①菌丝膨胀;②菌丝破裂;③菌丝肿胀;比例尺=30 μm
2.5 盆栽试验中TUBP1发酵液对微菌核的抑制作用
盆栽试验结果(表2)表明,处理组的萌发率低于对照组,相对抑制率为38.95%,表明TUBP1发酵液对微菌核的萌发有较好的抑制 作用。

表2 TUBP1发酵液对棉花黄萎病菌微菌核萌发的抑制Table 2 Inhibition of TUBP1 on sclerotia germination of Verticillium dahliae
3 讨 论
在国家要求“化肥、农药双减”的背景下生物菌剂在抑制植物病害方面作用日益突出,芽孢杆菌作为一类抗逆性极强的生防菌,可抑制多种植物病原菌。目前已有许多研究将芽孢杆菌与杀菌剂复配,包括枯草芽孢杆菌、多粘芽孢杆菌、解淀粉芽孢杆菌、蜡状芽孢杆菌等多个种属,经过验证能成功防治多种植物病害[15]。
在本研究中,阿萨尔基亚芽孢杆菌发酵液可通过抑制大丽轮枝菌微菌核的形成控制病原菌生长繁殖,降低棉花黄萎病发病率。试验表明,阿萨尔基亚芽孢杆菌发酵液在离体、盆栽试验检测中对大丽轮枝菌微菌核萌发具有较强抑制作用。不同培养时期,阿萨尔基亚芽孢杆菌发酵液均对大丽轮枝菌形态及菌核萌发有影响。其中原浓度发酵液抑菌作用最强;共培养15 d,大丽轮枝菌由菌核型向菌丝型转变,其抑菌率达64.69%,说明阿萨尔基亚芽孢杆菌发酵液对大丽轮枝菌抑菌活性显著且存在浓度依赖性。在扫描电镜下较直观地观察到对照组与处理组差异,随培养时间及发酵液浓度增加大丽轮枝菌菌丝形态发生膨胀、断裂、异型,分生孢子及微菌核形成逐渐减少,进一步说明阿萨尔基亚芽孢杆菌对大丽轮枝菌微菌核有较强抑制作用。
微菌核形成量少或不能形成微菌核的大丽轮枝菌,其致病力也会相应减弱[16],微菌核形成量的减少意味着棉花黄萎病的抗逆性休眠体减少,连作棉田的发病率降低。拮抗植物病原菌的生防细菌抗逆性强、生长快、种类较多,其中芽孢杆菌应用较多,定殖率高,且能够促进植物生长[17]。该研究中的阿萨尔基亚芽孢杆菌易于培养,生长繁殖速度快,在优化发酵工艺[18 -19]基础上制成活菌生防菌制剂施入土壤,直接作用于大丽轮枝菌微菌核,减少土壤中黄萎致病菌数量,达到生防目的。综上可见,开发阿萨尔基亚芽孢杆菌生防菌剂防治棉花黄萎病前景乐观,对新疆棉花黄萎病的生物防治意义重大。

