莱茵衣藻对MeJA处理的初期响应模式分析
贾彬,兰成湘,李翔宇
深圳大学生命与海洋科学学院,深圳市海洋生物资源与生态环境科学重点实验室,广东省海洋藻类生物工程技术研究中心,广东深圳 518071
光合微藻是单细胞真核生物,由于其生境广泛[1]、光合效率高[2]、可适应极端环境[3],以及具有回收无机碳、氮的能力,在生产高价值化合物等方面广受关注.微藻还是活性类异戊二烯的天然来源,如虾青素[4]、β-胡萝卜素[5]和岩藻黄质[6]等.莱 茵 衣 藻(Chlamydomonas reinhardtii,C. reinhardtii)是目前分子研究最为深入的模式藻种之一[7],在莱茵衣藻中,代谢工程手段已被用于生产高价值的异源类异戊二烯[8-11],但由于内源异戊二烯底物异戊烯焦磷酸(isopentenyl pyrophosphate,IPP)与二甲基丙烯焦磷酸(dimethylallyl pyrophosphate,DMAPP)的供应不足导致异源萜产量低.因此,如何促进异戊二烯底物供应,以及研究异戊二烯的胞内合成和积累机制成为莱茵衣藻异戊二烯工程亟待解决的问题.
茉莉酸甲酯(methyl jasmonate,MeJA)能够激活茉莉酸信号通路,参与植物从种子萌发、根系生长、幼苗发育、衰老等发育到防御反应的许多生理过程,被广泛用于植物次生代谢产物调节[12-14],如酚类、类异戊二烯(青蒿素、紫杉醇和人参皂苷等)、黄酮类、生物碱(长春花碱和尼古丁)和苯丙烷类等.研究发现,MeJA 能够通过增强类异戊二烯的合成途径基因表达,促进产物的积累[15-17].MeJA 处理能使莱茵衣藻中类异戊二烯化合物的合成基因表达改变[15],导致三萜类化合物前体角鲨烯和(S)-2,3-环氧角鲨烯的积累[16],诱导中央碳代谢和饱和脂肪酸代谢网络改向,并选择性改变氨基酸、黄酮类和生物碱的生物合成,虽然相关代谢物产量的变化在MeJA 处理1~2 d 后呈现,但植物体内的分子应答反应却非常迅速[17].植物对内源或者外源激素(特别是胁迫类激素)的刺激极为敏感,甚至在处理后的几分钟内便在分子水平做出迅速的应答反应.因此,研究莱茵衣藻在MeJA 处理后的初期响应是发现其体内核心响应基因的关键.莱茵衣藻的异戊二烯合成依赖于叶绿体中的2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methnatureyl-D-rythritol-4-phosphate,MEP)合成途径.本研究以h 为时间单位,探索莱茵衣藻在MeJA 处理初期的响应特点,重点关注其生长速度、光合效率、MEP途径关键基因、类胡萝卜素合成途径关键基因和甾醇类物质合成途径关键基因的变化规律,以期揭示MeJA 处理下莱茵衣藻的异戊二烯代谢的响应,为研究微藻异戊二烯合成和代谢机制提供理论参考.
1 材料方法
1.1 实验材料与培养条件
莱茵衣藻UVM4 购自美国衣藻资源中心(https://www.chlamycollection.org).培养条件为:tris-acetate-phosphate(TAP)培养基,温度25 ℃,光照强度120 μmol/(m2·s),16 h/8 h光暗交替.
1.2 莱茵衣藻生长状态特征的测定
根据文献[16]报道,当MeJA 浓度达到1.0 mmol/L时会促进异戊二烯途径关键中间代谢物的积累,但也会对细胞生长和生理产生负面影响,因此本研究使用3 种浓度(0.5、1.0 和1.5 mmol/L)处理莱茵衣藻.处理后,以h 为单位细胞计数反映MeJA 对莱茵衣藻生长特征的影响.同时,在处理后 0、24、48 和 72 h 后分别取 20 mL 藻液,离心收集细胞,置于烘箱烘干后测定细胞的质量浓度.
1.3 叶绿素荧光参数的测定
使用Phytopam测试仪检测莱茵衣藻的叶绿素荧光参数.取2 mL 处理后的藻液加入荧光比色杯,保持黑暗条件2 min 后进行饱和脉冲光处理,测量PSII光化学还原的最大量子产率.使用饱和脉冲光处理120 s测量实际光合效率.
1.4 叶绿素与总类胡萝卜素的测定
莱茵衣藻胞内色素使用甲醇提取,并使用酶标仪进行检测.取2 mL经MeJA处理后的藻液,离心后弃上清,收集藻细胞,加入2 mL 甲醇(体积分数≥99%),混匀后于4 ℃放置24 h,离心取上清分别测定波长为470、652 和665 nm 处的光密度值D(470)、D(652)和D(665),并通过式(1)—式(3)计算藻液中叶绿素a、叶绿素b与总类胡萝卜素的质量浓度(ρ总,单位:μg/mL).

1.5 MEP途径与下游次生代谢产物合成途径基因的实时荧光定量聚合酶链式反应检测
使用Trizol 法提取总核糖核酸(ribonucleic acid,RNA).采用超微量分光光度计(Nanodrop 2000,Thermo Fisher Scientific)测定RNA 样品的质量浓度和纯度,每个样品以1 μg 的总RNA 量使用Evo M-MLV(湖南艾克瑞)反转录试剂盒合成互补脱氧核糖 核 酸(complementary deoxyribo nucleic acid,cDNA).将模板cDNA 稀释10 倍后进行使用SYBR®Green Premix Pro Taq HS 实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)试剂盒(湖南艾克瑞),以U4 核仁小分子核糖核酸(small nucleolar RNA,snoRNA)作为内参,对MEP途径关键基因(DXS、DXR、CMK、MDS和IDI)、类胡萝卜素合成关键途径基因(PSY、PDS、ZDS、CRTISO和CHYb)与甾醇合成关键途径基因(FPPS、SQE、CAS、CYP51 和ERG4/24)进行定量检测,每个样品设置3个重复.
1.6 数据统计与分析方法
使用GraphPad Prism 8.0 软件进行数据的统计分析与作图,以非处理组为对照(control check,CK),并通过双因素方差分析Dunnett-t检验进行多重比较.以P< 0.01 为差异显著,以P< 0.001 为差异极显著.本研究中数据均为用平均值±标准偏差()表示(n= 3).
2 实验结果
2.1 MeJA处理下的莱茵衣藻生长与光合特征分析
不同浓度MeJA 处理时,藻细胞生长均受到程度抑制不同,结果见图1(a).随着处理浓度的提高,藻细胞受到的抑制程度也越严重.当MeJA 浓度达1.5 mmol/L 时,藻细胞死亡数量增加,处理72 h 后,存活细胞密度不足 5 × 105mL-1.MeJA 处理导致藻干质量下降,且浓度越高,细胞干质量下降越迅速,见图1(b).综上所述,MeJA 对莱茵衣藻的生长具有显著的抑制作用,且抑制效果与其浓度成显著正相关.

图1 不同浓度MeJA处理后细胞的生长曲线与干质量变化Fig.1 Growthcurveanddryweightof C.reinhardtii cells after treatment with different concentrations of MeJA
光合系统对微藻生长和增殖有重要的生理意义.本研究检测了MeJA 处理下莱茵衣藻的光合效率.结果显示,在72 h 内MeJA 处理组的最大光合效率和实际光合效率始终显著低于CK 组,见图2(b).其中,1.0 mmol/L 与 1.5 mmol/L MeJA 处理组的最大光合效率和实际光合效率在1 h 内呈快速降低趋势(图2),且实际光合效率随处理时间延长而持续下降.该结果表明,高浓度MeJA 处理可快速降低莱茵衣藻的光合效率,对光系统造成不可逆的损伤,这可能是导致莱茵衣藻细胞增殖受到MeJA抑制的主要因素之一.
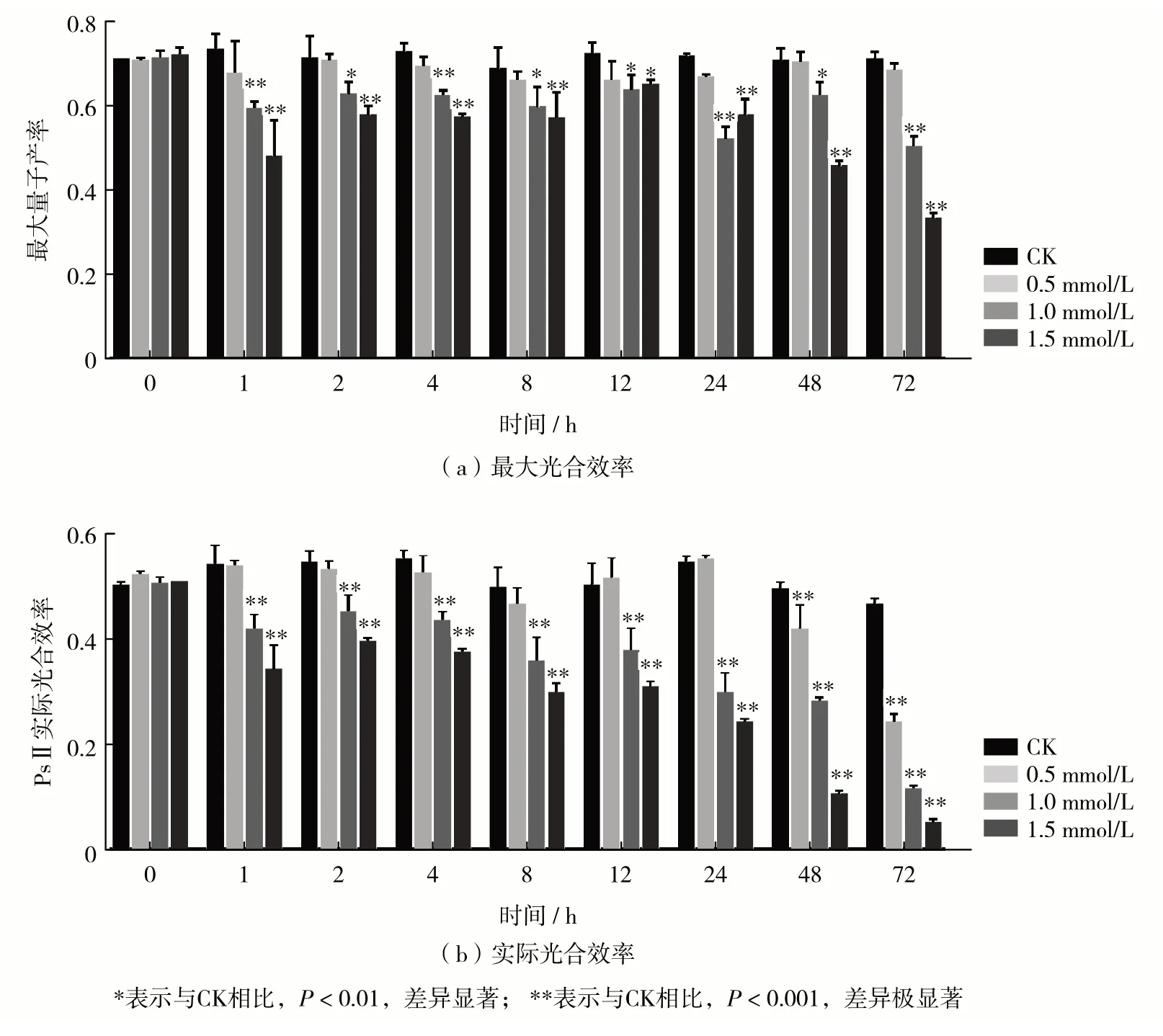
图2 不同浓度MeJA处理后最大光合效率与实际光合效率的变化Fig.2 Changes of the maximum and actual photosynthetic efficiency after treatment with different concentrations of MeJA
2.2 MeJA处理可增强MEP途径关键基因的表达
MeJA 处理后,参与微藻MEP 途径5 个基因(DXS、DXR、CMK、MDS和IDI)的表达模式如图3.由图3可见,MeJA处理增强了MEP途径关键基因表达的上调,且在不同浓度MeJA 处理下,MEP途径基因具有不同的表达模式.其中,当MeJA 浓度为1.0 mmol/L时,1 h与4 h上调幅度更高;而当MeJA 浓度为1.5 mmol/L 时,则在24 h 时上调幅度更高.MeJA 浓度为1.0 mmol/L 的处理组在1 h 时,DXS与MDS基因表达上调最为显著,分别上调至4.63倍与2.11倍;在4 h时,DXS基因表达上调至5.88倍.MeJA浓度为1.5 mmol/L的处理组在1 h与4 h 时,仅DXS基因表达显著上调,分别上调至1.78 倍与 3.09 倍;在处理 24 h 时,DXS、DXR与CMK基因表达分别显著上调至6.00、38.29 与5.85倍.

图3 不同浓度MeJA处理后MEP途径基因的表达水平Fig.3 Expression levels of MEP pathway genes after treatment with different concentrations of MeJA
2.3 MeJA 处理能降低胞内光合色素和调节类胡萝卜素合成基因表达
莱茵衣藻的光合色素、类胡萝卜素和甾醇类等物质的合成均依赖于MEP 途径,而MeJA 处理能影响莱茵衣藻的MEP途径,并抑制其光合系统活性.因此,本研究进一步测定MeJA 处理下莱茵衣藻的光合色素质量浓度变化以及类胡萝卜素合成途径关键基因的表达水平.
不同浓度MeJA 处理后,莱茵衣藻胞内叶绿素a、叶绿素b 和总类胡萝卜素质量浓度变化如图4.在处理24 h时,3种胞内色素质量浓度均升高,但MeJA 处理组(0.5、1.0 和1.5 mmol/L)的色素质量浓度均显著低于CK 组,且处理浓度越高,降低的幅度越明显.在处理24 h后,处理组色素质量浓度不再显著上升.其中,1.0 mmol/L与1.5 mmol/L处理组在处理48 h 后,色素开始降低;在处理72 h后,1.5 mmol/L 处理组3 种胞内色素质量浓度低于处理前,分别为处理前的86%、81% 和78%.qPCR分析发现,MeJA会影响类胡萝卜素合成径的关键基因表达(图5).与对照组相比,MeJA分别处理1 h与4 h时,类胡萝卜素合成途径的基因均受到显著的抑制作用;处理24 h时,尽管PDS、ZDS与CRTISO基因的表达水平有所恢复甚至上调,但限速酶八氢番茄红素合成酶(phytoene synthase,PSY)基因与下游的CHYb基因仍被显著抑制.其中,1.0 mmol/L 与 1.5 mmol/L 处理组的PSY基因表达量仅为对照的20%与12%,CHYb基因表达量仅为对照的31%与7%.限速酶基因的低表达可能是造成胞内色素降低的原因.
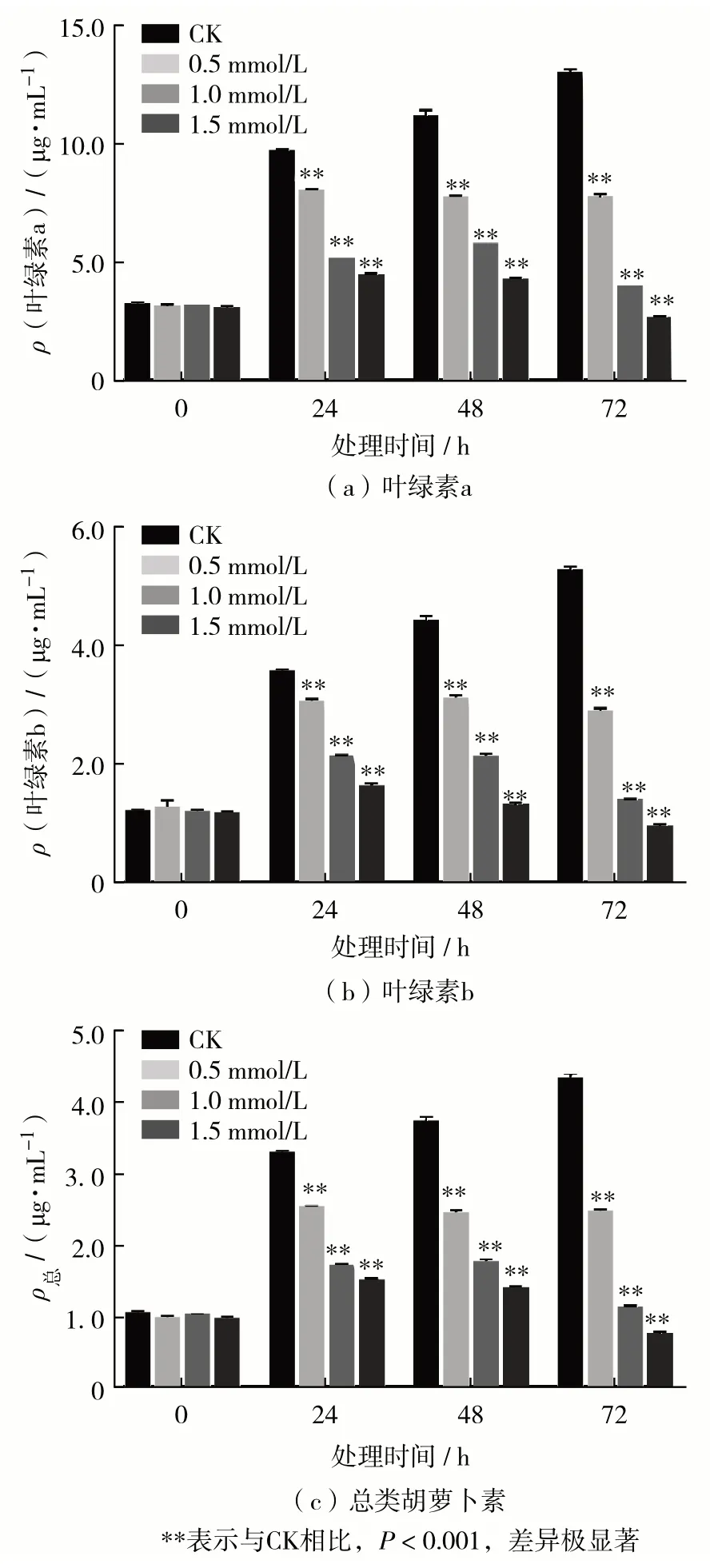
图4 不同浓度MeJA处理后叶绿素a、叶绿素b、总类胡萝卜素的变化Fig.4 Changes of chlorophyll a,chlorophyll b and total carotenoids after treatment with different concentrations of MeJA
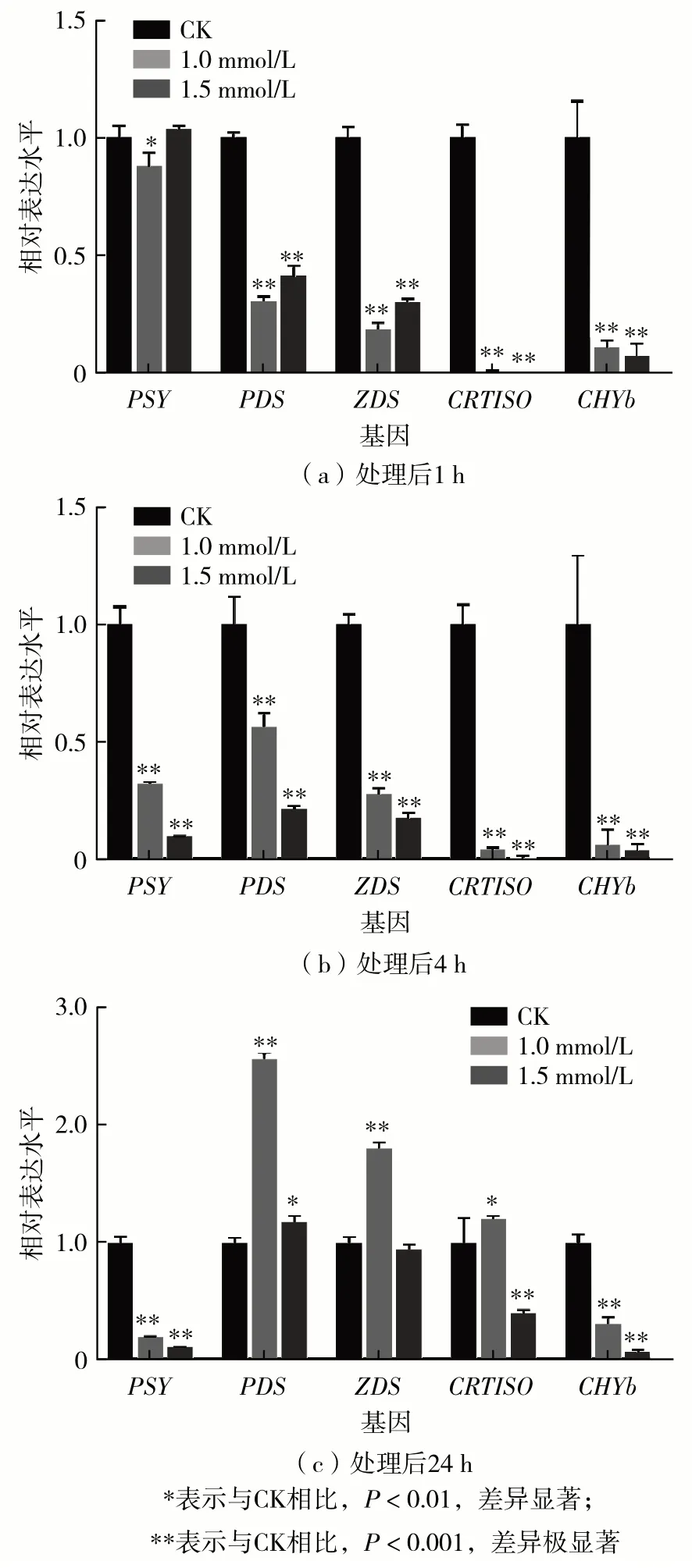
图5 不同浓度MeJA处理后类胡萝卜素合成途径基因的表达水平Fig.5 Expression levels of carotenoid synthesis pathway genes after treatment with different concentrations of MeJA
2.4 MeJA处理能增强甾醇类物质合成途径基因表达
莱茵衣藻的甾醇类物质合成同样依赖于MEP途径,合成途径的关键基因有FPPS、SQE、CAS、CYP51 和ERG4/24.它们在MeJA 处理下的表达模式如图6.甾醇类物质合成途径基因在不同浓度MeJA 处理后均显著上调,且随着处理时间延长,上调幅度持续上升.在处理4 h 时,1.0 mmol/L 处理组上调幅度更高;而在处理24 h后,1.5 mmol/L处理组上调幅度更加显著.其中,1.0 mmol/L处理组在处理4 h 时,ERG4/24 基因相对表达水平最高上调至14.47倍,其他基因分别上调至1.26~7.52倍.1.5 mmol/L 处理组在处理24 时,CYP51 与ERG4/24 基因相对表达水平分别上调至40.26 与23.01倍,其他基因分别上调至6.11~7.56倍.
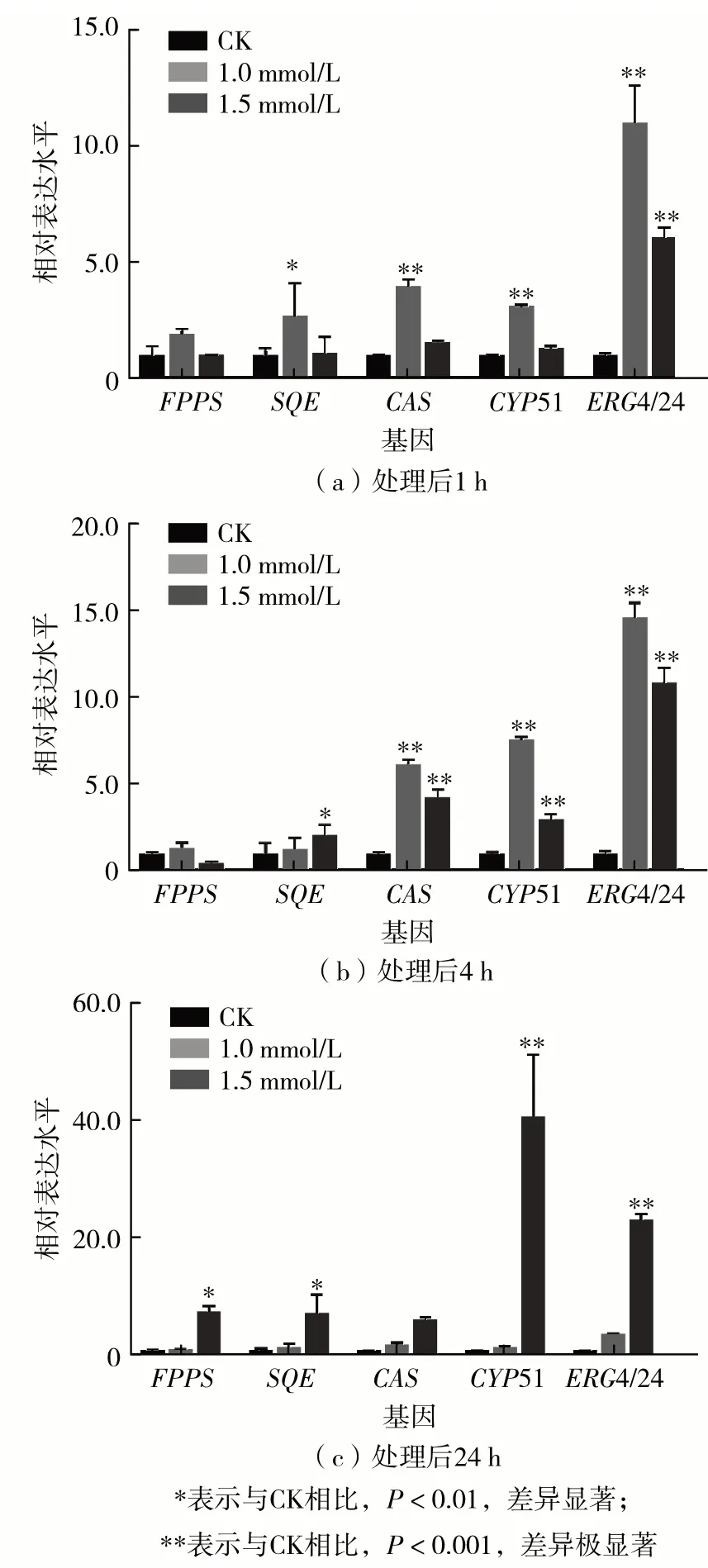
图6 不同浓度MeJA处理后甾醇类物质合成途径基因的表达水平Fig.6 Expression levels of sterol synthesis genes after treatment with different concentrations of MeJA
综上所述,MeJA 处理诱导MEP 途径与甾醇类物质合成途径基因上调表达,类胡萝卜素合成途径基因下调,说明MeJA 处理下导致异戊二烯更多流向细胞质内甾醇类物质的合成.
3 讨 论
3.1 MeJA处理诱发莱茵衣藻细胞作出快速响应
莱茵衣藻是单细胞真核微藻,对于外源刺激响应十分迅速,处理后样品早期和晚期的转录水平组间差异大[18-19].因此,对初期响应模式分析能够更加精准地发现莱茵衣藻在短时间内做出的应答反应机制.MeJA 作为外源刺激剂,会导致莱茵衣藻在生理生化、代谢与转录水平发生巨大改变.在生理生化水平,MeJA 处理会损伤光系统,导致光合色素质量浓度降低,致使光合效率,细胞活性下降[16].在代谢水平,MeJA 处理后莱茵衣藻细胞中心碳代谢和饱和脂肪酸代谢发生广泛的重组,氨基酸代谢发生选择性改变[17],甚至诱导细胞生成新生未知的三萜化合物[15].在转录水平,MeJA 处理导致MEP 通路基因表达发生改变,IPP 和DMAPP 流向发生改变,光合色素合成和甾醇类物质合成受阻[17].类胡萝卜素是维护光系统活性的重要组成,对于清除光合作用产生的活性氧有重要的生理意义.因而,类胡萝卜素合成受阻可能是MeJA 处理下莱茵衣藻光合活性与细胞活性降低的主要原因之一.本研究发现,莱茵衣藻细胞对MeJA响应快速,且与处理剂量呈正相关.加入MeJA 的同时,莱茵衣藻光系统活性即呈迅速下降,且随着处理时间的延长持续下降,降低速度与处理浓度呈现显著的线性相关.细胞浓度在处理后1 ~2 h后,处理组同对照组产生了显著的差异,说明莱茵衣藻对MeJA 极为敏感,响应快速.
3.2 MeJA对MEP途径与下游代谢网络的调控作用
近年来,莱茵衣藻作为生产异源类异戊二烯的光合细胞工厂受到了一定的关注[11],但MEP 通量有限,导致微藻产萜能力受到限制.1-脱氧木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)与1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)是MEP 通路的关键和限速酶,提高它们的表达量能增加MEP 途径通量,促进下游产物的积累[20-22].本研究发现,莱茵衣藻细胞经1.0 mmol/L MeJA 处理 1 ~ 4 h 后,可诱导DXS基因表达迅速上调,但不影响DXR的表达,这可以增加IPP 和DMAPP 的通量.MeJA 减少莱茵衣藻细胞光合色素合成,尽管一些类胡萝卜素合成途径基因在24 h时,表达上调,但类胡萝卜素合成的起始酶基因PSY受到显著抑制,同时,胞内色素质量浓度较低也说明IPP 与DMAPP 可能从合成光合色素流向细胞质中三萜化合物的合成.
虽然本研究中发现甾醇类物质合成途径的基因上调表达,但也有研究表明,MeJA 处理后莱茵衣藻胞内主要甾醇(麦角固醇与7-脱氢多孔甾醇)降低,却同时检测到了尚未表征的未知三萜类产物[15],该化合物与甾醇使用共同前体底物(S)-2,3-oxidosqualene 进行生物合成[23].因而推断 MeJA 可能激活未知基因(如细胞色素P450)的表达,导致胞内产生新的三萜类化合物,而甾醇的减少不利于细胞膜结构稳定,这可能也是生物量减少的原因之一.
结 语
MeJA 处理对微藻的生物量积累和光合系统活性有负面影响,造成莱茵衣藻生长速率降低,但可以激活叶绿体内MEP 上游合成途径基因与胞质内三萜类化合物合成途径基因的上调,下调类胡萝卜素合成途径关键基因.在转录与生理层面,莱茵衣藻对于MeJA 处理的初期响应具有快速与剂量依赖性的特点.莱茵衣藻在MeJA 处理早期的响应模式研究为微藻异戊二烯工程设计改造提供新的思路和工具,也为在莱茵衣藻中进行合成生物学与代谢工程研究奠定一定的基础.
致谢:衷心感谢胡章立教授的悉心指导!感谢深圳大学测试中心、生命与海洋科学学院公共仪器服务平台的设备支持!

