抗体药物的发展与应用
杨懿祺, 张志高, 游小龙, 张婧, 林冠峰, 吴英松
南方医科大学检验与生物技术学院,广州510515
抗体(antibody)又称免疫球蛋白,是由B 淋巴细胞接受刺激后产生的糖蛋白,结构呈“Y”字型,具有特异性结合抗原的功能,在人体抵御外界感染性病原体中发挥重要作用。早在1890 年,德国科学家Emil Adolf von Behring 首次建立了血清免疫疗法用于治疗白喉,获得了首届诺贝尔生理学或医学奖,开创了人工被动免疫治疗的先河[1]。1975年,Kohler和Milstein成功利用杂交瘤技术生产了单克隆抗体(monoclonal antibodies,mAbs)[2],这是一种由单一B细胞克隆产生的,高度均一、仅针对特定抗原表位的抗体。相较于多克隆抗体具有特异性强、纯度和效价高等优势。
随着人们对抗体的认识不断深入,单克隆抗体在临床治疗、体外诊断、科学研究等领域发挥重要作用,而抗体药物已经成为全球新药开发的热点。自1986 年全球首个鼠源单克隆抗体药物莫罗莫那单抗(muromonab-CD3)经美国食品与药品监督管理局(US Food and Drug Administration,FDA)批准上市至今,抗体药物历经数十年的发展,已经成为生物药中增长最快的领域。目前,获FDA 批准上市的抗体药物已超100 个[3],超80 种抗体药物获国家药品监督管理局(National Medical Products Administration,NMPA)批准进口,国内自主研发并成功上市的国产抗体药物近10 种(表1)。随着更多抗体药物的成功上市,适应证覆盖面进一步扩大,抗体药物市场蓬勃发展的同时也推动了医学的进步。
1 单克隆抗体药物的人源化历程
早期单克隆抗体药物是以莫罗莫那单抗为代表的全鼠源单抗,用于治疗器官移植后的急性排异反应,但由于具有较短的半衰期和较强的免疫原性,易诱发人抗鼠抗体(human anti-mouse antibody,HAMA)反应而被迫退出市场[4]。为了使抗体药物更好地应用于临床,抗体人源化改造的步伐从未停止,经历了鼠源性、人鼠嵌合性、人源化和全人源化4个阶段[5]。
人鼠嵌合抗体通过基因重组技术,保留了鼠源的可变区以保证抗体特异性和亲和力,而恒定区为人源成分以减低免疫原性。目前市场份额较大的人鼠嵌合抗体药物是1997 年上市的利妥昔单抗(rituximab-CD20),该抗体药物通过ADCC 和CDC 杀死肿瘤细胞,适用于非霍奇金淋巴瘤和慢性淋巴细胞白血病。
基于CDR 移植技术[6],人源化抗体将人源化部分提高到95%,仅保留动物来源的部分可变区(即骨架区),进一步降低了免疫原性。代表性药物是1998 年批准上市的曲妥珠单抗(trastuzumab-HER2),用于治疗乳腺癌,通过阻断HER2 信号通路,抑制肿瘤生长。2008年,我国首个自主研发的人源化抗体药物尼妥珠单抗(nimotuzumab-EGFR)上市,用于鼻咽癌的治疗,打破了国外对抗体药物垄断的局面。
全人源化抗体完全由人类基因编码,显著减低了免疫原性,主要依赖于抗体展示技术和转基因小鼠技术[7]。2002 年,经噬菌体展示文库筛选得到的阿达木单抗(adalimumab-TNFα)成为首个经FDA 获批上市的全人源化抗体,因其广泛的适应证和连续多年排名第一的销量而有“药王”之称,至今仍具有巨大的发展潜力。
2 新型抗体药物的类型及特点
随着现代生物技术的发展及对抗体结构和功能认识的不断深入,研究人员通过不同抗体片段的组合、对抗体表面的位点进行修饰、偶联小分子药物或其他化学物质等策略,发展了数量庞大的抗体结构形式,并各有优势。包括抗体融合蛋白(antibody fusion protein)、抗体偶联药物(antibodydrug conjugate,ADC)、双特异性抗体(bispecific antibody,BsAb)、小分子抗体片段等。
2.1 抗体融合蛋白
抗体融合蛋白是指通过DNA 重组技术,将目的蛋白基因与抗体片段基因相连并表达的重组蛋白,具有抗体的特性及融合功能蛋白的活性。由于直接由基因编码表达为完整的融合蛋白,其优势在于蛋白与抗体连接稳定,结合均一[8]。根据抗体结构的不同,可以将抗体融合蛋白分为完整抗体融合蛋白和抗体片段融合蛋白[9],且以Fc 融合蛋白最多见。
基于上述单元信息知识组织的流程,建立基于本体和关联数据的单元信息知识组织框架,如图3所示,该框架为4层结构,从下至上分别为数据层、语义聚合层、数据关联层和应用层。各层功能相对独立,上层功能基于底层功能实现。
Fc 融合蛋白的抗体Fc 段可以通过增大融合蛋白的分子量及FcRn 介导的再循环机制延长药物半衰期[10-11],提高融合蛋白的稳定性,还可以发挥Fc 段特有的细胞毒性作用杀伤肿瘤细胞[12]。另外,Fc 段也有助于融合蛋白生产过程中的表达和检测[11]。
研究发现,细胞因子及其受体有治疗疾病的潜能,但受限于治疗窗口较窄,而细胞因子受体与抗体融合组成的重组抗体细胞因子受体融合蛋白能有效解决该问题,目前相关研究多处在临床前或早期临床研究阶段[9]。现已上市且应用广泛的重组抗体细胞因子受体融合蛋白是重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白——依那西普(etanercept-TNF),属于Fc 融合蛋白,适应证为类风湿性关节炎、银屑病、强直性脊柱炎。另外,各种来源于细菌、病毒的毒素也可以与抗体融合组成抗体融合蛋白,通过干扰细胞的蛋白合成发挥功能。重组免疫毒素也是一类重要的抗体融合蛋白,它是全抗体或抗体片段与蓖麻毒素等生物毒素蛋白的融合蛋白。目前已获批上市的重组免疫毒素有remitoro、lumoxiti、vicineum,主要用于血液系统肿瘤[8]。

表1 部分已上市的具有代表性的抗体药物Table 1 Some representative antibody drugs on the market
2.2 抗体偶联药物
抗体偶联药物是一类由高特异性和亲和力的单克隆抗体、稳定的连接头(linker)、高效的细胞毒性化学药物(cytotoxic chemical agent)三部分组成的靶向生物药剂[13]。通过单克隆抗体的靶向作用特异结合肿瘤细胞,释放细胞毒性药物,杀死肿瘤细胞[14],从而实现药物的高速靶向运输、精准杀伤肿瘤细胞、减少全身不良反应的目的。
人源IgG1 型抗体凭借其较弱的免疫原性、较好的亲和力和特异性、较长的半衰期,能诱发ADCC 和CDC 的特点而常被应用于ADC[15-16]。连接头的选择对ADC 的效能和安全性有重要影响,需要保证其在循环中的稳定性和到达靶点后有效释放药物,以腙键、肽键或二硫键较常见[17]。常见的细胞毒性药物类型主要有微管蛋白抑制剂和DNA损伤试剂[5]。
但ADC 仍存在一些问题有待改进,包括化学偶联的方法导致细胞毒性药物与抗体偶联比例(drug-to-antibody ratio,DAR)不稳定[10],连接头不稳定导致的脱靶毒性[17],以及药物释放后扩散杀伤周围正常细胞的旁观者效应[5]。
在临床应用上,FDA已批准的ADC共10个,主要针对血液系统肿瘤和实体瘤,包括白血病、淋巴瘤、乳腺癌、泌尿系统肿瘤[18]等。目前我国已经获批进口的ADC有恩美曲妥珠单抗(trastuzumab emtansine-HER2)和维布妥昔单抗(brentuximab vedotin-CD30),分别针对乳腺癌和淋巴瘤发挥功能[19]。2021 年,我国首个自主研发ADC 维迪西妥单抗(disitamab vedotin-HER2)上市,用于局部晚期或转移性胃癌。
2.3 双特异性抗体
双特异性抗体是一类可以同时识别和结合两种不同抗原的新型抗体。相比于传统单克隆抗体,双特异性抗体通过诱导细胞相互靠近,增强杀伤作用,还可以结合同一细胞表面不同抗原,减少脱靶效应。
已经上市或在研发的双特异性抗体种类繁多,形式多样(图1)。根据是否含Fc 段将双特异性抗体分为两类。一类是含Fc 段的双特异性抗体,其与传统抗体结构类似,但两个Fab 区可以结合不同抗原,稳定性好、亲和力强、半衰期较长,包括Triomabs、KIHIgG、DVD-IgG、2 in 1-IgG、Cross-MAb、DuoBody和ART-IG等。另一类是不含Fc段的双特异性抗体,由Fab 或更小的片段构成,具有分子量小、穿透力强、半衰期短等特点,如Tand-Abs、DART、BiTE、Bi-Nanobody等[20-21]。

图1 不同形式的双特异性抗体Fig.1 Different types of bispecific antibodies
已经获批上市的双特异性抗体药物主要通过介导免疫细胞杀伤,促进蛋白形成功能性复合体,干扰信号通路发挥作用。通过双特异性的结合位点使靶细胞(如肿瘤细胞)和免疫细胞(如T细胞)结合,准确定位,激活免疫细胞发挥杀伤作用[22]。2009年上市的卡妥索单抗(catumaxomab-EpCam*CD3)和2014年上市的博纳吐单抗(blinatumomab-CD3*CD19)均通过该机制发挥功能,分别适用于恶性腹水和急性淋巴细胞白血病。2017 年上市的艾美赛珠单抗(emicizumab-FIXa*FX)通过促进蛋白形成功能性复合体发挥功能。该抗体可以桥接凝血因子IXa 和凝血因子X,促进凝血酶生成,用于A型血友病的常规预防。2021年获批上市的埃万妥单抗(amivantamab-EGFR*c-MET)则通过阻断信号通路和介导免疫细胞杀伤双重抗癌,适用于EGFR突变的非小细胞肺癌。
2.4 小分子抗体片段
小分子抗体片段包括以下几种:抗原结合片段、单链可变区(single-chain fragment variable,scFv)和单域抗体,具有体积小、穿透能力强、特异性强、免疫原性弱、易于基因工程改造和表达生产等特点[23]。其半衰期短、易清除的缺点可以通过结合不同的小分子和肽段适当增加分子大小来弥补,在延长其半衰期的同时,也能够拓宽其功能,增强效能[24-25]。抗体片段的制备方法包括体外酶消化法、多种表达系统表达以及噬菌体展示技术。其中,大肠杆菌表达系统具有生产成本低、产量高、生产效率高的特点[26]。
1994 年,第2 个获批上市的抗体药物阿昔单抗(abciximab-GPⅡb/Ⅲa)是由哺乳动物细胞表达重组人鼠嵌合IgG 抗体,经木瓜蛋白酶消化获得显著降低其免疫原性的Fab 片段,用于治疗克罗恩病及类风湿性关节炎的培塞利珠单抗(certolizumab pegol-TNFα)是来源于大肠杆菌表达系统的人源化F(ab′)2。我国自主研发的美妥昔单抗(metuximab-HAb18G)是鼠源F(ab′)2,偶联碘[131I]用于治疗晚期肝癌。
scFv 抗体片段是由抗体重链的可变区(VH)与轻链的可变区(VL)在一段肽链的连接下构成的小分子抗体。如双特异性T 细胞衔接器(bispecific T cell engager)类型的双特异性抗体——博纳吐单抗也属于小分子抗体范畴。
单域抗体(single-domain antibody,SdAb)是只包含单一可变区(VH/VL)的抗体。第一个单域抗体是从骆驼科动物体内发现的,又称纳米抗体(nanobody)。单域抗体体积小、穿透能力强、能够结合传统抗体所不能触及的位点,如结合酶的活性中心[27-28],进入实体肿瘤内部[24],穿过血脑屏障[29],为免疫治疗提供了新的思路。单域抗体稳定性强,可以耐受极端pH、高离子强度、蛋白酶存在、高温[30-33]等极端情况。2019年,首个单域抗体药物卡拉西单抗(caplacizumab-vWF)获批上市,用于获得性血栓性血小板减少性紫癜的治疗。
3 抗体药物在新型冠状病毒肺炎治疗中的应用
抗体药物在肿瘤杀伤、自身免疫病治疗、移植后免疫抑制均发挥重要作用,其在感染性疾病,尤其是病毒感染相关疾病的预防和治疗中,也有不可替代的作用[34]。
当前,新型冠状病毒肺炎(coronavirus disease 2019,COVID-19,以下简称新冠肺炎)疫情蔓延全球,严重威胁人们的身体健康和生命安全。而新型冠状病毒(SARS-CoV-2,以下简称新冠病毒)中和抗体是人类对抗病毒的有力武器,在疾病的预防和治疗中都发挥了重要作用。目前已经获批使用的新冠病毒中和抗体药物(以下简称新冠抗体药物)共6个(图2),适应证为具有进展至重度或住院高风险的轻、中度COVID-19成年患者[35-37]。
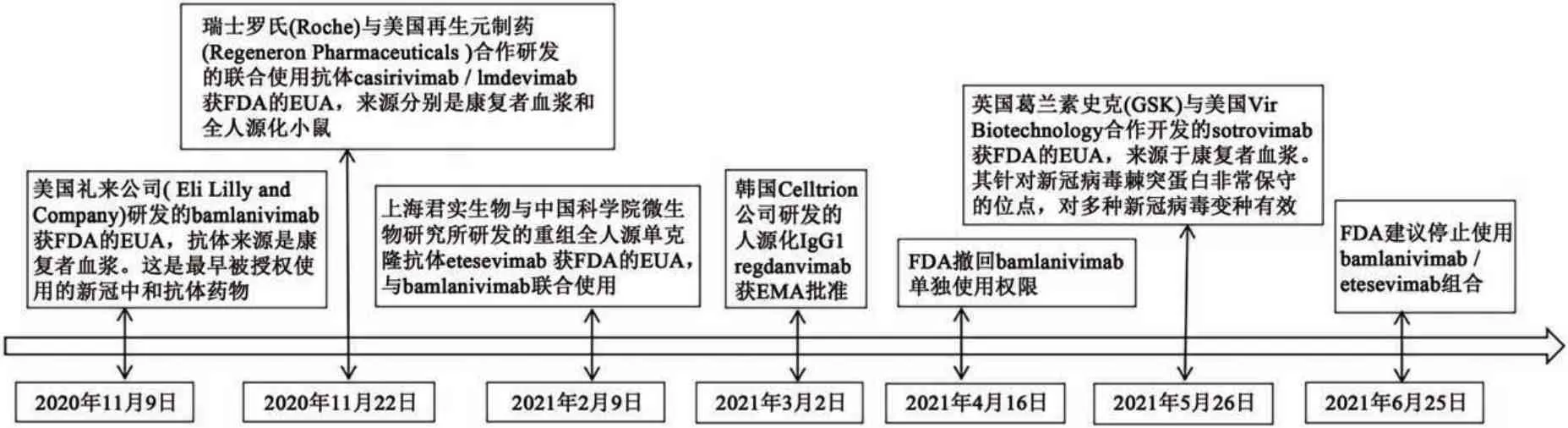
图2 新冠抗体药物发展时间轴Fig.2 Timeline of antibody drug development of COVID-19
新冠抗体药物来源包括:恢复期患者血浆、基因工程重组抗体以及转基因人源化小鼠。由于恢复期患者来源的中和抗体有活性及浓度的差异,难以标准化,来源珍贵,推广困难[37]。利用基因工程技术及转基因人源化小鼠生产抗体则是更好的选择。如利用噬菌体展示技术可以高效、低成本、大批量地生产抗体药物。
不同机构研发的新冠抗体药物靶点为新冠病毒表面刺突蛋白的不同位点。使用单一的抗体药物容易诱导病毒变异和进化,从而对现有的中和抗体产生逃逸[38]。如bamlanivimab 单独使用导致的新冠逃逸突变率达10%[37]。为此,科学家们提出了两种解决方案。一是研发针对病毒刺突保守位点的抗体药物[39],如sotrovimab,其针对的保守位点若突变会影响病毒的功能,但通常保守位点难以接触及开发。另一解决方案为“鸡尾酒疗法”,通过联用针对不同位点的多种抗体来避免逃逸。如抗体药物组合bamlanivimab/etesevimab 和casirivimab/imdevimab。但由于病毒变异性较强,bamlanivimab/etesevimab 组合在获批近5 个月后被FDA 建议停止使用。
4 展望
经过数十年的发展,抗体药物研发生产技术逐渐成熟与完善,抗体药物在生物治疗药物的市场上占据重要地位,具有广阔的发展前景。抗体药物研发领域以下几点有待发展和完善。
4.1 完善抗体技术,提高基因工程来源抗体药物比例
以人血浆来源的抗体药物成分复杂,来源稀少,不能满足巨大的市场需求,且存在伦理问题和潜在的危险性,而来源于动物的抗体药物免疫原性较强,容易引起过敏反应,如我国抗狂犬病毒免疫球蛋白(rabies immunoglobulin,RIG)主要来源于供浆员血浆和马血清,不可避免存在以上问题[41-42]。因此,利用基因工程技术生产抗体是有效的解决方案,其技术成熟,可以对抗体进行改造,流程规范,易于标准化大规模生产。如重组抗狂犬病毒单克隆抗体(rRIG)相关产品SIIRMab(Rabishield)和RabiMabs(Twinrab)已分别于2016 年和2019 年在印度上市,但至今未获批进口[43]。在中国,由华北制药集团研制的重组人源抗狂犬病毒单抗注射液(rh-RIG)于2021 年8 月获国家药品监督管理局批准上市,相比于印度的鼠源性RIG,其人源化改造进一步减低了免疫原性。同时,基于基因工程技术大量生产的狂犬抗体能有效缓解我国巨大的RIG供应压力,降低RIG 价格,提高暴露人群注射RIG的接受度和完成度。
4.2 发展多特异性抗体,避免位点突变逃逸,减少不良反应
病毒及肿瘤的位点突变造成的逃逸是导致单位点抗体药物失效的常见原因。如针对狂犬病毒具有多种病毒株和不同表位的现象,世界卫生组织(World Health Organization,WHO)推荐,RIG 制剂应是含有结合病毒多个中和表位的多株单抗组合成“鸡尾酒”式混合制剂,以保证单抗制剂对不同基因型病毒株的有效性。新冠抗体药物的联合使用也证实了这一点。即便如此,“鸡尾酒”治疗策略仍存在许多问题,如多种抗体药物混用导致药物毒性增强而特异性未明显提高[21]。多特异性抗体是含有针对两种或两种以上具有不重叠表位的单克隆抗体产品,相比单位点抗体具有多功能和多特异性,可作为单一组分药剂靶向针对多种抗原,是更为先进和令人期待的新型抗体药物。在肿瘤治疗中,同时靶向多个受体或信号通路的多特异性抗体可以提高抗体结合肿瘤细胞的成功率。在病毒性感染中,多特异性抗体能够覆盖更多的抗原表位,对不同病毒株起效,也可避免病毒获得性突变逃逸。研究表明,HIV 三特异性抗体相比于多种单抗药物混合使用有更高的中和效能[44]。因此,相比于单位点抗体混合联用,多特异性抗体不良反应大大降低,活性更好,具有广阔的前景。
4.3 抗体药物与多种治疗策略联合使用,提高疗效
在临床应用中,不同抗体药物最佳使用剂量和应用时间还有待探索,使用抗体药物带来的不良反应也不可忽视,主要包括抗体药物的免疫原性引起的免疫反应、诱发细胞因子风暴、血细胞数量变化等[45],除了优化抗体本身,结合有效的治疗策略辅助抗体药物的使用以减少不良反应、提高药物治疗效果也是重要的措施。抗体药物在临床实际应用上也可以通过不同治疗策略的联合使用来进行一些尝试和探索,包括不同抗体药物之间的联合、抗体药物与传统化学药物的联合、抗体药物与外科手术的联合,期望在临床实际工作中相辅相成以发挥最大的效能。
4.4 建立流程,完善规范,联动合作,提高效率
目前,抗体药物的研发仍存在不少问题,包括研究缺乏创新、新的靶点难以开发、研发成本高、成功率低、临床研究进展缓慢、缺乏规范的标准等。目前主要以人源化抗体研发技术较成熟且成功上市产品占比较大。不少新型抗体药物创新性较强,研发流程尚不成熟,多处于临床前研究阶段,相关管理规定尚未出台,在一定程度上限制了抗体药物的发展。结合本次应对新冠疫情的经验,有研究认为,在流行病出现早期,研究机构与企业联动合作,加速研发有效的抗体药物是控制流行病进一步发展的重要手段[37,39]。
抗体药物已呈现出蓬勃发展的态势,随着技术的革新与标准的完善,难题终将逐个被攻破,成为更加有效、精准、个性化的治疗手段,更广泛地应用于临床。

