一种基于配体肽的CRP荧光检测探针的研制
王思雅, 韩雨灏, 李针保, 张婷婷, 梁佳欣, 林卉丰, 张淑华
长春理工大学生命科学技术学院,长春130022
C 反应蛋白(C-reactive protein,CRP)是一种急性时相反应蛋白,在炎症反应初期表达显著增加,也被称为免疫防御结合蛋白[1],其由细胞因子,如白细胞介素1、肿瘤坏死因子和白细胞介素6 刺激下的肝细胞合成。CRP 是天然免疫系统的重要组成成分,有激活补体、促进吞噬、调节免疫等作用[2]。近年来,研究表明CRP 与某些临床疾病,如结缔组织疾病、心脑血管疾病、糖尿病、自身免疫性疾病的发生和发展密切相关[3-4];同时,CRP作为标志物也可用于其他疾病的诊断与检测,包括患者病情评估及药效判断等。因此,对CRP 的有效检测具有重要的临床意义[5-6]。
目前,CRP 常使用的检测方法可分为化学分析法和免疫测定法两大类。化学分析法包括气象色谱法(gas chromatography,GC)、薄层色谱法(thin-layer chromatography,TLC)及高效液相色谱法(high performance liquid chromatography,HPLC)等,如高效液相色谱法,尽管检测灵敏度及准确度较高,可以实现定量检测,但存在操作要求高、检测时间长、设备昂贵等不足[7-8]。免疫测定法包括免疫扩散法(radial immunodiffusion,RID)、乳胶凝集法(latex agglutination method,LA)及酶联免疫(enzyme-linked immunosorbent assay,ELISA)测定法等,其中ELISA法是最常用的方法,具有高灵敏性、高特异性、操作简便、检测时间短等优点,但该方法核心产品为CRP 单克隆抗体,而抗体存在制备流程繁琐、价格昂贵、不能批量合成等不足。因此,探究一种操作简便的手段,在保证检测特异性前提下,获得CRP 特异性亲和配体,以替代价格昂贵的单克隆抗体,具有重要的临床意义。本研究以CRP 为靶标,利用噬菌体表面展示技术筛选出CRP配体序列,再通过ELISA鉴定其结合活性,利用多肽固相合成技术和生物标记技术获得CRP荧光检测探针,以期建立一种高特异性、高灵敏度、低成本检测CRP的生物学新方法。
1 材料与方法
1.1 试验材料
1.1.1 仪器 立式高速低温冷冻离心机(GL-22M,BIOBASE 公 司);凝 胶 成 像 系 统(WD-5413C,北京六一生物科技有限公司);高效液相色谱仪(Agilent 1260,杭州瑞析科技有限公司);多功能酶标仪(Tecan Infinite® 200 Pro,南京普朗生物技术有限公司);冷冻干燥机(Free zone Plus 6,美国LABCONCO 公司)。十二通道半自动多肽合成仪由吉林大学生命学院生物大分子实验室提供;质谱检测由吉林大学测试中心完成;测序工作由生工生物工程(上海)股份有限公司完成。
1.1.2 试剂 C-反应蛋白标准品(95%)、IPTG、Tetracycline、X-gal、购自Sangon Biotech 公司;Ph.D.-12TM试 剂 盒 购 自BioLabs 公 司;Tween-20 购 自OXOID 公司;BSA、Tris-base、TMB、DMSO 及96 孔细胞培养板购自Aladdin公司;鼠抗M13单克隆抗体、HRP标记羊抗鼠二抗购自美国Earth Ox公司。
1.2 方法
1.2.1 噬菌体表面展示技术筛选CRP 亲和配体将CRP 标 准 品 溶 解 于0.1 mol·L−1的NaHCO3(pH 8.6)中,配制成100 μg·mL−1,包被聚氯乙烯培养皿4 ℃过夜。次日回收培养皿中包被液,于滤纸上甩掉残留液体,加入2 mL 封闭液4 ℃静置2 h。除去封闭液,用0.1%TBST 缓冲液洗板8次。取1 mL TBST加入到培养皿中,再加入10 μL原始文库,即2×1011噬菌体,室温摇动1 h。除去未结合 的 噬 菌 体,洗 板8 次。取1 mL 0.2 mol·L−1的Glycine-HCl(pH 2.2)加 入 培 养 皿 室 温 摇 动20 min。用1 mol·L−1HCl(pH 9.1)中和溶液。取1 μL 滴度测定,剩余洗脱液进行新一轮扩增。通过计算,加入到第2轮淘选中。共进行3轮筛选,2轮非特异性洗脱和1轮特异性洗脱。
1.2.2 ELISA 法检测配体序列与CRP 结合活性将一定浓度CRP 溶液作为抗原包被96 孔板,同时,用封闭液包被3 个空白孔为阴性对照,4 ℃包被过夜。次日,于滤纸上弃去孔内残余液体,加入0.2 mL 封闭液,4 ℃封闭2 h。用缓冲液洗板3 次,加入重组噬菌体,室温孵育1.5 h,缓冲液冲洗6次。在每个反应孔加入0.1 mL 鼠抗M13 一抗(1∶1 000)室温孵育1 h,缓冲液冲洗6次。再加入0.1 mL 羊抗鼠-HRP 二抗(1∶1 000)室温孵育1 h,缓冲液冲洗6 次。0.1 mL TMB 显色15 min,用2 mol·L−1硫酸溶液终止反应。450 nm条件下读取数值并统计检测结果。
1.2.3 噬菌体ssDNA 提取及序列测定 根据ELISA 检测结果,用碘化物法提取重组噬菌体ssDNA。取 噬 菌 斑 扩 增 液,10 000 r·min−1离 心3 min,弃上清,加入1/6 体积PEG-NaCl 室温静置20 min。12 000 r·min−1离心10 min,弃上清,用0.1 mL碘化钠溶液重悬沉淀,再加入0.25 mL乙醇溶液,静置20 min。离心后用0.5 mL 的70%乙醇(提前预冷)洗沉淀,短暂真空干燥,加入30 μL TE 重悬沉淀。送样至生工生物工程(上海)股份有限公司测序。
1.2.4 荧光检测探针的合成 取适量的2-氯三苯甲基氯树脂加入到反应器中,加二氯甲烷(dichloromethane,DCM)振荡30 min 保证其溶胀充分。接第1 个氨基酸使用沙芯抽滤掉溶剂,用N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)溶解3倍摩尔过量的N-(9-芴甲氧羰基)-L-脯氨酸(Fmoc-Pro-OH)氨基酸,再加入10 倍摩尔过量的N,N-二异丙基乙胺(N,N-diisopropylethylamine,DIEA),振荡60 min。用DMF 和DCM 分别交替冲洗6 次,用甲醇进行封闭。去掉DMF,加20%哌啶/DMF(哌啶∶DMF=1∶4)溶液,振荡5 min 后将其去除。重新加入该溶液振荡15 min。抽掉哌啶溶液,用乙醇清洗树脂3 次,加入检测试剂检测,105~110 ℃加热5 min,深蓝色为阳性。分别用DMF、DCM、DMF 各清洗2 次。用DMF 将保护氨基酸和3 倍过量的O-苯并三氮唑-四甲基脲六氟磷酸盐[2-(1H-benzotriazole-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate,HBTU]溶解后加入反应器,并加入10 倍摩尔过量DIEA,反应30 min。用乙醇清洗树脂3 次后加入检测试剂检测,105~110 ℃加热5 min,无色为阴性。应用DMF、DCM、DMF 各清洗反应器2 次,循环至12 个氨基酸添加完毕。最后将肽链N端与6-氨基己酸(epsilon-aminocaproic acid,EACA)C 端相连,用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)与EACA 的N 端相连,避光反应4 h。抽干后从树脂上切割多肽,切割时间为2 h。裂解液用氮气吹干,乙醚清洗6 次,室温挥发干净。用HPLC 法将粗品提纯,探针纯品经MS鉴定。
2 结果与分析
2.1 噬菌体表面展示技术筛选CRP亲和配体
利用NaHCO3对CRP 靶分子进行溶解包被聚氯乙烯培养皿,通过增加TBST(缓冲液浓度Tween-20 由0.1%到0.5%),经过“洗脱-扩增-洗脱”循环,获得与CRP 特异性亲和的配体序列。3轮筛选后结果详见表1,回收率提高450 倍,表明噬菌体已达到特异性富集的目的。
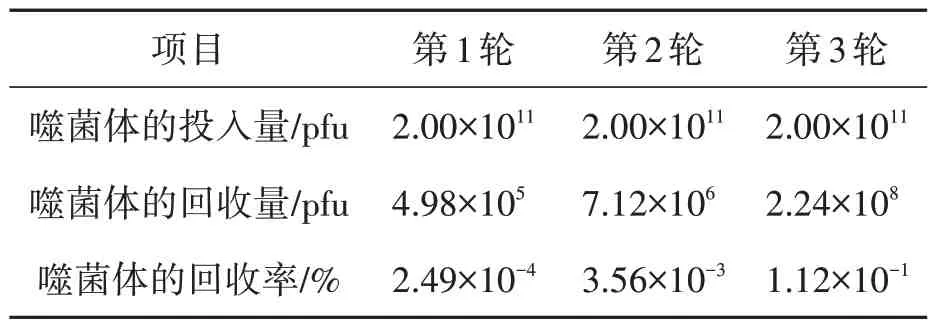
表1 采用噬菌体表面展示技术3轮筛选结果Table 1 Results of the biopanning by phage display techniques
2.2 ELISA法检测配体序列与CRP结合活性
从第3 轮洗脱物滴度测定的培养皿中随机挑取15 个蓝斑扩增(标记C1~C15),取扩增液进行ELISA 检测,测试结果详见图1。3 轮筛选后有10个克隆样本与CRP 结合活性较强(OD≥0.2);其中有6 个克隆样本(C1、C5、C8、C10、C12、C14)结合活性非常明显(OD≥0.4);5 个克隆样本(C4、C6、C9、C13、C15)结合活性较弱(OD≤0.2),表明利用噬菌体展示技术能够成功获得与CRP 靶分子特异性结合的重组噬菌体。

图1 第3轮筛选后重组噬菌体与CRP结合活性Fig.1 Binding activity of recombinant phage clone to CRP after three rounds of screening
2.3 噬菌体ssDNA的提取及序列测定
基于ELISA 测定结果,对第3 轮克隆样本进行ssDNA提取并测序。如表2所示,1号肽序列在15 个样品中共出现6 次重复,2 号和3 号肽序列分别出现2 次,其余5 条肽序列均出现1 次;1 号肽序列在15条序列中重复率最高且包含其他序列的部分基序,表明1号肽序列优于其他序列,结合ELISA检测结果,将1号肽作为目标肽进行合成。

表2 3轮筛选后重组噬菌体DNA单链序列测定结果Table2 Results of single-stranded DNA sequence of recombinant phage after three rounds of screening
2.4 荧光检测探针的合成
通过序列比对与ELISA 检测结果,最终确定1 号肽(S-P-H-N-R-S-N-L-V-Q-E-L)为与CRP 特异性亲和的配体。采用多肽固相合成法,以树脂为固相载体,将氨基酸从C 端到N 端以共价键形式进行连接。为提高检测灵敏度,用FITC 作为荧光标记物对该配体进行了标记,制成检测试剂-荧光肽探针:FITC-(Acp)-S-P-H-N-R-S-N-L-V-Q-E-L,结构如图2所示。
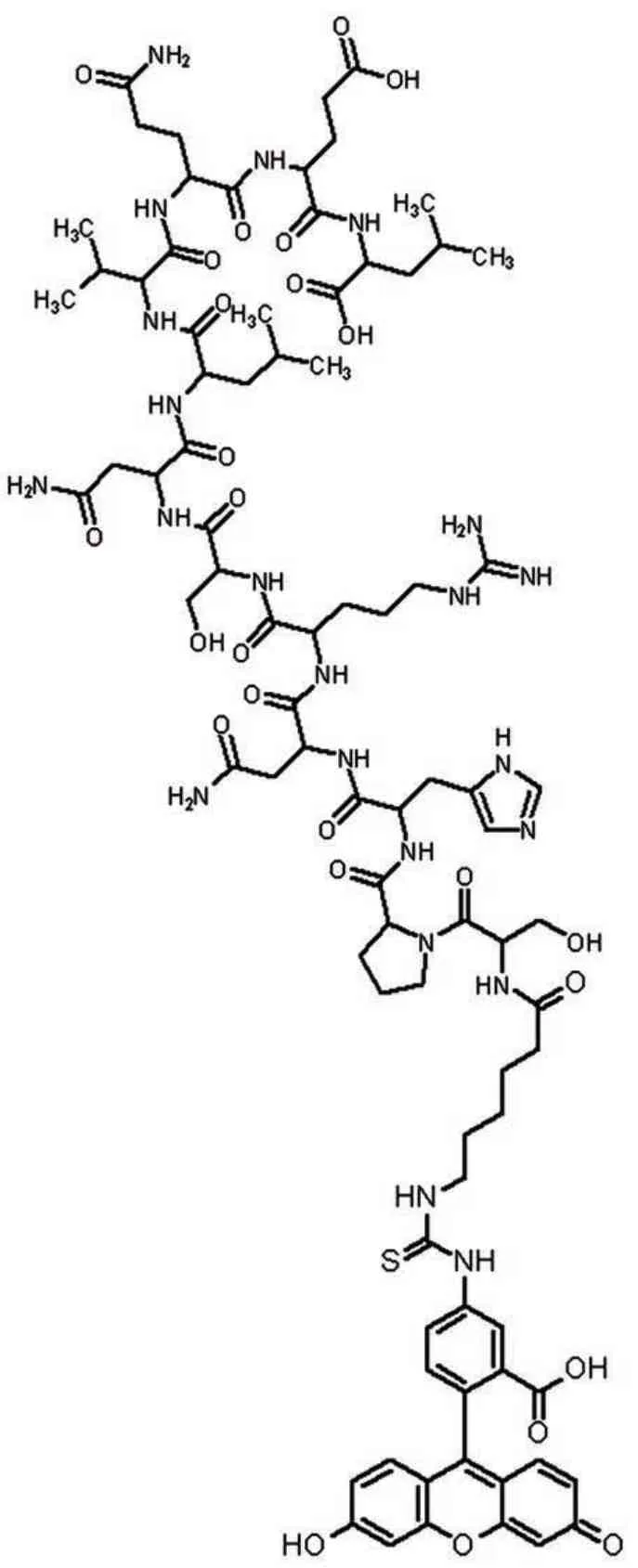
图2 CRP荧光检测探针结构图Fig.2 Structure of CRP fluorescence detection probe
采用高效液相色谱仪对探针粗品进行提纯后收集(图3),回收主峰处纯度最高的样品,冻干成固体粉末,HPLC 分析结果显示,纯度可达94.37%。经质谱鉴定(图4),分子质量为1 896.08,荧光探针实际分子量与理论计算分子量相符。结果表明,合成荧光探针标记的配体肽正确。
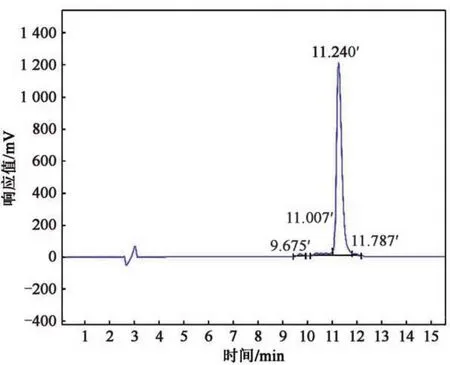
图3 CRP荧光检测探针HPLC分析图Fig.3 HPLC analysis of CRP fluorescence detection probe

图4 CRP荧光检测探针质谱鉴定图Fig.4 Mass spectra identification diagram of CRP fluorescence detection probe
3 讨论
CRP 是一种高度保守的五聚体蛋白,在临床上作为机体感染和损伤的非特异性炎症标志物[9],对CRP的有效检测一直是临床关注的热点。近年来,人们不断探求快速检测CRP 的新方法。噬菌体展示技术目前被广泛用于抗原表位的分析、生物大分子配体的筛选、蛋白质-DNA 结构和功能研究[10]。如罗俊茜[11]和朱锡群等[12]利用该技术筛选小分子功能肽并成功用于检测。Guo[13]和Sompunga 等[14]利用噬菌体展示技术成功筛选大分子抗体片段。本研究根据分子间特异性相互作用原理,利用噬菌体表面展示技术最终得到CRP特异性亲和配体序列,且该技术筛选出的配体分子与靶标结合活性高,特异性强。
多肽固相合成技术是采用化学手段将氨基酸按照一定顺序定向缩合成多肽或蛋白质的技术[15],该方法能最大程度上保护主链的完整结构,与经典的液相肽合成技术相比,具有快速、高效、易批量合成等优点[16],已成为多肽合成的常用手段。本研究采用的2-氯三苯甲基氯树脂具有交联性好、易于过滤、机械性能强等特点,且该树脂与氨基酸连接过程温和,无需额外导入反应基团从而影响后续实验结果。在生物标记技术中,同位素常被作为标记物进行分子标记,尤其是放射性同位素的使用会造成污染[17],而FITC 作为免疫标记中使用率较高的荧光素之一,具有较高的光吸收性、良好的水溶性,能够在一定波长范围内产生可检测的荧光信号,稳定性强,且不具有污染性。本研究选择小分子材料EACA 为桥,一端与FITC连接,另一端与配体肽连接,既保证了制备的荧光探针具有稳定的空间结构和高灵敏度,又不影响与靶分子的结合能力。
虽然本研究制备的荧光检测探针能够在一定程度上替代CRP 单克隆抗体,但由于探针分子量较小,导致与靶分子结合的空间位点较少,因此,与相应靶分子结合的牢固性弱于单克隆抗体大分子,且结合活性也会受到影响。基于此,在后续的研究中可采用抗体库进行筛选,并考虑引入计算机模拟技术和分子对接技术,对得到的序列进行结构设计、修饰及优化,以提高探针与靶分子的结合能力,进一步增强特异性,达到高灵敏度、高特异性、低成本检测CRP的目的。

