外泌体PD-L1 在非小细胞肺癌患者血清中的表达及其临床意义
童晶涛,张三典,贺婷婷,郑璐,杨梓汝,许权,章慧
免疫治疗在多种肿瘤中取得了显著 的疗效,其中包括非小细胞肺癌(NSCLC)。肿瘤组织中的PD-L1 表达水平是目前免疫治疗的重要预测因子。有研究发现,PD-L1不仅存在于肿瘤细胞膜表面,还存在于细胞外,主要包括可溶型PD-L1(sPD-L1)和外泌体PD-L1(ePDL1)[1]。本研究检测分析NSCLC 患者血清中ePD-L1 的阳性表达及其与患者临床病理参数的关系,探索其在不同特征NSCLC患者中的表达情况,现报道如下。
1 资料与方法
1.1 一般资料 收集2019 年1 月至2020 年12 月宁波市医疗中心李惠利医院放疗科和呼吸科收住的经病理确诊的NSCLC 肺癌患者82 例,男62 例,女20例。收集同期20 例健康人血清样本。记录所有研究对象的临床资料,包括患者性别、年龄、吸烟状况、肿瘤大小、淋巴结转移、远处转移、临床分期及病理类型等。本研究通过医院医学伦理委员会审批。
1.2 方法
1.2.1 外泌体的提取 用EDTA管采集全血,用1900 r/min 转速离心10 min,转移上清到新的离心管中。离心机4 ℃预冷,3000 r/min 离心15 min,弃沉淀。将上清液移至新的离心管内,2000 r/min离心30 min。取上清,4℃,10000 r/min 离心45min。将上清置于0.45 m 滤膜过滤,后4 ℃,100000r/min 离心70min。取沉淀用10 ml PBS 重悬,再次4℃,100000r/min 超速离心70min,得到外泌体沉淀物。去上清后用150 l预冷的PBS重悬,-80℃保存。
1.2.2 外泌体的鉴定 取外泌体10 l,铜网上沉淀1 min,加醋酸双氧铀10 l沉淀1 min,滤纸吸净残余液体。常温干燥数分钟后进行电镜检测。
1.2.3 外泌体径粒检测 将外泌体取出20 l,加入980 lPBS 中并充分混匀。1ml注射器吸取所有液体加入马尔文仪器加样槽,设置好样本名称及稀释度后进行NTA 检测。最终测得粒子浓度为50 倍稀释后的浓度。
1.2.4 外泌体总蛋白提取 将外泌体与6×RIPA裂解液混匀,冰上裂解30min。取5 l 样品加入到BCA 试剂中混匀,37 ℃孵育30 min。上机测量,调节酶标仪吸光度值为562 nm 处,测量吸光度值,计算蛋白浓度。
1.2.5 Western-Blot 检测外泌体中PDL1 的表达 配制浓度12%SDSPAG电泳胶;将电泳装置装好后,加入适量电泳缓冲液。取出蛋白样品,进行上样。采用湿转方式,300mA 转膜60min,5%脱脂牛奶室温下摇床封闭1 h。将配制好的一抗溶液(抗体稀释比例均为1∶1000)加入抗体盒中,4 ℃孵育过夜。回收一抗后用TBST洗3 次,再进行牛奶封闭3 次。加入按1∶5000 配在5%脱脂牛奶PBS 溶液中的二抗溶液,室温摇床孵育1 h。回收二抗后用TBST 室温下洗膜3 次。用等体积混合的ECL A/B 液混合液浸泡PVDF膜,按照规范,设置好参数,进行曝光。
1.2.6 ELISA 法检测外泌体中PD-L1表达量 采用酶联免疫吸附试验(ELISA)检测ePD-L1,试剂盒购自美国Raybiotech 公司,严格按试剂盒说明书操作,每份样本重复检测3 次。
1.3 统计方法 采用SPSS20.0 统计软件进行分析,计量资料以均数±标准差表示,采用t 检验。P <0.05 为差异有统计学意义。
2 结果
2.1 NSCLC 患者血清中外泌体鉴定透射电镜下外泌体的形态呈明显的茶托状,纳米颗粒跟踪分析结果显示外泌体粒子直径范围在131 nm左右,呈现正态性分布。见图1。
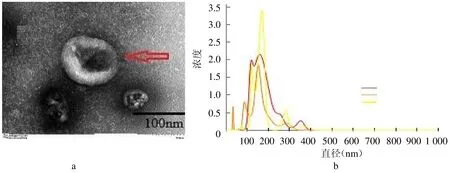
图1 NSCLC 患者血清中外泌体
2.2 NSCLC 患者与健康人群血清中ePD-L1 蛋白的表达差异 NSCLC患者血清中ePD-L1 蛋白表达较健康人群对照组明显增高,外泌体标记物CD9 在两组中的表达无明显差异。见图2。
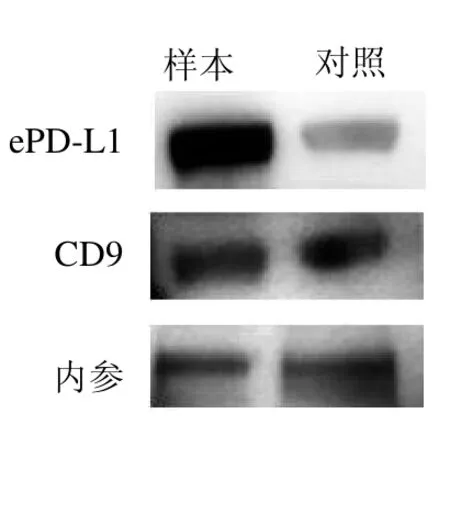
图2 NSCLC 患者血清中的外泌体ePD-L1 表达
2.3 NSCLC 患者与健康人群血清中ePD-L1 的表达差异 NSCLC患者血清中ePD-L1 表达浓度较健康人群明显增高,见图3。以ePD-L1 与外泌体总蛋白的比值作为校正浓度(ePD-L1/pro),结果显示NSCLC 患者血清中ePD-L1/pro 较健康人群明显增高,见图4。
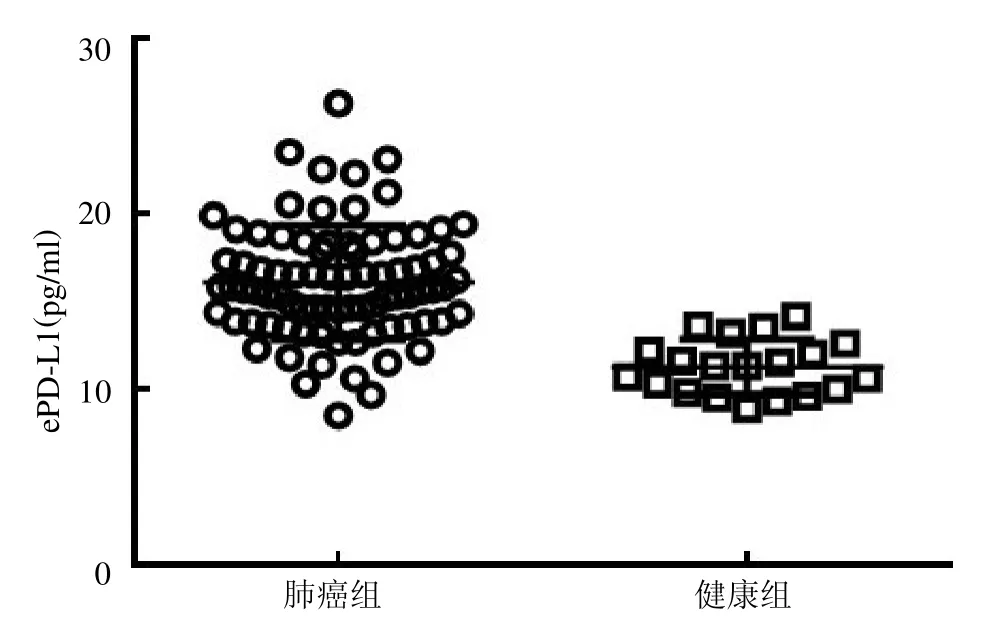
图3 NSCLC 患者血清中的ePD-L1 表达量
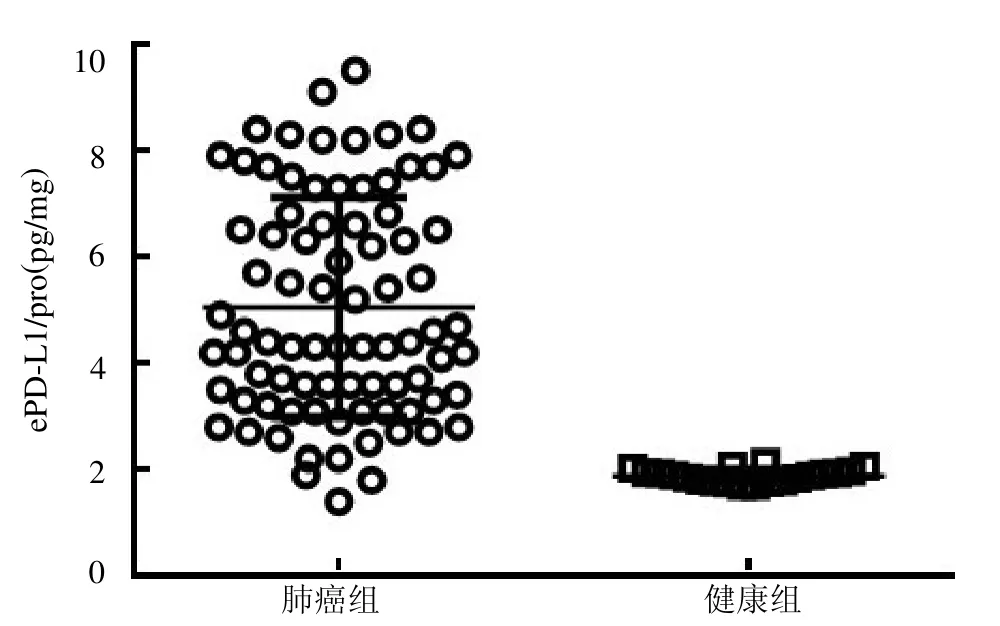
图4 NSCLC 患者血清中的ePD-L1/pro
2.4 血清外泌体PD-L1 表达与NSCLC患者临床病理特征的关系 血清ePD-L1表达在性别、病理类型上差异均无统计学意义(均P>0.05);但在年龄、吸烟、肿瘤大小(T 分期)、淋巴结转移(N 分期)、远处转移(M 分期)及肿瘤INM 分期中差异均有统计学意义(均P <0.05)。血清ePD-L1/pro 表达在年龄、性别、病理类型及吸烟上差异均无统计学意义(均P >0.05);在T 分期、N 分期、M 分期及肿瘤INM 分期中差异均有统计学意义(均P<0.05)。见表1。
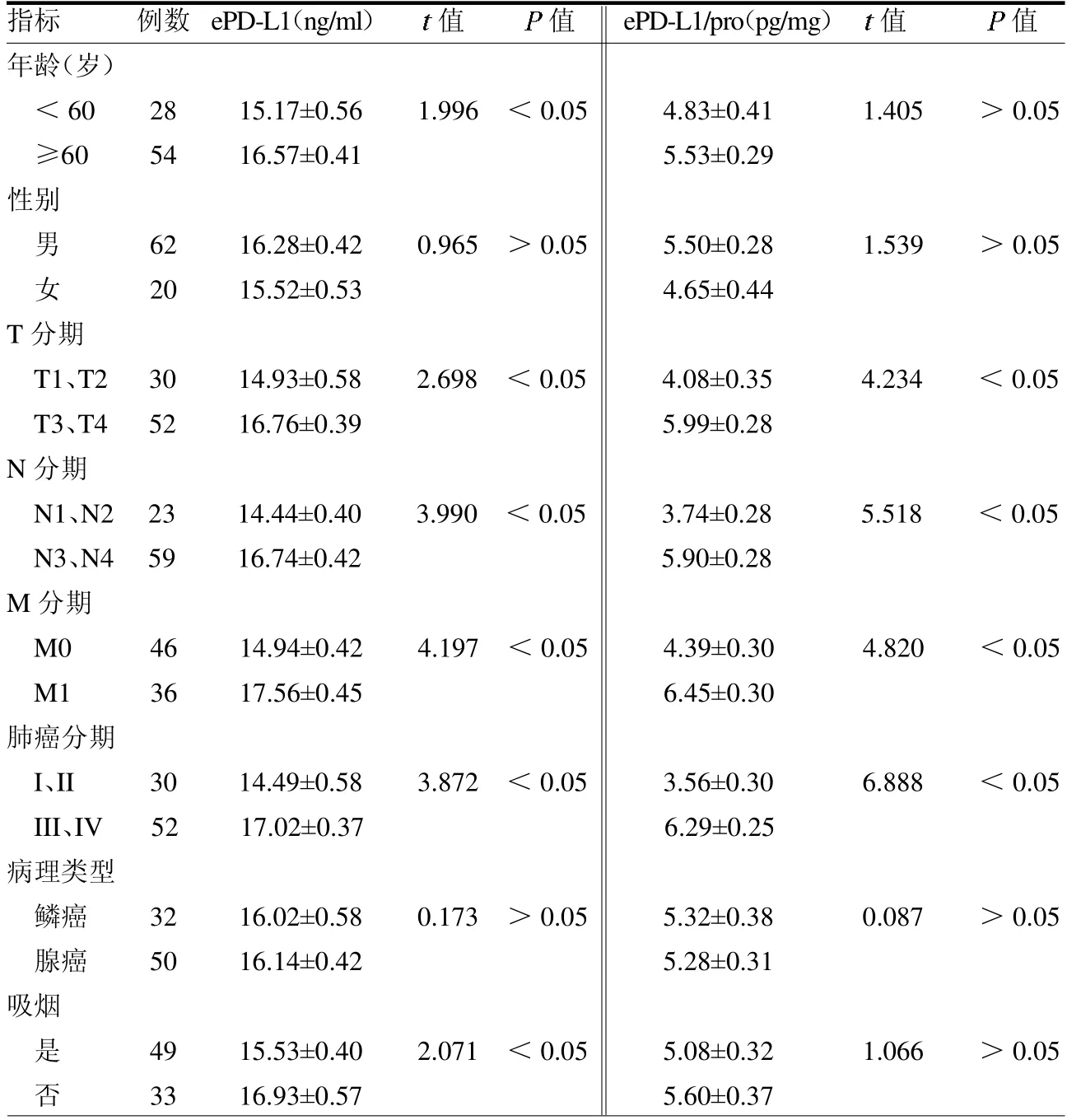
表1 血清ePD-L1 表达与NSCLC 患者临床病理特征的关系
3 讨论
外泌体是细胞分泌的一种微小的膜性囊泡物质,直径50~150 nm,密度介于1.12~1.19 g/ml,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,通过胞吞进入临近细胞,释放其中的DNA、miRNA及蛋白质和脂质成分,在细胞之间进行信息传递,继而影响细胞的生长、增殖及迁移等多种生物学活动[2-3]。而PD-L1 作为目前免疫治疗的重要靶点,通常表达于肿瘤细胞膜,与T 细胞膜上的PD-1 相结合,激活PD-1/PD-L1 的抑制信号通路,抑制T细胞的活化,促进肿瘤细胞的生长[4]。近期研究发现,肿瘤细胞除了在胞膜上表达PD-L1 外,还能释放含有PD-L1 的外泌体,如恶性黑色素瘤、头颈部肿瘤、乳腺癌及脑胶质瘤等肿瘤中均发现了ePD-L1 的表达[1,5-7]。ePDL1 相对于细胞膜PD-L1 更稳定,不易被蛋白水解酶降解[8],因此在诱导肿瘤免疫抑制的微环境和生物功能的调节上发挥了重要作用,有望成为肿瘤临床治疗的新靶点[9]。
本研究结果显示透射电镜下外泌体呈明显的茶托状,粒子直径范围在131nm左右,呈现正态性分布,与文献[10]报道类似。本研究还发现在肿瘤患者和健康对照者血清中ePD-L1 的表达差异明显,肿瘤患者血清中ePD-L1 的表达明显高于健康对照者。同时,ELISA 定量分析结果显示肿瘤患者血清中ePD-L1 的表达浓度明显高于健康对照者。为了更精准地显示两者的差异,本研究设定了ePD-L1与外泌体总蛋白比值作为校正浓度,结果发现肿瘤患者血清中的ePD-L1/pro 也明显高于健康对照者,进一步提示两类人群中ePD-L1 的表达差异。
本研究结果发现肿瘤患者血清中ePD-L1 及ePD-L1/pro 表达浓度在T 分期、N 分期、M 分期及肿瘤TNM 分期中差异均有统计学意义(均P <0.05),这表明ePD-L1 的表达与肿瘤进展有关。这结果与文献[11-13]类似,提示ePD-L1在肿瘤的发生发展中同样有着重要的作用。
——外泌体与老年慢性疾病相关性的研究进展

