增强MR组学联合临床因素预测肝细胞癌根治性切除术后早期复发的价值研究
杨浩然,张濬韬,马密密,邹林轩,曹新山*
作者单位:1.滨州医学院附属医院放射科,滨州 256603;2.通用电气医疗精准医学研究院,上海 210000
原发性肝癌是我国目前第4位常见恶性肿瘤及第2 位常见肿瘤致死病因[1],肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的类型,占85%~90%。HCC根治性切除术是肝脏储备功能较好的HCC 患者获得长期生存的主要治疗方式,但潜在术后复发风险较高,其中早期复发即根治性切除术后两年内复发占总体复发的70%以上[2],这与HCC肝内转移、多灶性发生、微血管侵犯(microvascular invasion,MVI)等生物学行为密切相关[3-4]。并且早期复发患者较远期复发患者预后更差[5],因此及时识别HCC 切除后早期复发相关的敏感生物学标志物至关重要,这将有助于HCC患者的分类和及时干预,提高生存率。目前,已有多种实验室指标及影像学征象将HCC预后预测与治疗选择相结合[6-7],然而,这些预测因子大多不针对预后效果,其预测HCC 术后复发方面的价值有限。
影像组学运用医学图像推断分子肿瘤数据,再通过计算机算法从大规模的数据集中进行学习,是传统影像学与分子生物学、信息科学等多学科的结合。影像组学研究已在HCC 临床诊断与预后预测方面展现出明显优势[8-9],但评估HCC 术后早期复发的研究较少。本研究通过探究增强MR 影像组学模型联合临床因素预测HCC 术后早期复发,旨在为优化早期HCC 手术预后评估方案提供新的思路与方法。
1 资料和方法
1.1 研究对象
回顾性分析2015 年1 月至2020 年12 月于滨州医学院附属医院放射科行肝脏MRI 检查的患者病例资料。纳入标准:(1)经HCC 根治性切除术后,病理组织学确诊为HCC 的患者;(2)术前4 周内行MRI 检查的患者;(3)单发肿瘤的HCC 患者。排除标准:(1)既往有HCC 治疗史或合并其他恶性肿瘤的患者;(2)联合接受其他抗肿瘤治疗(如经动脉化疗栓塞、靶向治疗、放疗等)或姑息治疗;(3)自术后第一天起随访时间不足12 个月。共计116 例病例被纳入研究。根据随访结果是否复发将病灶分为早期复发和未复发两类。通过Python 中sklearn 库随机数发生器将整个队列按7∶3 的比例随机分为训练集和验证集,训练集82 例,验证集34 例。所有图像信息均在滨州医学院附属医院PACS 系统进行采集,按照纳入和排除标准收集患者术前以下四个磁共振序列图像:T2 加权成像(T2 weighted imaging,T2WI)、扩散加权成像(diffusion weighted imaging,DWI)、表观扩散系数(apparent diffusion coefficient,ADC)、动态对比增强MRI (dynamic contrast enhanced MRI,DCE-MRI),以DICOM格式导出。
1.2 临床数据及随访方法
常规的术前临床数据和实验室检查从医院的电子病历系统中收集。临床数据包括年龄、性别、是否有肝炎病史、肝硬化状态、Child-Pugh 分级以及肿瘤TNM 分期(美国癌症联合委员会第8 版癌症分期)。术前1 周内获得的实验室指标,包括血清甲胎蛋白(AFP)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)和白蛋白等临床资料。以实验室检查、腹部影像学[超声、增强计算机体层摄影(computed tomography,CT)或增强MRI]以及病理结果为随访诊断标准。若实验室检查或超声检查怀疑肿瘤复发可能,则进行增强CT 或MRI 检查进一步明确,否则每6 个月常规进行1 次增强CT 或MRI 检查。随访截至2020 年12 月31 日的病例。终点为复发(剔除不能确定死亡原因病例),其定义为具有典型HCC影像学特征的新的肝内复发和/或肝外复发,或术后12个月内病理学证实的复发。
1.3 MRI检查参数
MRI扫描使用GE DISCOVERY 750W 3.0 T磁共振扫描仪,获取所有患者的轴位T2WI、DWI及DCE-MRI序列图像,扫描参数:T1WI:TR 4.5 ms,TE 1.7 ms,FOV 380 mm×380 mm,层厚5 mm,矩阵256×192;T2WI:TR 6667 ms,TE 90.5 ms,FOV 380 mm×320 mm,矩阵256×256,层厚6 mm;DWI:TR 8000 ms,TE 69.8 ms,FOV 400 mm×320 mm,矩阵380×380,层厚6 mm,b值选取0、800 mm2/s;DCE-MRI:TR 4.5 ms,TE 1.7 ms,FOV 380 mm×380 mm,层厚5 mm 矩阵256×192。DCE-MRI扫描时使用自动注射器在预扫描后以2 mL/s的流率注射对比剂钆特酸葡胺,对比剂使用剂量0.2 mL/kg,等量生理盐水冲洗。注射对比剂后分别在0 s (早期前期)、11 s (动脉早期)、37 s (动脉晚期)、136 s (静脉期)进行扫描,获得增强扫描的4 期图像。
1.4 图像分割及影像组学特征提取
图像分割软件为3D Slicer (Version 4.10.2)[10]。图像分割由具有5 年腹部MRI 诊断经验的放射科医师1 运用3D Slicer 中的“Segment Editor”模块在DCE-MRI 图像逐层手动勾画病灶ROI (图1),HCC 大多为肝动脉供血的富血供肿瘤,增强扫描动脉期图像上,肝动脉强化,而肝静脉无强化。动脉晚期与动脉早期相比,HCC 在这一阶段表现出更高强化。此外,少部分肝癌仅在动脉晚期才显示高强化[11]。因此选择DCE-MRI 增强后第三期(37 s,动脉晚期)作为影像组学分析的期相。勾画病变时同时参考T2WI、ADC、DWI 序列图像以提高准确性。由1 名具有20 年腹部磁共振诊断经验的医师2 审核医师1 的图像分割工作,如医师2 对医师1 分割后的感兴趣区(region of interest,ROI)有质疑,则医师2 与医师1 协商达成一致结果或由医师2 对医师1 的分割结果做出相应修改。通过Python 中的Pyradiomics[12]提取勾画得到的ROI 中的影像组学特征。

图1 男,64岁,肝细胞癌。1A:轴位动脉晚期病灶;1B:勾画病灶边界;1C:填充病灶;1D:对整个病灶进行逐层分割,绿色区域表示用于提取影像组学特征的ROI的轮廓;1E:感兴趣区的三维(3D)体积重建。Fig. 1 A 64‑year‑old male with histologically confirmed HCC. 1A: The late arterial stage on axial direction; 1B:Draw the boundary of the lesion;1C: Fill in the lesion;1D: layers segmentation of the whole lesion illustrated, the green area represent the delineations of the ROIs used to extract the radiomics features; 1E:Three‑dimensional(3D)volumetric reconstruction of the ROI.
1.5 影像组学评分模型的构建与验证
本研究中使用了两种特征选择方法,最大相关-最小冗余算法(maximum correlation minimum redundancy,mRMR)和最小绝对值收缩和选择算子(least absolute shrinkage and selection operator,LASSO)来选择特征。首先,对冗余和不相关的特征使用mRMR 缩小范围,保留的特征再通过LASSO进行筛选,LASSO回归结果中相应系数不为零的特征被保留,进行10 折交叉验证以选择最优的λ值,并同时得到相应影像组学特征的系数,通过将所选的多个特征乘以各自的系数进行线性组合,计算出每例患者的影像组学评分(rad-score),采用Wilcoxon 秩和检验分别比较训练集、测试集中影像组学评分的差异是否有统计学意义。最后通过影像组学模型计算出每例患者患HCC的概率,绘制ROC曲线评估预测模型在训练集和测试集数据中的诊断效能。
1.6 临床-病理因素联合影像组学列线图模型的构建及验证
收集到的临床-病理因素:年龄、性别、肝功能分级、是否合并肝炎、肝硬化状态、术前甲胎蛋白水平、临床TNM 分期、MVI 分级、AFP、ALT、AST、ALP、白蛋白、间接胆红素和直接胆红素。定量数据以平均值±标准差表示,分类数据以百分比表示。采用单因素分析比较未复发与复发组间临床因素的差异,输入单因素分析中的显著性变量,采用多因素Logistic 回归建立临床-病理因素模型。结合影像组学评分和临床因素,采用多变量Logistic 回归方法建立联合模型,以联合模型的预测评分绘制了列线图。利用ROC曲线评估列线图预测精度。采用Hosmer-Lemeshow检验,并以此绘制校准曲线(calibration curve)用于评估模型预测概率和实际概率之间的拟合度。将仅考虑临床因素构建的模型与列线图模型进行比较,Delong 检验用于比较列线图和临床模型的AUC 差异是否具有统计学意义,最后通过决策曲线来评价模型的临床净收益率。分别运用影像组学评分,临床模型,联合列线图模型计算出每例患者患HCC 的概率,通过ROC 曲线评价各个模型的诊断效能。
1.7 统计分析
采用R统计软件(Version 4.1.0)进行统计分析。计量资料以均值±标准差表示。采用Wilconxon秩和检验比较训练集、测试集中影像组学评分的差异是否具有统计学意义。以受试者工作特征(receiver operating characteristic,ROC)曲线评价各模型预测HCC根治性切除术后早期复发效能,计算相应的曲线下面积(area under the curve,AUC),并采用Delong检验比较各模型AUC 的差异,P<0.05 为差异有统计学意义。使用Hosmer-Lemeshow检验,并以此绘制校准曲线用于评估联合模型预测概率和实际概率之间的拟合度。通过决策曲线分析(decision curve analysis,DCA)来评价联合模型的临床净收益率。
2 结果
2.1 患者资料
在82 例训练集病例中,40 例术后未复发,42 例术后早期复发;34 例测试集病例中,17 例术后未复发,17 例术后早期复发。患者一般资料的分类信息见表1,从表1 的数据可以得出训练集中复发与未复发病例的年TNM 分期,甲胎蛋白水平,γ-谷氨酰氨基转移酶,Child-Pugh 分级组间差异有统计学意义(P<0.05)。

表1 患者一般资料Tab.1 General information of patients
2.2 特征选择、影像组学模型的验证
从每个病例的ROI区域图像中提取了805个特征,经过mRMR 筛选保留30 个特征,再通过LASSO 回归及10折交叉验证得到最优的λ值(图2A、2B),对应的子集中确定9 个影像组学特征,9 个特征名称分别为wavelet_LLH_glrlm_GrayLevelNonUniformityNormali zed、log_sigma_4_0_mm_3D_gldm_DependenceVariance、wavelet_HLL_glszm_LowGrayLevelZoneEmphasis、wave let_HHH_firstorder_Uniformity、wavelet_HHL_glcm_SumSquares、 original_glcm_SumEntropy、 wavelet_HLH_glszm_LowGrayLevelZoneEmphasis、wavelet_HHH_firstorder_Median、original_firstorder_Kurtosis(图2C),经过Wilcoxon秩和检验,未复发和早期复发的影像组学评分差异具有统计学意义(图2D)。影像组学模型的AUC为0.79 (95%CI:0.69~0.88) (图3)。

图2 影像组学模型的构建。使用最小绝对值收缩和选择算子(LASSO)进行影像组学特征筛选。2A:调整参数λ使拟合损失值二项偏差最小,以筛选最优影像组学特征;2B:筛选最优影像组学特征的系数收敛图;2C:选定的9个特征及其系数;2D:训练集和验证集中每个患者的影像组学评分。Fig. 2 Construction of the radiomics signature. Radiomics feature selection using the least absolute shrinkage and selection operator (LASSO) Logistic regression model. 2A:Adjusting the parameter λ to minimize the binomial deviation of the model fitting loss value, in order to select the best radimics characteristics;2B:Radiomics feature selection using the LASSO Logistic regression model; 2C:The selected 9 features and the values of their coefficients; 2D:The Radiomics scores(Rad‑scores)for each patient in the training and test set.
2.3 联合模型列线图的验证
TNM 分期、甲胎蛋白水平、γ-谷氨酰氨基转移酶、Child-Pugh分级等临床因素与HCC切除术后早期复发的相关性建立临床模型,并结合影像组学评分得出早期复发风险评分的联合模型列线图(图4A)。仅使用临床因素构建的模型,训练集的AUC 为0.77 (95%CI:0.67~0.87),验证集的AUC 为0.71 (95%CI:0.52~0.90);联合模型的训练集AUC为0.87 (95%CI:0.79~0.94),验证集AUC为0.79 (95%CI:0.63~0.96) (图3)。DeLong 检验,联合模型与临床因素模型训练集ROC 比较,Z=2.363,P=0.018,影像组学模型与临床因素模型训练集ROC比较,Z=0.191,P=0.849。
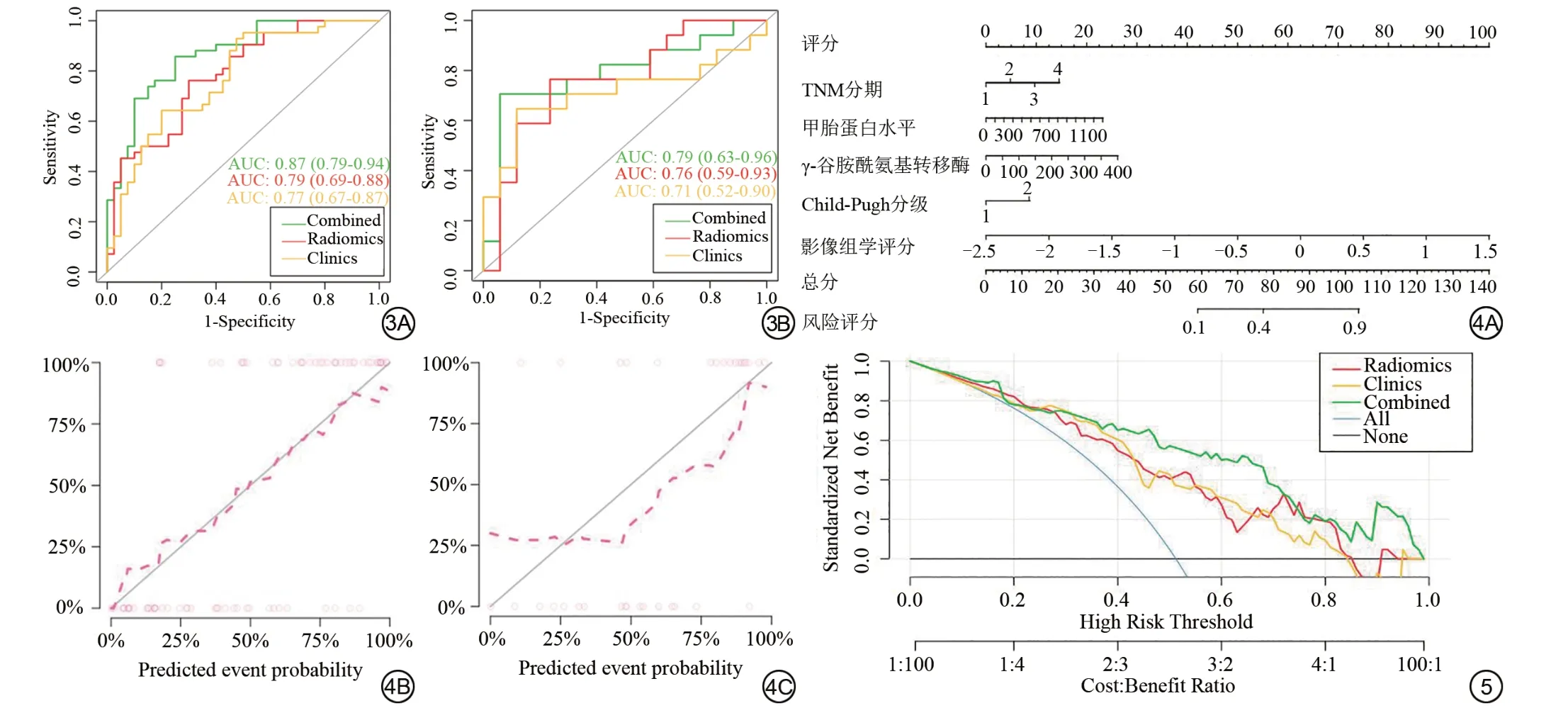
图3 训练集(3A)和验证集(3B)中的临床模型(黄色)、影像组学模型(红色)和联合模型列线图(绿色)的受试者工作特征(ROC)曲线。 图4 列线图和校准曲线。4A:临床因素结合Rad‑score 构建联合模型列线图;4B~4C:校准曲线表明训练集(4B)和验证集(4C)的列线图校准良好。 图5 决策曲线。红线代表影像组学模型,黄线代表临床模型,绿线代表列线图联合模型,对三个模型进行决策曲线分析,y轴和x轴分别表示标准化净收益和高风险阈值概率。蓝色线代表所有患者未复发的假设,水平黑线代表所有患者早期复发的假设。与临床因素模型和影像组学模型相比,联合模型列线图提供了更高的净收益。Fig 3 The receiver operator characteristic(ROC)curves of the clinical factors model,the radiomics model and the combined model nomogram,respectively in the training set 3A and test set 3B. Fig. 4 Nomogram and Calibration curve. 4A: The radiomics nomogram is constructed by combining clinical factor model and Radiomics score(Rad‑score).4B,4C:The calibration curves indicate good calibration of the nomogram in the training and test sets.Fig.5 Decision curve analysis for the three models (The red line represents the imaging omics model, the yellow line represents the clinical model, and the green line represents the rosette combination model).They‑axis andx‑axis indicate the net benefit and the threshold probability, respectively.The blue line represents the hypothesis for all patients without recurrence, while the horizontal black line represents the hypothesis for all patients with early recurrence.The nomogram provides a higher net benefit than the clinical factors model and the radiomics.
训练集拟合优度H-L 检验P=0.633,验证集拟合优度H-L 检验P=0.147,预测值与真实值之间差异无统计学意义(图4B、4C)。决策曲线显示,联合模型决策曲线在高风险阈值概率0.4~0.6段与临床模型和影像组学模型相比明显偏上(图5)。
3 讨论
根治性手术切除是目前最常采用的HCC 治疗方式[13],然而早期复发仍是导致患者术后五年内生存率降低的重要因素。多灶性和MVI 等肿瘤生物学行为已被确定为早期复发的危险因素,但是这些因素中的大多数只能在术后评估。因此在术前确定可靠的早期复发预测因子对于患者风险分层、治疗决策支持和长期生存改善至关重要。目前已经有相关研究将影像组学应用于肝癌手术的预后评估,Akai等[9]通过影像组学特征结合随机森林模型分析了肝癌切除术预后风险因素,得出影像组学评分作为高危个体风险(风险比=1.06,P=8.4×10-8)是预后不利影响因素之一。Mao 等[14]提取术前297 名HCC 患者的影像组学特征并结合临床因素训练机器学习模型,AUC 值为0.80,高效预测了HCC的术前病理分级,协助评估HCC患者的复发风险。
3.1组学模型的价值
本研究使用MRI 动态对比增强图像作为影像组学分析期相,MRI相对于CT的主要优点是对比度分辨率高,同时能对肝内和病灶内的脂肪和铁含量进行定量分析,而且能同时使用细胞外和肝细胞特征性对比剂。根据最近文献报道,对于肝脏病变的定位和定性,MRI具有比CT更高的诊断准确率[15]。通常诊断HCC 常规使用钆对比剂多期增强扫描加脂肪抑制获得的T1 加权快速回波扫描MRI (肝动脉期及随后的门静脉期和延迟期)以及DWI 等序列,其中肝动脉期特别是动脉晚期能够获得较好的病变强化信息[16]。同理与CT 相比MR 的影像学的多参数特性,体现在影像组学特征上,则HCC 患者MR 图像中所对应的高通量信息相比较CT图像更多,可提取参数数量更庞大,同时也需要排除更多弱相关性及冗余参数。因此在本研究中,采用mRMR算法评估避免特征间的冗余,经初步筛选后再通过LASSO 结合多折交叉验证对剩余特征进行降维,最终得出小于10个特征,以防止过拟合,得到的9个特征中,3个对预后生存不利的回归系数要明显高于6个有利特征。LASSO是一种同时进行特征选择和正则化的回归分析方法,尤其适用于高维数据的降维,同样的LASSO 正则化Logistic 回归也是对预测因子数量远远超过观测数的连续变量的有效选择策略,经过这些特征训练,9 个特征被合并成一个Rad-Score,该评分在训练集和测试集中表现了良好的预测效果(AUC 分别为0.79、0.76),符合多预后因素的组合比单一因子具有更好的预测性能的统计观点。
3.2 联合模型的价值
Rad-Score可作为一个独立的生物学标志物,在本研究中引入了部分临床因素建立联合模型,已有研究表明MVI、术前血清AFP、肿瘤直径等临床指标是导致HCC患者根治性切除术后早期复发风险增加的危险因素[17-18],可以提示HCC 术后情况。本研究从临床因素筛选出HCC TNM 分期,AFP、Child-Pugh分级以及γ-谷氨酰胺基转移酶指标。在联合模型列线图的五个组成部分中,可以看出单一临床因素的量化指标均与实际临床应用相符,其中TNM 分期主要划分依据是肿瘤原发灶情况,肿瘤原发灶的大小是HCC早期复发的重要危险因素,随着肿瘤增大,早期复发率升高。在本研究中MVI 的多因素逻辑回归P值>0.05,未列入早期复发的独立危险因素。AFP 是HCC 肿瘤标志物,用于HCC 诊断、疗效评估、复发监测及预后评估等方面,AFP 水平是HCC 早期复发的危险因素[19]。在本研究中,术前血清AFP 水平与早期复发密切相关。Child-Pugh 分级是对肝硬化患者肝脏储备功能进行量化评估的分级标准,也是肝脏术前的评估手术风险的重要参考,较差的肝功能储备对预后影响明显,在本研究中B 级相对于A 级有更高的复发风险。γ-谷氨酰胺基转移酶升高主要受肝内合成亢进影响,与AFP联合检测,可提高肝癌诊断正确率,其对早期复发的相关性与AFP 接近。Rad-Score 模型ROC 曲线训练集和验证集AUC (分别为0.79、0.76)与临床因素模型AUC (分别为0.77、0.71)相比较高,但Delong 检验显示Rad-Score 模型与临床因素模型之间ROC 差异无统计学意义(P值=0.8488),这表明两个模型对预测术后早期复发效能接近。考虑到我们收集到的大多数HCC病例为单发,且被排除的少数多发肿瘤HCC 病例并不能确定哪一处病灶对复发的影响更大,因此为了控制这个不确定因素对模型效能的影响,在我们的研究中,只纳入了单发肿瘤的HCC 患者,这一研究设计可能与临床因素模型的AUC相对较低有关。按照传统分期系统,这些患者属于早期或中期,更适合手术治疗[20],在多发肿瘤的HCC 病例中临床分期及实验室检查的提示作用更显著。联合模型在训练集和测试集上AUC (分别为0.87、0.79)均高于前两者,校准曲线显示联合模型预测概率与实际概率之间具有良好的拟合度,当前数据集中的信息利用较充分;另外联合模型的DCA偏高于另外两个模型,结合Delong检验结果,联合模型与临床因素模型ROC 差异具有统计学意义(P值=0.018),提示联合模型的临床预测净收益率要高于另外两个模型。综上所述,基于增强MR的影像组学特征已被证明是HCC患者早期复发的一个有效的术前预测指标,综合临床因素和MR 组学特征模型效能及临床净收益率较高,可帮助临床医生选择适合HCC患者的治疗方案。
3.3 局限性和展望
本研究为初步探索性研究,单中心,样本量相对较小,回顾性研究存在潜在的信息偏倚,图像质量如信噪比、重采样参数对显示肿瘤异质性信息有较大影响,可能造成预测结果的稳定性差,虽然所有MR图像都是在统一的MR 扫描仪中采集的,并具有标准化的成像采集序列,提取特征时的统一重采样及提取后的数据预处理,以减少我们结果的偏差,但其他机构的外部验证是必要的。因此在后续的研究中,我们将引入外部验证或者组成多中心研究,获取更大样本量数据做进一步验证。另外Kierans等[21]的研究发现肿瘤环形强化等影像学形态特征也是早期复发的独立预测因子,已有相关研究证明肿瘤周围区域内的影像组学特征具有临床应用价值[22]。本研究选择MR 增强动脉晚期(注射对比剂后37 s采集)图像进行影像组学特征提取,仅是该时相的肿瘤内部影像组学数据模型,有所偏颇;相较动脉晚期,动脉早期没有背景强化的干扰,能更清晰显示分支动脉信息,延迟期有假包膜强化对肿瘤周围影像学特征显示更确切,DWI提供了有关组织细胞密度和细胞膜完整性的信息[23],较多文献认为HCC 多序列、动态多图像影像组学综合分析更接近肿瘤异质性实际状况[24]。上述研究给我们提供了新的思路,今后,我们将用多序列多期相MR 影像组学验证HCC 肿瘤影像形态学及肿瘤周围强化特征因素,并综合这些因素所体现的HCC肿瘤周围和内部影像组学特征建立预测模型,以提高增强MR 组学模型对HCC根治性切除术后早期复发的预测效能。
作者利益冲突声明:全部作者均声明无利益冲突。

