初烤和复烤对烟叶真菌群落结构的影响
成 瑜,刘 京,高英明,3,周家喜,芶剑渝,管景强,邹 晓*,
1. 贵州大学生命科学学院真菌资源研究所,贵阳市花溪区甲秀南路515 号 550025
2. 贵州省烟草公司遵义市公司,贵州省遵义市汇川区人民路341 号 563000
3. 贵州大学农业生物工程研究院,贵阳市花溪区甲秀南路515 号 550025
烟草是我国重要的经济作物,从新鲜烟叶到成品卷烟,采收后的烟草需经过初烤、复烤和储存陈化等一系列加工过程[1-2]。其中初烤和复烤是决定烟叶品质和产量的关键环节,对烟叶真菌群落结构有重要影响[3-4]。初烤过程包括低温高湿的变黄阶段、高温中湿的定色阶段和高温低湿的干筋阶段[5],复烤过程包括真空回潮、润叶、打叶和复烤等加工环节[4]。
陈乾丽[3]研究发现初烤和复烤过程中烟叶所处的自然和加工环境会提高霉菌污染的概率,增加烟叶霉变的风险。烟叶霉变可影响烟叶的外观和品质,降低烟叶的使用价值,造成了巨大的经济损失[6-7]。Welty 等[8]研究表明曲霉和青霉等真菌是引起烟叶霉变的主要微生物。目前关于霉变烟叶真菌群落组成的研究已有大量报道。赵文姬[9]采用稀释平板法分离出云南霉变烟叶真菌38株,经鉴定分别属于曲霉属、青霉属、根霉属、毛霉属和木霉属。陈乾丽等[10]通过高通量测序技术研究发现贵州兴义地区烤后霉变烟叶中的优势属是曲霉属、青霉属和链格孢属等。Zhou 等[11]对吉林、贵州和上海3 地霉变陈化烟叶的研究发现,其优势真菌类群为曲霉属、耐干霉菌属和节担菌属。然而,目前大多数研究主要集中在引起烟叶霉变真菌的种类和数量,而这些真菌具体于哪个加工阶段在烟叶上富集的相关研究还鲜见报道。为此,采用高通量测序技术对贵州湄潭、平坝和惠水3地4个加工阶段(初烤前、初烤后、复烤前和复烤后)的烟叶真菌群落进行检测,旨在进一步探究在烟叶加工过程中霉菌富集的主要阶段和变化过程。
1 材料与方法
1.1 样品采集
2019 年7 月至12 月在贵州省遵义市湄潭县、安顺市平坝县和黔南州惠水县3地的烟田、烤房和复烤厂采集了初烤前(新鲜烟叶)、初烤后、复烤前和复烤后4个加工阶段的烟叶样品。初烤前烟叶:在烟叶成熟期,采用五点取样法,从田间(20 m×20 m)随机采收15片烟叶[12]。初烤后烟叶:从烤房的上层、中层和下层随机各选择5片烟叶并混合。复烤前烟叶:在烟叶真空回潮前的烟堆中随机抽取15片烟叶并混合。复烤后烟叶:在复烤结束时随机收集500 g烟叶。共采集到12 个样品,样品均为中部叶,品种为云烟87。将样品置于无菌袋储存于-80 ℃冰箱中。
1.2 真菌总DNA提取、PCR扩增及高通量测序
采 用E.Z.N.A.®soil DNA kit 试 剂 盒(美 国Omega 公司)提取烟叶表面和内部微生物总DNA,提取后采用1%的琼脂糖凝胶电泳检测其品质,使用NanoDrop2000 紫外-可见分光光度计(美国Thermo Scientific公司)检测DNA浓度。使用正向引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和 反向 引物ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌内源转录间隔区(ITS1)区域。PCR扩增反应体系(20 μL):5×TransStart FastPfu 缓冲液4 μL,2.5 mM/L dNTPs 2 μL,上游引物(5 μM/L)0.8 μL,下游引物(5 μM/L)0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 2 μL,ddH2O 补足至20 μL。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,从变性到延伸共30 个循环;72 ℃延 伸10 min,4 ℃保 存。PCR 产 物 使 用AxyPrep DNA 凝胶提取试剂盒(美国Axygen Biosciences公司)进行纯化,并使用QuantiFluor™-ST微型荧光计(美国Promega公司)进行定量。经处理的PCR扩增产物由上海美吉生物医药科技有限公司完成Illumina MiSeq测序。
1.3 数据处理
1.3.1 序列处理及OTUs注释
根据Overlap关系将Miseq测序得到PE reads进行拼接,对序列质量进行质控和过滤,根据序列首尾两端的Barcode和引物序列区分样品得到有效序列,校正序列方向获得优化序列。
通过UPARSE 7.0.1090软件[13](http://drive5.com/uparse/)对 序 列 进 行OTUs(Operational Taxonomic Unit,操作分类单元)聚类,聚类相似度水平为97%。选择OTUs 的代表性序列通过RDP Classifier 2.2 软件[14](http://rdp.cme.msu.edu/)与Unite Release 8.0 数据库(http://unite.ut.ee/index.php)进行物种分类注释。使用Mothur 软件(https://www.mothur.org/wiki/Download_mothur)计算各组样本的α多样性指数,包括香农(Shannon)指数、辛普森指数(Simpson)、Ace指数、Chao指数、Sobs指数及覆盖度指数。
1.3.2 真菌群落动态变化分析
根据物种注释和丰度信息,分析不同加工阶段优势真菌类群,其中相对丰度小于0.01%的物种归为“其他”。在属水平上选择了总丰度排名前35 个类群,利用热图分析不同加工阶段样品中优势真菌类群的变化。利用韦恩图分析OTUs 在不同加工阶段的数量差异。利用LEfSe系统分析不同加工阶段样品间存在显著差异的物种(LDA=2)。利用FUNGuild 数据库(http://www.stbates.org/guilds/app.php)解析不同加工阶段烟叶真菌的营养方式(Trophic mode)和对环境资源的吸收利用方式(Guild)。使用SPSS 20.0 软件对α多样性指数进行差异性分析。
2 结果与分析
2.1 高通量测序结果
如图1 所示,随着样品序列数的增加,Shannon-Winner 指数曲线越趋向平坦,表明本试验中测序的数据深度可较全面地反映测序样品中微生物信息。
图1 Shannon-Winner指数曲线Fig.1 Shannon-Winner index curves
经优化处理,12 个样本共检测到834 184 条有效序列,189 990 454 个碱基,平均每个样本60 441~74 962条序列,序列长度为140~531 bp。本次检测中共鉴定出4个门、23个纲、71个目、196个科、445个属和1 171 个OTUs。由表1 可知,反映物种多样性的香农指数和辛普森指数值分别在1.80~2.43 和0.25~0.34之间,反映真菌丰富度的Chao指数和ACE指数分别在353.30~423.82和275.58~429.52之间,Sobs指数在298.00~384.67之间。4个加工阶段样品覆盖度指数均达0.98以上,表明本次测序数据合理。
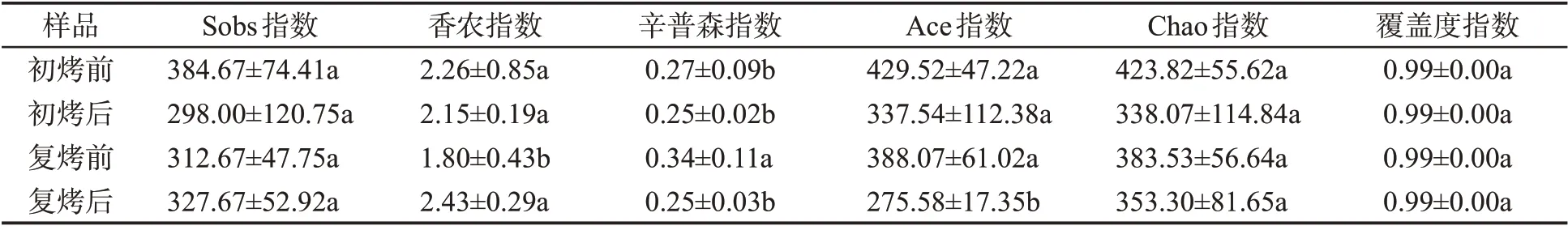
表1 不同加工阶段烟叶真菌α多样性指数①Tab.1 Alpha diversity index of tobacco leaf fungi of different processing stages
2.2 真菌群落组成
在门水平上,担子菌门(Basidiomycota)和子囊菌门(Ascomycota)为4个加工阶段共有优势菌门;其次是毛霉门(Mucoromycota)(图2)。担子菌门相对丰度下降幅度较大(从初烤前的73.56%降至复烤后的52.1%),而子囊菌门相对丰度上升幅度较大(从初烤前的26.21%上升至复烤后的47.26%)。
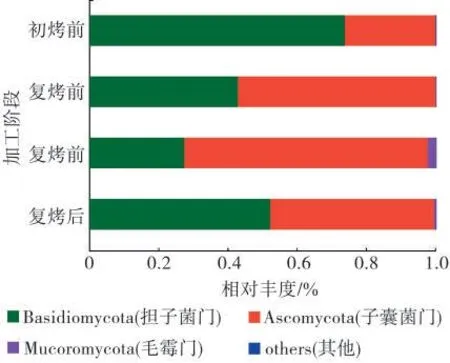
图2 不同加工阶段烟叶真菌群落组成(门水平)Fig.2 Tobacco leaf fungal community composition at phylum level of different processing stages
物种相对丰度柱状图(图3)表明,在属水平上,初烤前优势属为 Sampaiozyma、枝孢菌属(Cladosporium)和Symmetrospora 等。初烤后优势属为Sampaiozyma、链格孢属(Alternaria)、未分类的亚隔孢壳科(Didymellaceae)真菌和枝孢菌属(Cladosporium)等。 复烤前优势属为曲霉属(Aspergillus)、Sampaiozyma 和根霉属(Rhizopus)等。复烤后优势属为Sampaiozyma 和曲霉属(Aspergillus)等。Sampaiozyma 是4 个加工阶段共有优势属,在各阶段其相对丰度分别为44.27%、37.87%、24.12%和46.12%。曲霉属(Aspergillus)在初烤前的相对丰度仅为0.05%,在初烤后、复烤前和复烤后相对丰度分别 为2.86% 、60.82% 和25.78% 。 链 格 孢 属(Alternaria)在初烤前的相对丰度为0.5%,初烤后其相对丰度达到18.42%,复烤后降至1.3%。未分类的亚隔孢壳科(Didymellaceae)真菌和枝孢菌属(Cladosporium)的相对丰度也呈现初烤后上升和复烤后下降的趋势。而初烤前相对丰度较高的Symmetrospora在后3个加工阶段中持续降低。
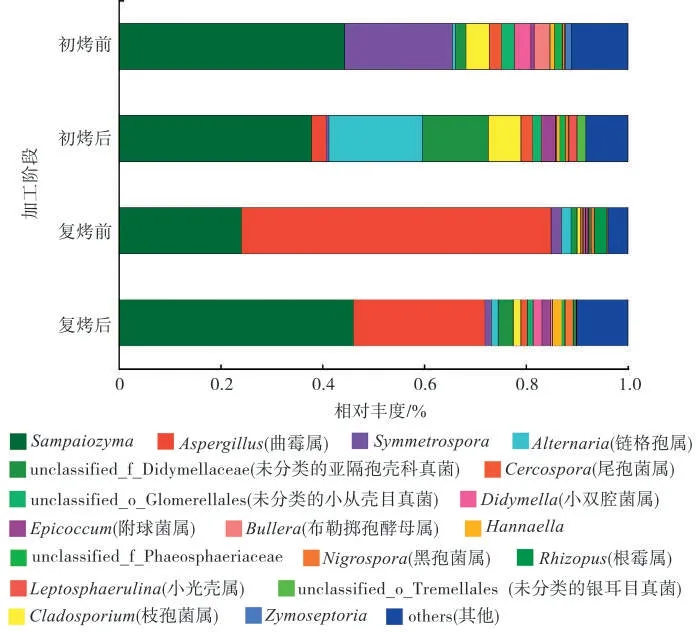
图3 不同加工阶段烟叶真菌群落组成(属水平)Fig.3 Tobacco fungal community composition at genus level of different processing stages
层次聚类热图(图4)表明,初烤前和复烤后的群落结构较相似,故先聚为一类,再与初烤后真菌群落聚类,最后与复烤前真菌群落聚类。结果表明初烤后和复烤后的真菌群落差异较小,复烤前的真菌群落与初烤后和复烤后的真菌群落差异较大,这意味着初烤后的真菌群落在复烤前产生了变化,在复烤后又发生了变化。整个群落变化规律为初烤前烟叶中微球黑粉菌纲的Sampaiozyma 和囊担子菌纲的Symmetrospora 占优势;初烤后烟叶中微球黑粉菌纲的 Sampaiozyma 和座囊菌纲的枝孢菌属(Cladosporium)和链格孢属(Alternaria)占优势;复烤前烟叶中散囊菌纲的曲霉属(Aspergillus)、微球黑粉菌纲的Sampaiozyma、座囊菌纲的链格孢属(Alternaria)和节担菌纲的节担菌属(Wallemia)占优势;复烤后微球黑粉菌纲的Sampaiozyma和散囊菌纲的曲霉属(Aspergillus)占优势。
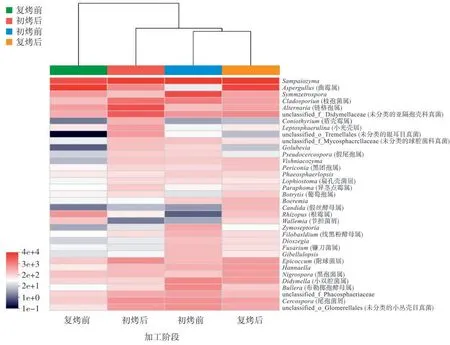
图4 不同加工阶段烟叶真菌的聚类热图(属水平)Fig.4 Clustering heatmap of fungi at genus level of different processing stages
2.3 不同加工阶段烟叶OTUs数量变化
由图5 可知,4 个加工阶段的真菌种类存在差异。初烤前、初烤后、复烤前和复烤后烟叶的共有OTUs 数量为228 个(占所有OTUs 数量的19.47%)。较初烤前,初烤后、复烤前和复烤后OTUs 数量分别下降了18.45%、22.67%和15.21%。初烤前、初烤后、复烤前和复烤后烟叶的特有OTUs 数量分别为201、102、89 和128 个,分别占所有OTUs 数量的17.16%、8.7%、7.6%和10.93%,其中初烤前特有OTUs数量最多。初烤前烟叶的OTUs 数量和特有OTUs 数量均高于另外3个加工阶段。
2.4 LEfSe物种差异分析
不同加工阶段LEfSe物种差异分析结果见图6,LDA值表示每个组分(物种)相对丰度对差异效果影响的大小。结果表明,在能够检测到的属水平上(排除Norank 和Unclassified 的类群)各样本之间LDA值>2.0 的真菌类群有6 个,分别是初烤前的Bannoa属和赭霉属(Ochroconis),复烤前的曲霉属(Aspergillus)和 节 担 菌 属(Wallemia),复 烤 后 的Cutaneotrichosporon和青霉属(Penicillium)。
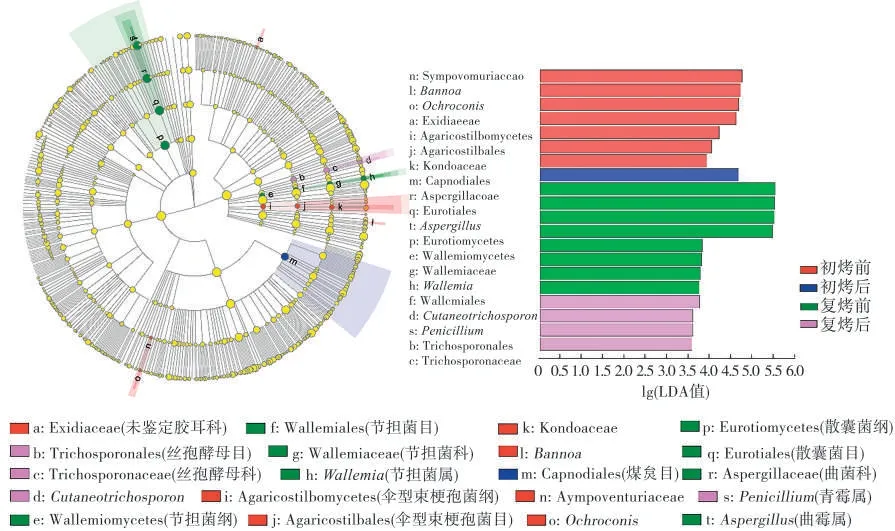
图6 不同加工阶段烟叶LEfSe物种差异分析图Fig.6 Analysis of tobacco leaf LEfSe species differences at different processing stages
2.5 FUNGuild功能类群预测
利用FUNGuild对烟叶真菌群落进行功能预测,结果显示4个加工阶段共鉴定出1 171个OTUs,被划分为8个真菌功能类群,即腐生菌群(Saprotroph)、共生菌群(Symbiotroph)、病理菌群(Pathotroph)、腐生-共生过渡型(Saprotroph-Symbiotroph)、病原菌-腐生-共生菌群(Pathotroph-Saprotroph-Symbiotroph)、病理寄生-腐生菌群(Pathotroph-Saprotroph)、病理寄生-共生菌群(Pathotroph-Symbiotroph)和病原-腐生-共生菌群(Pathogen-Saprotroph-Symbiotroph)。其中复烤前后的腐生菌群(Saprotroph)相对丰度均高于初烤前后,复烤前最高。
根据对环境资源的吸收利用方式,4 个加工阶段烟叶真菌可分为65 个共位群,其中在初烤前烟叶中动物病原菌-内生菌-植物病原菌-木腐菌(Animal Pathogen-Endophyte-Plant Pathogen-Wood Saprotroph)和动物病原菌-内生菌-地衣寄生菌-植物病原菌-木腐菌(Animal Pathogen-Endophyte-Lichen Parasite-Plant Pathogen-Wood Saprotroph)的相对丰度较高;初烤后和复烤后烟叶中均是植物病原菌-内生菌-植物病原菌-木腐菌(Animal Pathogen-Endophyte-PlantPathogen-WoodSaprotroph)的相对丰度较高;而复烤前烟叶中未定义腐生菌(Undefined Saprotroph)的相对丰度较高(图7)。
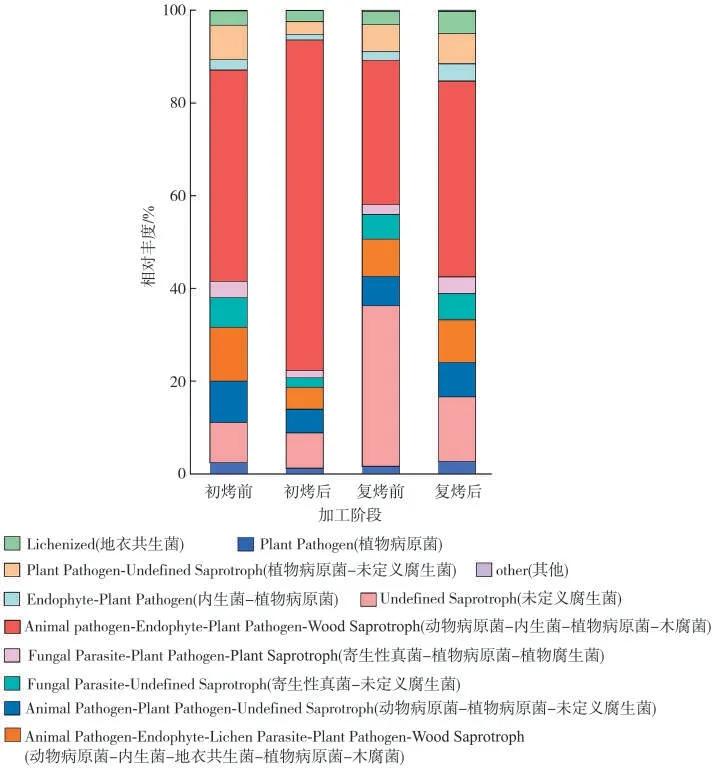
图7 基于OTUs水平注释表的真菌功能群相对丰度Fig.7 Relative abundances of fungal functional groups based on OTUs annotation table
3 讨论
真菌群落分析表明,担子菌门和子囊菌门在4个加工阶段均为优势门,这与Welty 等[15]和陈善义等[16]的研究结果一致。然而,本研究中,担子菌门相对丰度下降幅度较大(从初烤前的73.56%降至复烤后的52.1%),而子囊菌门相对丰度上升幅度较大(从初烤前的26.21%上升至复烤后的47.26%),这与Chen等[17]研究发现烘烤过程中子囊菌门相对丰度下降幅度较大,而担子菌门相对丰度变化不明显的研究结果不一致,造成此差异的原因可能是本研究中样品烟叶生长的地理环境和样品处理方式与Chen等[17]的研究不同。此外,本研究中在属水平上Sampaiozyma、曲 霉 属(Aspergillus)和 链 格 孢 属(Alternaria)是优势菌属;这与陈乾丽等[10]发现曲霉属和链格孢属是初烤后烟叶中的优势属和Zhou等[18]发现在陈化初期烟叶中Sampaiozyma 是优势菌属的结论基本一致。相比初烤和复烤前后的细菌群落[4,18-20],真菌群落的变化较小,相对稳定,这与Hu等[21]研究结果相似。Welty等[8,22]把收获前侵入到烟草中的真菌定义为“田间真菌”,在收获后侵入的真菌称为“储藏真菌”,且田间真菌很少感染烟草,而储藏真菌(主要是曲霉菌和青霉菌)在收获后侵入烟草。Christensen 等[23]和Tuite 等[24]的研究也证实,曲霉和青霉等会在收获后侵入,导致谷物变质。在本研 究 中,曲 霉 属(Aspergillus)、帚 枝 霉 属(Sarocladium)、节担菌属(Wallemia)、枝顶孢霉属(Acremonium)和根霉属(Rhizopus)等致霉真菌是初烤后在烟叶上显著富集的菌群,而青霉属(Penicillium)主要是在复烤阶段显著富集。本研究中功能预测结果表明,烟叶在初烤后腐生菌群相对丰度升高,复烤前相对丰度最高。曲霉属和青霉属为常见腐生真菌[15,25],后期腐生菌群的增加可能是由曲霉和青霉的富集引起。上述研究结果均表明曲霉和青霉等致霉真菌是在收获后侵入烟草,这与Welty等[22]的结论一致,尤其是初烤后至复烤前,复杂的环境增加了致霉真菌侵入的可能性,未来可加强此期间的霉变防治。然而,曲霉和青霉等作为常见致霉真菌,其致霉机制还鲜见报道,未来可深入研究。此外,本研究中担子菌门微球黑粉菌纲的Sampaiozyma优势地位明显。有研究[26-28]证明其为土壤及湖泊的沉积物中的野生酵母,能产生脂肪酶和果胶酶等胞外酶,但其在烟叶中的功能和特性鲜见报道,可进一步研究。
4 结论
采用高通量测序技术分析了4个加工阶段(初烤前、初烤后、复烤前和复烤后)烟叶样品的真菌群落,分析结果表明4个加工阶段烟叶的真菌群落结构存在明显差异:初烤前主要菌属为Symmetrospora、Sampaiozyma、枝孢菌属(Cladosporium)和布勒掷孢酵母属(Bullera),初烤后主要菌属为未分类亚隔孢壳科(Didymellaceae)真菌、Sampaiozyma、链格孢属(Alternaria)和尾孢菌属(Cercospora);复烤前主要菌属为曲霉属(Aspergillus)、Sampaiozyma 和根霉属(Rhizopus),复烤后主要菌属为曲霉属(Aspergillus)、Sampaiozyma 和未分类亚隔孢壳科(Didymellaceae)真菌。其中Sampaiozyma是共有优势菌属,在4个加工阶段的相对丰度分别为44.27%、37.87%、24.12%和46.12%。曲霉属(Aspergillus)是复烤阶段优势属,其相对丰度初烤前为0.05%,而复烤前和复烤后的相对丰度分别为60.82%和25.78%。

