核心素养导向的离子平衡图像试题特征及教学建议
石秀梅 黄都
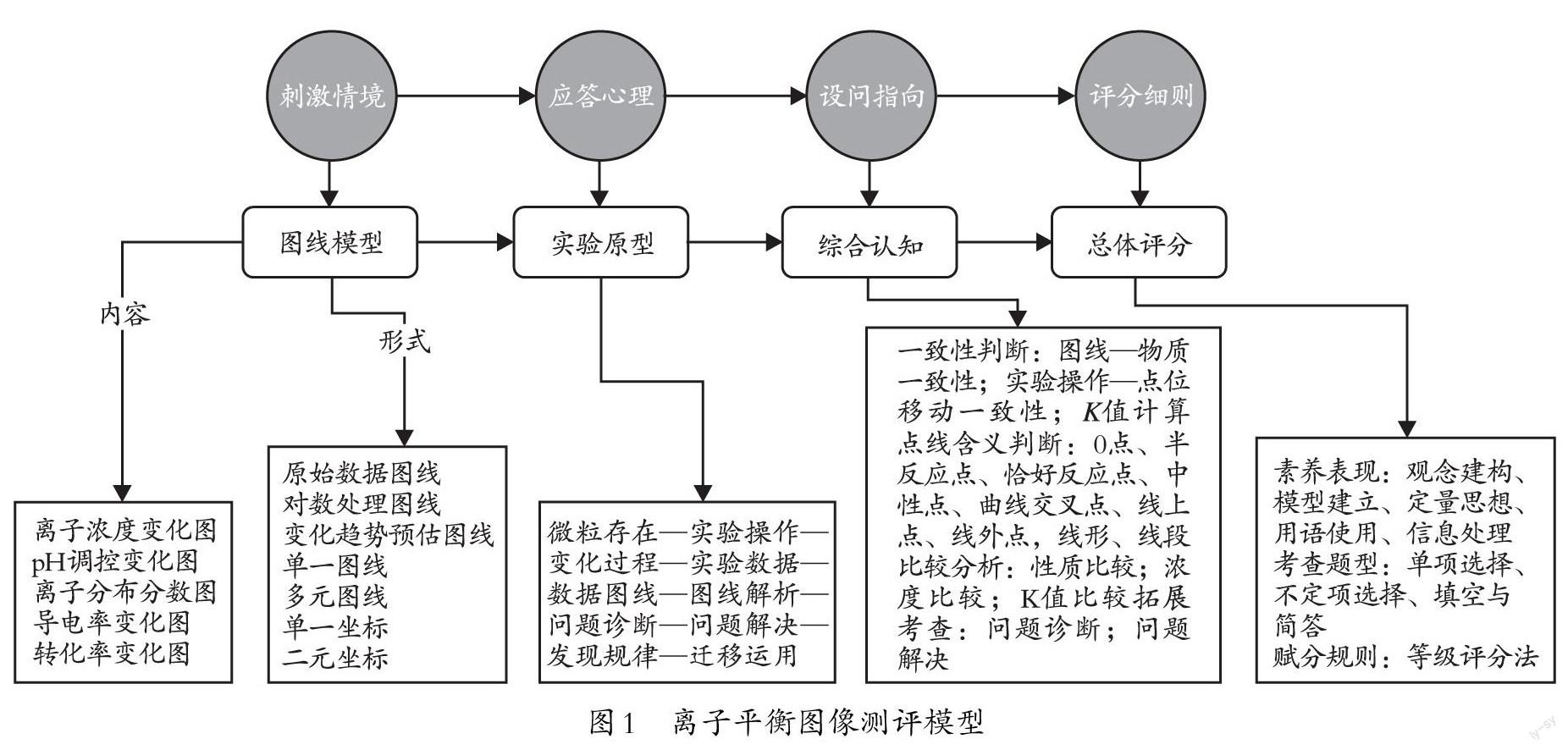

【摘要】本文阐述离子平衡图像试题的考查目标与测评价值,汇编2017—2021年高考化学全国卷离子平衡图像试题并分析试题考查的知识规律,提出有针对性的教学建议与试题命制建议。
【关键词】化学学科核心素养 离子平衡图像 试题命制 教学建议
【中图分类号】G63 【文献标识码】A
【文章编号】0450-9889(2022)20-0066-06
大规模考试的试题对教学具有指导作用。本文笔者以2017—2021年高考化学全国卷离子平衡图像试题为研究对象,归纳总结该类试题考查的知识点特征发现,这些知识点均来源于教材,但能力要求几乎都高于教材;这些知识点在教材中的呈现方式比较单一,但在试题中的呈现方式多样又抽象,且情境与设问每年都有创新。也就是说,高考试题可以作为教材内容的补充,促进学生学科核心素养的养成。
一、离子平衡图像试题的考查目标及测评价值
《普通高中化学课程标准(2017年版2020年修订)》(以下简称《新课标》)中关于“主题3:水溶液中的离子反应与平衡”的教学提示及策略为:关注水溶液体系的特点,结合实验现象、数据等证据素材,引导学生形成认识水溶液中离子反应与平衡的基本思路;通过让学生画微观图示、解释宏观现象等具体任务探察学生对水溶液体系认识的障碍点,以进一步明确教学重點和难点;发展学生“宏观辨识与微观探析”“变化观念与平衡思想”以及“证据推理与模型认知”等化学学科核心素养,培养思维能力。修订前后的课程标准在核心知识点方面的要求基本相同,但《新课标》更强调学生对核心知识模型建立过程的理解,更注重知识学习的逐阶建构和系统掌握过程。
从近五年离子平衡图像试题来看,命题者似乎试图从以下几个方面考量以达到测评目标。
(一)化学观的构建:通过分析电离平衡、水解平衡、沉淀溶解平衡等的存在及平衡移动,形成并发展学生的微粒观、平衡观、守恒观和变化观。
(二)模型的建构:水溶液中平衡常数的计算模型、pH的计算模型、水溶液中的平衡移动模型等。
(三)化学用语的熟练使用:电离方程式、水解方程式、平衡常数表达式。
(四)化学平衡中定量思想:提高定量分析问题的能力,掌握守恒法、各种平衡常数计算。
(五)信息的加工:提高用图表获取信息和加工信息的能力,能够根据各种图表分析物质的变化过程和反应原理。
笔者认为,离子平衡图像试题主要考查的素养目标是“模型认知”,辅助考查的素养目标是“宏微结合”和“变平思想”。其测评模型如下页图1所示。
测评模型指向的关键能力主要有两个方面:一是能说出模型与原型的关系;二是建立“微粒存在—实验操作—变化过程—实验数据—数据图线—图线解析—问题诊断—问题解决”的模型认知能力。具备此类素养的考生,可以通过图线来认知化学实验过程的微观变化以及化学实验创新的实际效果,为未来投身化学基础研究、化学实践应用等工作奠定能力基础。
二、离子平衡图像试题结构分析
(一)2017—2021年全国卷离子平衡图像试题汇编
1.滴定曲线
(1)与pH、分布系数及体积相关的滴定曲线
“二纵一横”坐标体系,横坐标为滴加已知浓度的NaOH溶液的体积;左纵曲线①②为体系中酸分子或酸根离子的分布系数[]如δ(A2-)=[cA2-1cH2A+cHA-+cA2-1]变化趋势图,右纵曲线③为溶液pH变化趋势图。此类图线以横坐标V为自变量,因变量是δ和pH。δ和pH并不存在一一对应关系,例如,当δ(HA-)=δ(A2-)时,对应的pH=2,而不是pH=4.8。
(2)与pH、对数相关的滴定曲线
以离子对的比值的对数值和溶液pH作为协变量,可以有效观察滴定时pH变化过程中,各类粒子浓度的大小关系及变化趋势。例如,图3中溶液pH由4.4线性增大至5.4过程中,体系中c(H2X)逐渐减小,c(HX-)、c(X2-)逐渐增大;pH=4.4时,c(H2X)=c(HX-),pH=5.4时,c(HX-)=c(X2-)。导致pH、对数值变化的因素是溶液中c(H+)的不断减少。各变量之间存在良好的线性关系,缘于特定温度下Kw、Ka[1]、Ka[2]的恒定不变性。
(3)与导电能力相关的滴定曲线
相对导电能力由电导率、离子浓度换算而成,溶液中自由移动离子浓度越大,导电能力越强。图4中,由a点到b点,是Na+和相应的阴离子浓度协同增大且同时生成水的过程;由b点到c点,是反应达到终点之后,继续滴加NaOH,导致Na+和OH-同时增大且不生成水的过程。因此,ab段的导电能力增长率小于bc段。
(4)与沉淀相关的滴定曲线
下页图5为工业上利用Cu和Cu2+在一定条件下发生归中反应除去废水中Cl-的反应进程曲线。在体系中Cu足量的情况下,c(Cu+)随着c(Cu2+)增大而增大,当c(Cu+)达到10-2mol/L时,溶液中的Cl-的基本除净。
下页图6为 AgNO3滴定的Cl-的反应进程曲线。曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl),当反应进程达到化学计量点(恰好完全反应)时,由于存在沉淀—溶解平衡,此时的c(Ag+)=
c(Cl-)=K[1/2sp](AgCl)。所生成沉淀的溶解度越小,曲线的“拐点”越上移。
2.沉淀—溶解平衡曲线
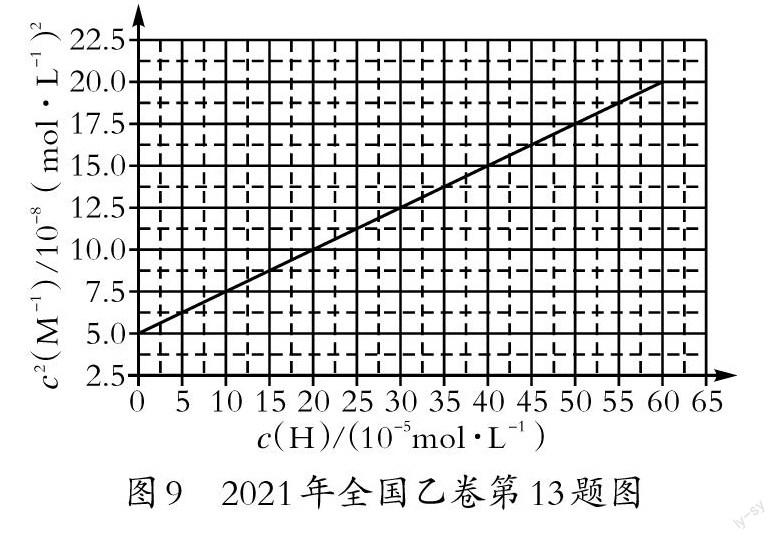
图7是沉淀—溶解平衡等温线,图8为同型难溶电解质Ksp线,图9为弱酸强碱难溶盐的酸溶曲线。这些试题均考查了不同情形中的Ksp、Ka计算及其应用。
3.分布系数曲线
分布系数描述了不同pH环境中的弱酸物料分布及其变化情况,建立了基于数据模型的离子浓度大小比较方法,为判断特定体系状态中的离子反应方程式,计算弱酸平衡常数,判定反应终点,判断物料守恒、电荷守恒等提供支持性信息。
(二)学业水平要求及体现的化学学科核心素养
离子平衡图像的原型是人为操作下的微观粒子数量关系及其变化情况,我们通过运用离子浓度、对数值、pH、分布系数、K等化学计量符号,对实验数据或假定数据进行恰当处理,发现数列之间的线性关系,进而绘制成平衡图像中的曲线模型。曲线模型的背后是数学模型、操作模型和微粒及其变化的相像模型,解答离子平衡图像试题要求学生具备较强的数学能力、化学实验能力和化学想象力。试题体现了测评的基础性、综合性和复杂性,难度较大,通常被设为压轴题。
现以2021年全国甲卷第12题为例。
例1(2021年全国甲卷)12.已知相同温度下,Ksp(BaSO4) A.曲线①代表BaCO3的沉淀溶解曲线 B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10 C.加适量BaCl2固体可使溶液由a点变到b点 D. c(Ba2+)=10-5.1时两溶液中[cSO2-4cCO2-3]=10y2-y1 从《新课标》的内容要求、模块主题学业要求、素养水平要求和学业质量水平要求等四个视角,可以系统地解构出该试题的知识传授、能力训练和素养培育功能(如表1所示)。 A、B选项设问比较直接,均是基于Ksp模型的分析和推理。C选项,运用平衡移动模型,通过定性分析和定量计算来推导结论。定性分析部分:向溶液中加入Ba2+,导致Ba2+浓度增大、阴离子浓度减小,曲线由b向a变动。定量分析部分:体系维持K值不变。D选项,c(Ba2+)相同,根据两者的Ksp大小比较,c(SO[2-4])必然小于c(CO[2-3]),即两者比值必然大于1,间接利用Ksp模型。 (三)考查的知识及调用知识的规律 1.考查的核心知识 Ka、Ksp的计算,离子浓度关系(大小关系、三大守恒关系),离子浓度变化规律。 2.调用知识的规律 有关离子浓度关系的内容因为平时训练较多,加之形式比较单一,多数学生可以较好地掌握,但面对Ka、Ksp的计算或与常数表达式变式有关的内容,学生经常觉得无从下手。教师通过分析可以总结出一定的解题模型与规律,如在温度一定的前提下,只要出现两种离子浓度比,几乎均与K的表达式有关,将0点数据或曲线交叉点数据与常数的表达式相关联,即可突破。 如解答2017年全国I卷第13题(图像如图3所示),如何确定lg[cX2-cHX-]、lg[cHX-cH2X-]与曲线的关系?此处出现两种微粒的浓度比,若在该浓度比的基础上均乘以c(H+),就得到H2X二级、一级电离平衡常数的对数,因K只与温度有关,可随意选择横坐标的0点(对应离子的浓度相等,可约掉)。经观察,两曲线对应的pH大小不一,pH小的点应为一级电离对应的点,即可知右下方直线为lg[cHX-cH2X-]。 常见试题的设问形式不尽相同,但考查的都是K表达式及其变式、K只与温度有关等知识。笔者经概括总结发现,0点、半反应点、恰好反应点、中性点、曲线交叉点,均有可能成为解答该类题型的突破口。 三、结论与建议 (一)基本结论 试题每年都在创新,情境和坐标不断变化。但无论题目怎么变,不管图像是以直线、曲线,还是以单线、双线,或是以平行线、交叉线等方式呈现,设问均紧紧围绕核心知识展开。核心知识需要在不同情境中调用,变式运用才有可能转化为关键能力,基于学习反思、知识整合的关键能力训练,才有可能实现此类试题的化学学科核心素养培育作用。 (二)教学建议 单旭峰认为,化学学科考试必须坚持引导教学;通过提供新反应、新装置、新成果、新技术,考查学生提取、加工和整合信息的能力,使其形成自主学习、终身学习的意识和能力。此类图像试题考查的就是学生提取、加工和整合信息的能力。教师在教学过程中,可以布置学生绘制数据曲线、微观图示,并用于解释宏观现象和反应规律,以外显学生的已有认识、认识障碍,启发学生的思维,完成由感性认识向理性认识的飞跃。 为了引导学生开展证据与推理、模型与解释、符号与表征等学习活动,教师在布置任务的过程中,需要注重问题设计的梯度、知识的循序渐进。 以2019年全国Ⅱ卷的第12题为例(试题图像如图6所示),笔者改编设问如下。 温度T1时,以CdS(s)[]Cd2+(aq)+S2-(aq) ΔH>0为例,回答下列问题: ①温度T1时,在图13所示坐标系中,画出难溶物CdS溶解达平衡后,溶液中c(Cd2+)与c(S2-)的变化曲线(提示:K=xy为反比例函数)。 ②若上述溶液的溶质只有CdS、c(Cd2+)与c(S2-)应处于图14曲线中的 点(填“a”“b”或“c”)。 ③往上述溶液中加入少量Na2S固体后,c(Cd2+)、c(S2-)如何變化?两者所处的位置由a移向何处? ④能否通过图15中A、B、C所在的位置来判断CdS在该条件下是否析出沉淀?理由是什么? ⑤在图15的基础上,画出温度升高到T2时,溶液中c(Cd2+)与c(S2-)的变化曲线。 ⑥(2019年全国Ⅱ卷)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图7所示。下列说法错误的是 A.图中a和b分别为T1、T2温度下CdS在水中的溶解度 B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n) C.向m点溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 解决问题①至问题⑤的过程,既能体现学生的认识发展,又能让学生将抽象的知识直观化,还能发展学生的演绎推理、系统假设等思维能力。学生一旦建构好了模型,遇到此类问题就能举一反三,在不进行机械刷题的前提下提升解决问题的能力,轻而易举突破难点。 接下来,教师还可以改变坐标,将曲线转换成直线,将反比例函数转变为线性函数,图像表达形式多样化,学生的思维也多样化了。 在复习过程中,教师必须开展专项训练,让学生掌握解决这类题的必备知识,如电离平衡、溶解平衡、电荷守恒、物料守恒、离子浓度大小关系、简单计算等,从而掌握解读图像信息的方法、分析推理方法、解题步骤和方法等关键能力。 (三)命题建议 从近几年已进入新高考的省(区、市)的学业水平试题来看,当选择题有2分和4分的两种类型时,2分的试题为基础题,4分的试题综合性较强,这符合新高考基础性、综合性的要求,也有利于了解学生的基础水平和综合水平。当前全国卷有关“离子平衡图像”的试题综合性较强,适合作为4分试题压轴。若将各选项的考查点分解成几道小题,形成单点结构的试题,也可作为2分试题。这样不但能使试题呈现出一定的梯度,还能让教师观察到学生的思维过程,充分体现了试题的评价价值。 例如2020年全国I卷第13题(试题图像如图10所示),教师可将该图像分解为两个图像(如图16所示)进行试题的命制。 试题命制的创新性,还可以通过坐标系的变化来体现。 例如2021年全国乙卷第13题(试题图像如图8所示),该试题所调用的知识并没有改变,还是考查离子平衡的核心知识,但是试题图示用一个与原平衡体系无直接关联的c(H+)作横坐标,增加了试题情境的新颖性。 教师掌握识图技能,是胜任化学科研、生产实践的重要素养,能够为学生在科研、生产、实验情境中进一步探察问题、解决问题奠定技能基础。因此,教师有必要增强自身能力,以求更好地培育学生,发展学生的化学学科核心素养。 参考文献 [1]单旭峰.基于高考评价体系的化学科考试内容改革实施路径[J].中国考试,2019(12). [2]房喻,徐端钧.普通高中化学课程标准(2017年版)解读[M].北京:高等教育出版社,2018(11). 注:本文系广西教育科学“十三五”规划2019年度广西考试招生研究专项课题“基于样卷研发的等级性学考科目命题团队建设实践研究”(2019ZJY032)、广西教育科学“十三五”规划2020年度广西考试招生研究专项课题“普通高中学业水平选择性考试命题素材管理系统优化研究”(2020ZJY190)、广西教育科學“十三五”规划2020年度考试招生研究专项课题“普通高中学业水平考试的审题程序、规范和技术研究”(2020ZJY221)的研究成果。 作者简介:石秀梅(1977— ),广西灵川人,高级教师,主要研究方向为中学化学教育教学;黄都(1973— ),通讯作者,广西都安人,博士,教授,主要研究方向为教学评整体设计。 (责编 刘小瑗)

