ER-β对三阴性乳癌细胞生物学行为和IL-8表达影响
姚瑶,吕志栋,夏菁,崔茹婷,孔滨
[摘要]目的 探讨雌激素受体β(ER-β)对三阴性乳癌细胞生物学行为和白细胞介素8(IL-8)表达的影响。方法 构建外源性ER-β慢病毒表达载体,转染人三阴性乳癌细胞MDA-MB-231。将细胞分为正常对照组、过表达组、阴性对照组和IL-8干预组。通过细胞增殖、细胞迁移实验及流式细胞术分别观察各组细胞增殖、迁移及凋亡的变化。采用蛋白印迹实验法检测各组细胞中ER-β、IL-8及凋亡相关蛋白Bax、Bcl-2和Cleaved caspase-3表达。结果 ER-β过表达慢病毒转染MDA-MB-231细胞后,ER-β的表达明显增加,而IL-8表达明显降低(F=31.17、60.26,P<0.05)。上调ER-β的表达明显抑制了MDA-MB-231的增殖和迁移能力,并促进凋亡率的增加(F=70.89~459.50,P<0.05),同時增加凋亡相关蛋白Bax/Bcl-2和Cleaved caspase-3的表达(F=20.67、89.64,P<0.05)。 但是外源性IL-8能够部分逆转ER-β对细胞迁移能力及凋亡的调控作用(P均<0.05),而对增殖无明显影响(P>0.05)。 结论 上调ER-β的表达可以抑制IL-8的表达,从而抑制三阴性乳癌细胞迁移并促进其凋亡。
[关键词]三阴性乳癌;雌激素受体β;白细胞介素8;细胞运动;细胞凋亡
[中图分类号]R737.9;R392.11
[文献标志码]A
[文章编号]2096-5532(2022)04-0480-06
doi: 10.11712/jms.2096-5532.2022.58.093[HT]
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.r.20220617.1644.008.html;[JY]2022-06-2108:21:08
EFFECT OF ESTROGEN RECEPTOR-β ON THE BIOLOGICAL BEHAVIOR AND INTERLEUKIN-8 EXPRESSION OF TRIPLE-NEGATIVE BREAST CANCER CELLS
YAO Yao, L Zhidong, XIA Jing, CUI Ruting, KONG Bin
(Department of Breast Disease Center, The Affiliated Hospital of Qingdao University, Qingdao 266100, China)
[ABSTRACT] Objective[WTBZ] To investigate the effect of estrogen receptor-β (ER-β) on the biological behavior and interleukin-8 (IL-8) expression of triple-negative breast cancer cells.
Methods[WTBZ] A lentiviral vector overexpressing exogenous ER-β was constructed and transfected into human triple-negative breast cancer MDA-MB-231 cells, which were divided into normal control group, overexpression group, negative control group, and IL-8 intervention group. CCK-8 assay, Transwell assay, and flow cytometry were used to observe the changes in cell proliferation, migration, and apoptosis, and Western blot was used to measure the expression of ER-β, IL-8, and the apoptosis-related proteins Bax, Bcl-2, and Cleaved caspase-3 in each group.
Results[WTBZ] After MDA-MB-231 cells were transfected with the ER-β overexpression lentivirus, there was a significant increase in the expression of ER-β and a significant reduction in the expression of IL-8 (F=31.17,60.26;P<0.05). Upregulation of ER-β expression significantly inhibited the proliferation and migration abilities of MDA-MB-231 cells, promoted the increase in apoptosis rate (F=70.89-459.50,P<0.05), and increased the expression levels of the apoptosis-related proteins Bax/Bcl-2 and Cleaved caspase-3 (F=20.67,89.64;P<0.05). However, exogenous IL-8 partially reversed the regulatory effect of ER-β on cell migration and apoptosis (all P<0.05), but with no significant effect on proliferation (P>0.05).
Conclusion Upregulation of ER-β expression can inhi-
bit the expression of IL-8, thereby inhibiting the migration of triple-negative breast cancer cells and promoting their apoptosis.
[KEY WORDS] triple negative breast neoplasms; estrogen receptor beta; interleukin-8; cell movement; apoptosis
三阴性乳癌(TNBC)是乳癌中最具侵袭力的一种亚型,具有较高的局部复发和远处转移率,给健康带来巨大威胁[1]。目前,对于TNBC病人内分泌治疗是需要探索的领域。雌激素在乳癌中通过雌激素[LL]受体α(ER-α)和雌激素受体β(ER-β)两个核受体发挥其作用[2]。ER-β首次发现至今已有30余年,在乳癌中的确切作用仍有争议[3]。白细胞介素8(IL-8)也称作CXCL8,是趋化因子的一种[4]。IL-8被证实可联合血管内皮生长因子建立肿瘤新的脉管系统,从而促进乳癌的发生发展[5]。有研究表明,ER-β可通过炎症通路来调控IL-8等相关炎性因子进而抑制前列腺癌的发生发展[6]。同时也有研究证实,在乳癌中ER-β可上调IL-8的启动子活性,从而促进乳癌的侵袭[7]。本研究以TNBC细胞MDA-MB-231为模型,探讨了ER-β对IL-8的调控作用并进一步验证其对乳癌细胞增殖、迁移和凋亡的影响。
1材料和方法
1.1实验材料
人乳癌细胞株MDA-MB-231由湖北普诺赛公司提供。ER-β过表达慢病毒(Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin,上海吉凱公司),高糖DMEM培养液(大连美仑公司),胎牛血清(进阶生物公司),人重组IL-8(苏州派普泰克公司),CCK-8细胞增殖检测试剂盒和结晶紫(北京索莱宝公司),Annexin V-7ADD/PE凋亡检测试剂盒(美国BD公司),抗ER-β、Bax、Bcl-2和Cleaved caspase-3单克隆一抗(美国CST公司),抗IL-8单克隆一抗(上海艾博抗公司),二抗及GAPDH一抗(武汉伊莱瑞特公司)。荧光显微镜、倒置相差显微镜(日本Olympus公司),酶标仪(瑞士Tecan公司),流式细胞仪(美国Apogee公司),显影仪(赛默飞世尔科技公司)。
1.2实验方法
1.2.1 细胞培养与分组MDA-MB-231细胞接种在含有体积分数0.10胎牛血清的DMEM培养液中,置于37 ℃、体积分数0.05 CO2培养箱中,细胞汇合度90%左右传代。实验分组:未转染的人乳癌细胞为正常对照组(a组),转染ER-β过表达慢病毒为过表达组(b组),载体空载为阴性对照组(c组),在转染ER-β过表达慢病毒后再使用人重组IL-8(150 μg/L)为IL-8干预组(d组)。
1.2.2 细胞转染将对数生长期的乳癌细胞接种在6孔板中,当细胞汇合度达到60%~70%时,更换1 mL含有体积分数为0.10胎牛血清的高糖DMEM培养液,ER-β过表达组加入40 μL助转试剂A和2 μL的 ER-β过表达慢病毒,空载组加入40 μL助转试剂A和2 μL阴性对照慢病毒,轻轻晃匀,根据细胞状态8~12 h后换液。72 h后荧光显微镜下观察,取稳定转染的细胞用于后续实验。
1.2.3 细胞增殖实验将各组按每孔5×103个细胞接种于96孔板中,设置5个复孔。24 h后每孔更换90 μL完全培养液,并加入10 μL 的CCK-8试剂,37 ℃、避光孵育2 h后使用酶标仪检测450 nm波长处的吸光度,连续测量5 d。细胞活力以OD值表示。
1.2.4 流式细胞术检测细胞凋亡分别收集各组细胞1×105个,以PBS洗涤2次后重悬于100 μL的1×Binding buffer中,分别在细胞悬液中加入Annexin V-7ADD和PE试剂各5 μL,在常温、避光条件下孵育20 min,使用流式细胞仪检测各组细胞的凋亡率。
1.2.5 细胞迁移实验将各组细胞用无血清的高糖DMEM接种于24孔Transwell板的小室中,每孔1×105个。每孔加入500 μL含体积分数0.20胎牛血清的高糖DMEM培养液,培养24 h后弃培养液,擦去小室内的细胞,以40 g/L的多聚甲醛固定30 min,用1 g/L的结晶紫染色30 min,随机选取5个视野拍照。
1.2.6 蛋白印迹实验收集细胞沉淀,加入160 μL预冷的RIPA裂解液和1 μL蛋白酶抑制剂,BCA法测定蛋白浓度。将上样缓冲液按1∶4的比例与总蛋白混匀,在95 ℃下加热5 min。选用150 g/L的SDS-PAGE胶分离电泳(每孔30 μg),然后转到PVDF膜上,再用50 g/L脱脂奶粉封闭2 h。TBST洗涤PVDF膜3次,一抗孵育过夜(4 ℃),二抗孵育1.5 h。 ECL发光成像,使用Image J软件分析目的条带灰度值,以GAPDH为内参照。
1.3统计学方法
使用Graph Pad Prism 8软件进行统计分析。计量资料数据以[AKx-D]±s表示,多组间均数比较使用单因素方差分析,不同天数组间细胞增殖的比较采用析因设计方差分析,两两比较使用单因素LSD法。以P<0.05为差异具有统计学意义。
2结果
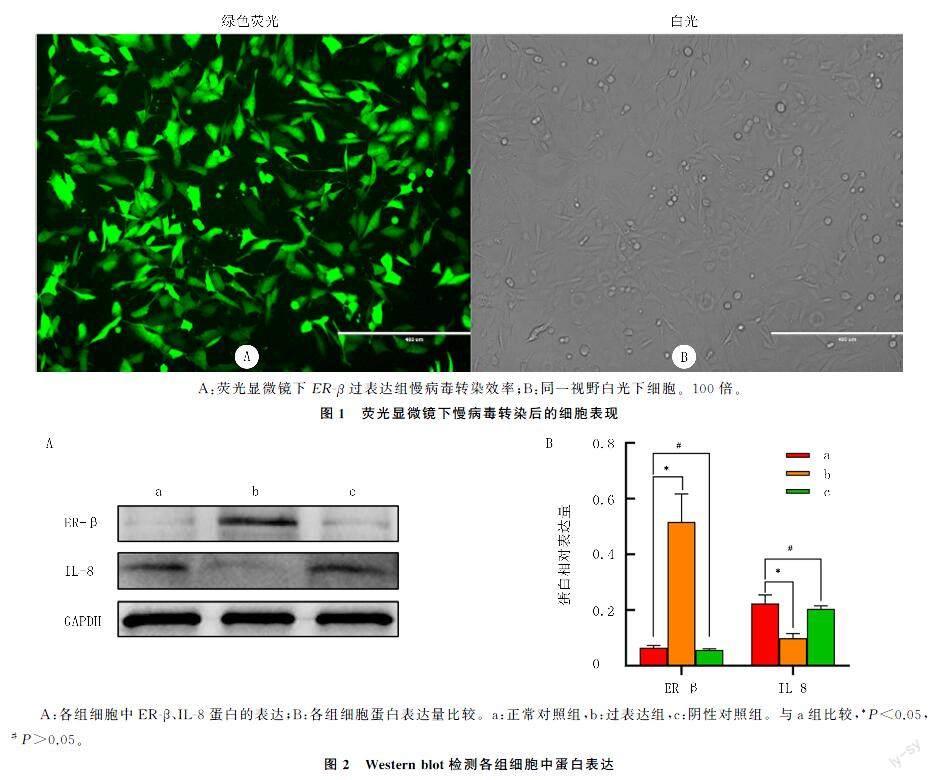
2.1ER-β过表达慢病毒转染效率检测
ER-β过表达及空载慢病毒转染72 h后,在荧光显微镜下观察有90%以上的细胞内绿色荧光蛋白(GFP)表达阳性(图1)。Western blot半定量分析表明,3组ER-β蛋白表达量差异具有统计学意义(F=60.26,P<0.05),过表达组(0.52±0.10)高于正常对照组(0.06±0.01)和阴性对照组(0.06±0.01);3组IL-8的蛋白表达量差异具有统计学意义(F=31.17,P<0.05),过表达组(0.10±0.02)低于正常对照组(0.22±0.03)和阴性对照组(0.20±0.01)。见图2。提示慢病毒转染能够明显增加乳癌细胞中ER-β的表达,同时降低IL-8的表达。
2.2ER-β对人乳癌细胞增殖能力的影响
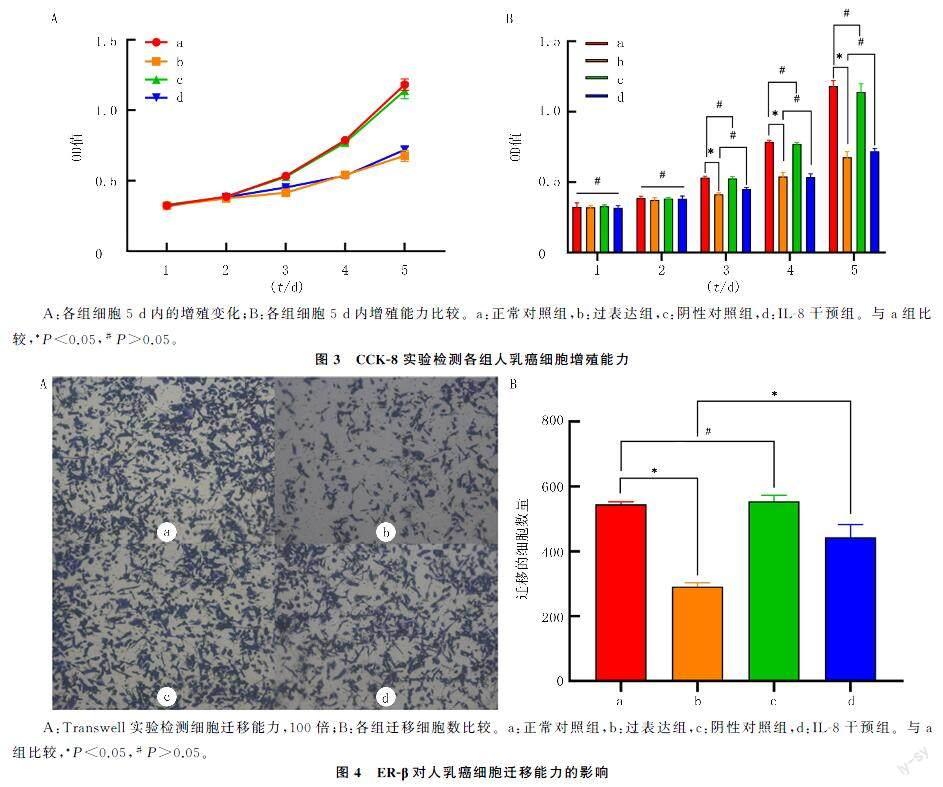
CCK-8检测结果显示,ER-β过表达抑制了细[CM)]胞活力,不同时间、不同组别及其二者交互比较,差异均有统计学意义(F时间=1 351.00,F组别=215.20,F时间×组别=70.89,P<0.05)。转染第1、2天,4组间差异无统计学意义(P>0.05)。值得注意的是,第3~5天,正常对照组的细胞活力值分别为0.53±0.01、0.79±0.01和1.18±0.04,阴性对照组分别为0.53±0.01、0.77±0.01和1.14±0.06,这两组间差异无统计学意义(P>0.05);[JP2]过表达组分别为0.41±0.01、0.54±0.03和0.68±0.04,这3组间差异均具有统计学意义(P<0.05)。IL-8干预组第1~5天的细胞活力值则分别为0.32±0.02、0.38±0.02、0.45±0.01、0.54±0.02和0.72±0.02,与过表达组比较差异均无统计学意义(P>0.05)。见图3。
2.3ER-β对人乳癌细胞迁移能力的影响
细胞迁移实验的结果显示,正常对照组的迁移细胞数量为每高倍视野545.00±27.94,过表达组为291.30±11.59,阴性对照组为554.00±18.68,IL-8干预组为443.70±39.55,4组细胞的迁移能力比较差异有显著意义(F=84.84,P<0.05)。正常对照组与阴性对照组迁移细胞数比较,差异无统计学意义(P>0.05);而过表达组则明显少于正常对照组,差异具有统计学意义(P<0.05);IL-8干预组明显多于过表达组,差异具有统计学意义(P<0.05)。见图4。
2.4ER-β对人乳癌细胞凋亡的影响
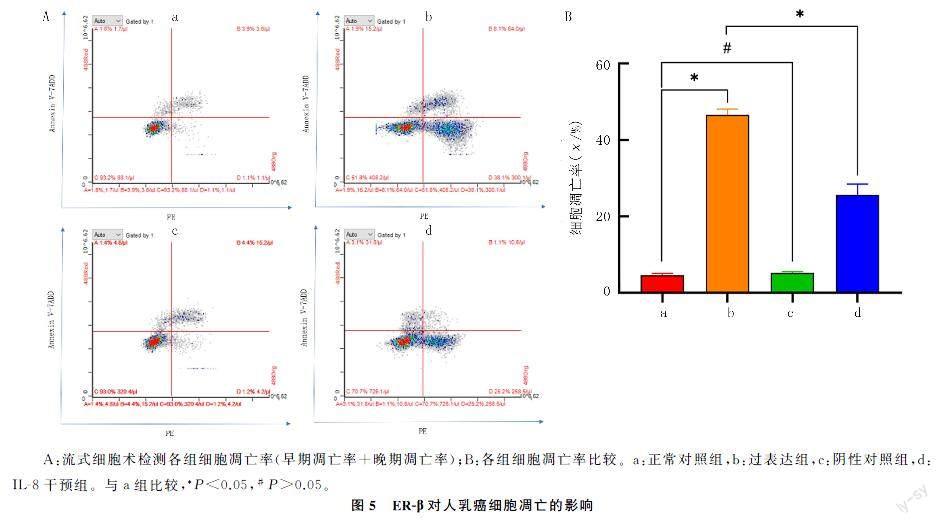
流式细胞术分析显示,正常对照组细胞凋亡率为(4.60±0.46)%,过表达组为(46.57±1.48)%,阴性对照组为(5.20±0.36)%,IL-8干预组为(25.00±3.15)%,4组细胞凋亡率比较差异具有显著性(F=459.50,P<0.05)。正常对照组细胞凋亡率和阴性对照组相比较,差异无统计学意义(P>0.05);而过表达组明显低于正常对照组,差异具有统计学意义(P<0.05);IL-8干预组明显高于过表达组,差异具有统计学意义(P<0.05)。见图5。
2.5 各组细胞Bax、Bcl-2和Cleaved caspase-3蛋白表达比较
蛋白印迹实验结果显示,4组细胞中Bax/Bcl-2、Cleaved caspase-3的表达水平比较,差异具有统[CM)]
计学意义(F=20.67、89.64,P<0.05)。过表达组Bax/Bcl-2、Cleaved caspase-3表达均明显高于正常对照组及阴性对照组,差异均具有统计学意义(P均<0.05);正常对照组和阴性对照组比较,差异均无统计学意义(P>0.05)。当转染组细胞加入IL-8培养后,Bax/Bcl-2、Cleaved caspase-3蛋白的表达较过表达组均明显降低,差异均具有统计学意义(P均<0.05)。见图6。
3讨论
目前乳癌病理分类中将ER的状态完全取决于ER-α的表达[8],但与其结构有一定同源性的ER-β的作用尚不明确。现有研究已证实,大约有30%的TNBC细胞表达ER-β[9],ER-β能否像ER-α一样成为内分泌治疗靶点值得期待[10]。既往研究报道,ER-β在ER-α存在的情况下发挥抗乳癌细胞增殖的作用,而在ER-α缺失的情况下又发挥促增殖作用[11]。也有研究结果证实,ER-β的激活可在没有配体(雌激素)诱导的情况下,通过诱导胱抑素分泌蛋白家族在TNBC中引发有效的抗癌作用[9]。近期ALEXANDROVA等[12]也在3种TNBC细胞中证实,ER-β1过表达可降低细胞增殖能力,抑制了细胞克隆形成。本研究以TNBC细胞株MDA-MB-231为研究对象,通过上调细胞中ER-β表达来观察其对细胞学行为的影响,结果表明,过表达ER-β后癌细胞出现增殖的抑制、更高的凋亡率以及低迁移率等。这与ALEXANDROVA等[12]研究结果相一致。提示ER-β可能是调控TNBC生物学行为的重要因子,深入研究其下游分子机制具有重要意义。
IL-8是一种炎症趋化因子,在黑色素瘤、肺癌等多种癌症进展中发挥着关键作用[13-16]。已有研究证明,在乳癌中IL-8与其侵袭潜力之间存在正相关[17-19]。既往主要将其归因于IL-8对中性粒细胞的趋化作用所致[20],而近年研究结果显示,IL-8可通过上调基质金属蛋白酶2或基质金属蛋白酶9的表达和激活PI3K-Akt/MAPK信号通路来增加TNBC细胞的侵袭性[21-22]。在体内模型中,靶向阻断IL-8-CXCR1/2轴可有效阻止癌细胞生长和扩散[23]。有研究报道,化疗期间血浆IL-8浓度越低的病人可获得越高的长期存活率[24]。在一项针对前列腺癌研究中发现,过表达ER-β可抑制炎性因子的表达,进而抑制肿瘤的发展[7]。本研究结果显示,ER-β可通过影响IL-8的表达实现对乳癌细胞生物学行为的调控。ER-β过表达后,IL-8的表达明显降低,线粒体途径凋亡蛋白Bax/Bcl-2、Cleaved caspase-3的表达量增加,从分子水平解释了ER-β过表达后乳癌细胞凋亡率增加的机制。
综上所述,过表达ER-β可以抑制MDA-MB-231细胞中IL-8表达,抑制其遷移并促进其凋亡,这可能为TNBC病人的内分泌治疗提供依据。同时,本研究显示ER-β可抑制癌细胞的增殖,但并非通过调控IL-8通路,其具体分子机制还有待进一步探讨。今后,我们也将在更多的TNBC细胞系中进一步验证该结论的可靠性。
[參考文献]
[1]SYNNOTT N C, BAUER M R, MADDEN S, et al. Mutant [STBX]p53 as a therapeutic target for the treatment of triple-negative breast cancer: preclinical investigation with the anti-P53 drug, PK11007[J]. Cancer Letters, 2018,414:99-106.
[2]HIRAO-SUZUKI M. Estrogen receptor β as a possible double-edged sword molecule in breast cancer: a mechanism of alteration of its role by exposure to endocrine-disrupting chemicals[J]. Biological & Pharmaceutical Bulletin, 2021,44(11):1594-1597.
[3]SELLITTO A, D'AGOSTINO Y, ALEXANDROVA E, et al. Insights into the role of estrogen receptor β in triple-negative breast cancer[J]. Cancers, 2020,12(6):E1477. doi:10.3390/cancers12061477.
[4]MATSUSHIMA K, YANG D, OPPENHEIM J J. Interleukin-8: an evolving chemokine[J]. Cytokine, 2022,153:155828.
[5]ALRAOUJI N N, ABOUSSEKHRA A. Tocilizumab inhibits IL-8 and the proangiogenic potential of triple negative breast cancer cells[J]. Molecular Carcinogenesis, 2021,60(1):51-59.
[6]XIAO L, LUO Y H, TAI R F, et al. Estrogen receptor β suppresses inflammation and the progression of prostate cancer[J]. Molecular Medicine Reports, 2019,19(5):3555-3563.
[7]CHEN Y, CHEN L, LI J Y, et al. ERβ and PEA3 co-activate IL-8 expression and promote the invasion of breast cancer cells[J]. Cancer Biology & Therapy, 2011,11(5):497-511.
[8]ZHOU Y, ZHOU J M, XIAO J Y, et al. Prognostic relevance of estrogen receptor status in circulating tumor cells in breast cancer patients treated with endocrine therapy[J]. Frontiers in Oncology, 2022,12:866293.
[9]REESE J M, BRUINSMA E S, NELSON A W, et al. PNAS Plus: ERβ-mediated induction of cystatins results in suppression of TGFβ signaling and inhibition of triple-negative breast cancer metastasis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018,115(41):E9580-E9589.
[10]GUO L Y, ZHANG Y U, YILAMU D, et al. ERβ overexpression results in endocrine therapy resistance and poor prognosis in postmenopausal ERα-positive breast cancer patients[J]. Oncology Letters, 2016,11(2):1531-1536.
[11]MENDES C, LOPES-COELHO F, RAMOS C, et al. Unraveling FATP1, regulated by ER-β, as a targeted breast cancer innovative therapy[J]. Scientific Reports, 2019,9:14107. doi:10.1038/s41598-019-50531-3.
[12]ALEXANDROVA E, GIURATO G, SAGGESE P, et al. Interaction proteomics identifies ERbeta association with chromatin repressive complexes to inhibit cholesterol biosynthesis and exert an oncosuppressive role in triple-negative breast cancer[J]. Molecular & Cellular Proteomics: MCP, 2020,19(2):245-260.
[13]GONZALEZ-APARICIO M, ALFARO C. Significance of the IL-8 pathway for immunotherapy[J]. Human Vaccines & Immunotherapeutics, 2020,16(10):2312-2317.
[14]IBARRA C, KARLSSON M, CODELUPPI S, et al. BCG-induced cytokine release in bladder cancer cells is regulated by Ca2+ signaling[J]. Molecular Oncology, 2019,13(2):202-211.
[15]ZHENG T J, MA G X, TANG M Q, et al. IL-8 secreted from M2 macrophages promoted prostate tumorigenesis via STAT3/MALAT1 pathway[J]. International Journal of Molecular Sciences, 2018,20(1):E98. doi:10.3390/ijms-20010098.
[16]LIAN S, LI S, ZHU J, et al. Nicotine stimulates IL-8 expression via ROS/NF-κB and ROS/MAPK/AP-1 axis in human gastric cancer cells[J]. Toxicology, 2021,7:153062.
[17]UDDIN M M, GAIRE B, DEZA B, et al. Interleukin-8-induced invasion assay in triple-negative breast cancer cells[M]//Methods in Molecular Biology. New York, NY: Sprin-
ger US, 2020:107-115.
[18]LIM H, KOH M, JIN H,et al. Cancer-associated fibroblasts induce an aggressive phenotypic shift in non-malignant breast epithelial cells via interleukin-8 and S100A8[J]. J Cell Physiol, 2021,236:7014-7032.
[19]KIM E S, NAM S M, SONG H K, et al. CCL8 mediates crosstalk between endothelial colony forming cells and triple-negative breast cancer cells through IL-8, aggravating invasion and tumorigenicity[J]. Oncogene, 2021,40(18):3245-3259.
[20]DE ANDREA C E, OCHOA M C, VILLALBA-ESPARZA M, et al. Heterogenous presence of neutrophil extracellular traps in human solid tumours is partially dependent on IL-8[J]. The Journal of Pathology, 2021,255(2):190-201.
[21]KIM S, LEE J, JEON M, et al. MEK-dependent IL-8 induction regulates the invasiveness of triple-negative breast cancer cells[J]. Tumor Biology, 2016,37(4):4991-4999.
[22]DENG F, WENG Y G, LI X, et al. Overexpression of IL-8 promotes cell migration via PI3K-Akt signaling pathway and EMT in triple-negative breast cancer[J]. Pathology, Research and Practice, 2021,223:152824.
[23]BOURIS P, MANOU D, SOPAKI-VALALAKI A, et al. Serglycin promotes breast cancer cell aggressiveness: induction of epithelial to mesenchymal transition, proteolytic activity and IL-8 signaling[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2018,74:35-51.
[24]TIAINEN L, HMLINEN M, LUUKKAALA T, et al. Low plasma IL-8 levels during chemotherapy are predictive of excellent long-term survival in metastatic breast cancer[J]. Clinical Breast Cancer, 2019,19(4):e522-e533.
(本文編辑于国艺)

