C-藻蓝蛋白对宫颈癌HeLa细胞增殖与迁移的作用
韩晶晶,董晓雷,杨方浩,刘国祥,杨丽娜,李冰


[摘要]目的 探討C-藻蓝蛋白(C-PC)对转化生长因子β1(TGF-β1)诱导的HeLa细胞增殖、迁移作用的影响。方法 应用CCK-8方法检测不同浓度(0、50、100、200、400、800、1 600 mg/L)C-PC处理24、48 h对HeLa细胞增殖的影响;将HeLa细胞随机分为对照组、TGF-β1处理组、TGF-β1与C-PC联合处理组、C-PC处理组,分别给予相应药物处理,应用细胞克隆实验和Transwell法检测HeLa细胞集落形成及迁移能力,qPCR方法检测迁移相关因子mRNA的表达变化,Western blot方法检测迁移相关蛋白Vimentin、E-cadherin、N-cadherin表达。结果 C-PC对HeLa细胞的增殖具有抑制作用,且呈浓度依赖性(F=189.300、127.400,P<0.05);C-PC明显抑制了TGF-β1诱导的HeLa细胞集落形成和迁移能力。与对照组相比,TGF-β1处理组HeLa细胞中[STBX]Slug、Twist、Snail、Zeb1的mRNA表达水平显著升高(F=16.115~47.541,P<0.05),E-cadherin蛋白表达水平显著降低(F=41.870~470.038,P<0.05),Vimentin、N-cadherin蛋白表达水平显著升高(F=5.581~1 071.323,P<0.05),而加入C-PC共处理可逆转上述改变。结论 C-PC能够明显抑制TGF-β1诱导的HeLa细胞增殖和迁移,其作用机制可能与C-PC降低迁移相关因子的表达及调节E-cadherin、Vimentin和N-cadherin的蛋白表达有关。
[关键词]HeLa细胞;藻青蛋白;转化生长因子β1;细胞增殖;细胞迁移抑制
[中图分类号]R737.33;R730.59
[文献标志码]A
[文章编号]2096-5532(2022)04-0494-06
doi:10.11712/jms.2096-5532.2022.58.069[HT]
[开放科学(资源服务)标识码(OSID)]
[网络出版]https://kns.cnki.net/kcms/detail/37.1517.R.20220320.1553.008.html;[JY]2022-03-2210:11:18
EFFECTS OF C-PHYCOCYANIN ON PROLIFERATION AND MIGRATION OF CERVICAL CANCER HELA CELLS
HAN Jingjing, DONG Xiaolei, YANG Fanghao, LIU Guoxiang, YANG Lina, LI Bing
(Department of Biology, Basic Medicine, Qingdao University, Qingdao 266071, China)
[ABSTRACT]Objective To investigate the effects of C-phycocyanin (C-PC) on the proliferation and migration of HeLa cells induced by transforming growth factor-β1 (TGF-β1).
Methods Cell Counting Kit-8 assay was used to determine the effects on the proliferation of HeLa cells after treatment by C-PC of different concentrations (0,50,100, 200,400,800, and 1 600 mg/L) for 24 and 48 h. The HeLa cells were divided into control group, TGF-β1 treatment group, TGF-β1+C-PC treatment group, and C-PC treatment group; then corresponding agents were administered. Cell clone assay, scratch assay, and Transwell assay were used to determine the colony formation and migration of the HeLa cells, quantitative PCR was used to determine the mRNA expression of migration-related factors, and Western blot was used to determine the expression of migration-related proteins Vimentin, E-cadherin, and N-cadherin.
Results C-PC inhibited the proliferation of the HeLa cells in a concentration-dependent manner (F=189.300,127.400;P<0.05); C-PC significantly inhibited the TGF-β1-induced colony formation and migration of HeLa cells. Compared with the control group, the TGF-β1 treatment group had significantly increased mRNA expression of [STBX]Slug, Twist, Snail, and Zeb1 in the HeLa cells (F=16.115-47.541,P<0.05), significantly decreased protein expression of E-cadherin (F=41.870-470.038,P<0.05), and increased protein expression of Vimentin and N-cadherin (F=5.581-1 071.323,P<0.05); C-PC co-treatment could reverse the above changes.
Conclusion C-PC can significantly inhibit the TGF-β1-induced proliferation and migration of HeLa cells, which may be attributed to the fact that C-PC can reduce the expression of migration-related factors and regulate the protein expression of E-cadherin, Vimentin, and N-cadherin.
[KEY WORDS] HeLa cells; phycocyanin; transforming growth factor beta1; cell proliferation; cell migration inhibition
宫颈癌是女性最常见的癌症[1]。尽管近年来宫颈癌病人早期诊出率和治疗存活率都明显增高,但晚期宫颈癌病人的预后和治疗效果仍然不甚理想。确诊和死亡病人中超过 85%发生在包括中国在内的发展中国家,宫颈癌的晚期转移是导致病人死亡的主要原因。人宫颈癌HeLa细胞相比于其他癌细胞,增殖与转移异常迅速[2]。研究表明,转化生长因子β(TGF-β)在癌症晚期可以诱导癌细胞增殖和迁移等众多反应[3]。C-藻蓝蛋白(C-PC)是从螺旋藻中分离出的天然蛋白[4],具有抗肿瘤[5]、抗炎症[6]和增进机体免疫力等作用。WANG等[7]通过构建C-PC/CMC-CD59sp 纳米颗粒,将C-PC高效转运至癌细胞内发挥杀伤作用。本研究以TGF-β1诱导的HeLa细胞作为研究对象,探讨C-PC抑制宫颈癌HeLa细胞增殖迁移活性的作用机制,为C-PC在临床上的应用提供理论依据。
1材料与方法
1.1实验材料
人宫颈癌HeLa细胞株受赠于青岛大学附属医院。试剂级C-PC粉末购于中国台州宾美生物技术有限公司;胎牛血清(FBS)购于以色列BI生物科技公司;DMEM高糖培养液购于美国Hyclone公司;青链霉素混合液购于苏州新赛美生物科技有限公司;PBS购于山东思科捷生物技术有限公司;重组人TGF-β1购于美国Peprotech有限公司;1 g/L结晶紫购于索莱宝公司;CCK-8试剂盒、BCA试剂盒及反转录试剂盒购自Biosharp白鲨生物科技公司;抗人E-cadherin、N-cadherin、Vimentin一抗购自美国Cell Signaling Technology公司;HRP标记的二抗购自南京巴傲德生物科技有限公司;ECL试剂盒购自上海雅酶生物科技有限公司;RNA提取试剂盒购自山东思科捷生物技术有限公司;PCR引物购自上海生工生物工程有限公司;qPCR试剂盒购自赛维尔生物科技有限公司。
1.2实验方法
1.2.1细胞培养及分组HeLa细胞加入含体积分数0.10胎牛血清及体积分数0.01青链霉素混合液的DMEM高糖培养液,恒温培养箱中培养,培养箱内温度为37 ℃、含体积分数0.05 CO2、95%的相对饱和湿度。当细胞培养至融合度达到80%~90%时进行细胞传代,传至2~3代时,取处于对数生长期且生长状态良好的细胞进行实验。实验分为4组,每组设置3个复孔。以DMEM高糖培养液培养的HeLa细胞作为对照组,10 μg/L TGF-β1处理的HeLa细胞作为TGF-β1处理组,200 mg/L C-PC处理的HeLa细胞作为C-PC处理组,以10 μg/L TGF-β1和200 mg/L C-PC处理HeLa细胞作為TGF-β1+C-PC共同处理组。
1.2.2CCK-8法测定C-PC对HeLa细胞增殖能力的影响取处于对数生长期的HeLa细胞,胰蛋白酶消化制成细胞悬液,调整细胞密度为1×105/L,加入96孔板中。在5个孔中加入无细胞培养液作为空白组,每孔100 μL,置于培养箱中孵育过夜;应用不同浓度的C-PC溶液(终浓度分别为0、50、100、200、400、800、1 600 mg/L)处理细胞,每个浓度设置5个复孔,分别培养24、48 h后,将溶液换为PBS并加CCK-8工作液,置于培养箱中反应4 h。用酶标仪检测450 nm波长处光密度(D)值,并计算每组细胞存活率。细胞存活率=(C-PC处理组D值-空白组D值)/(0 mg/L组D值-空白组D值)×100%。计算半抑制浓度(IC50)值并选取整数浓度作为后续实验浓度。
1.2.3细胞平板克隆形成实验检测HeLa细胞克隆形成能力将HeLa细胞制成单细胞悬液,以每孔1 000个细胞接种到6孔板中,按照1.2.1方法分组处理,将培养液补齐至3 mL,晃动培养板,使细胞均匀分布在孔内,置于培养箱中培养8~16 d,每3 d换液1次;当6孔板中出现肉眼可见的克隆斑时,终止培养。弃培养液,用PBS洗2~3次后,每孔加入40 g/L多聚甲醛1 mL固定细胞克隆20 min。弃固定液,加入适量结晶紫染色15 min,流水清洗,室温下干燥,观察并拍照,对克隆集落进行计数。
1.2.4Transwell实验检测HeLa细胞迁移能力
使用无血清培养液预处理8.0 μm孔径的Transwell小室,将饥饿处理12 h的HeLa细胞消化离心后,用无血清培养液重悬计数,取200 μL细胞悬液(1×108/L)离心后,按1.2.1方法分组并加入相应药物200 μL重悬,接种于上室;下室加入600 μL含体积分数0.20胎牛血清的培养液,置培养箱中培养48 h后取出小室,弃上清,PBS洗2次并用棉签擦拭内室,细胞固定液固定30 min,结晶紫染色15 min,PBS洗2次,晾干。荧光显微镜下随机选取5个视野拍照并进行细胞计数,计算每孔平均细胞数。
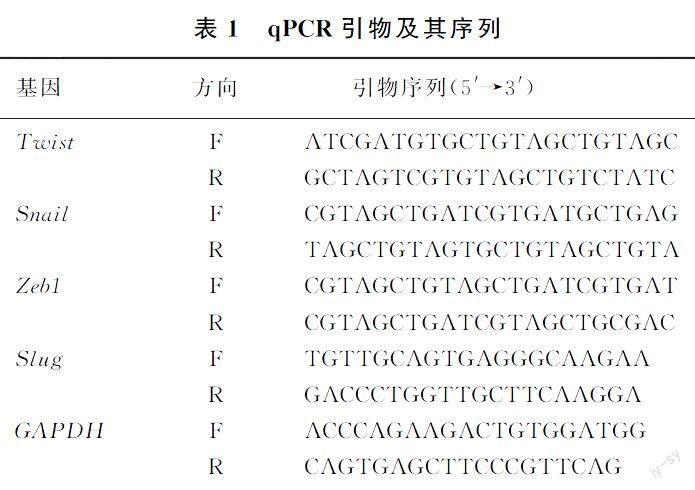
1.2.5荧光定量PCR(qPCR)方法检测迁移相关因子Slug、Snail、[STBX]Zeb1、Twist mRNA的表达将HeLa细胞按照1.2.1方法分组铺入6孔板,加药处理48 h后以PBS洗3次,胰蛋白酶消化,收集细胞,使用RNA提取试剂盒提取细胞总RNA,用核酸蛋白检测仪测定浓度并鉴定纯度。在以下反应条件下将总RNA反转录合成cDNA:25 ℃、5 min,42 ℃、30 min,85 ℃、5 min。用荧光定量PCR仪使用三步法行qPCR扩增及检测,反应条件:95 ℃预变性30 s,95 ℃、15 s,60 ℃、10 s,72 ℃、30 s,共进行40个循环。采用2-△△CT 法计算迁移相关因子mRNA相对表达水平。qPCR反应引物及其序列见表1。
1.2.6Western blot方法检测HeLa细胞迁移相关蛋白表达将HeLa细胞培养液换为无血清培养液饥饿处理12 h后,按照1.2.1方法分组处理48 h后,用PBS冲洗,加入含体积分数0.01蛋白酶抑制剂(PMSF)的RIPA裂解液,将细胞刮下后转移至EP管中,置于冰上裂解30 min,在预冷的4 ℃离心机中12 000 r/min离心15 min,将上清转移至新EP管中,BCA法测定蛋白浓度。取蛋白样品按1∶4比例加入SDS-PAGE Loading Buffer后恒温变性10 min,每孔吸取30 μg蛋白上样,以溴酚蓝作为指示剂,浓缩胶层恒压80 V电泳,至分离胶层时电压调至120 V继续恒压电泳,待测样品电泳至分离胶底部时,停止电泳。恒流300 mA濕转80 min转至PVDF膜上,置于摇床上室温封闭20 min,TBST洗3次。加入一抗4 ℃孵育过夜,TBST洗3次;加入HRP标记的山羊抗兔二抗室温孵育2 h,TBST洗3次。在暗室使用凝胶成像仪和ECL试剂盒对膜进行发光成像,应用Image J软件将各条带灰度值量化,分析HeLa细胞迁移相关蛋白E-cadherin、 N-cadherin和Vimentin表达。
所有实验均重复3次。
1.3统计学处理
采用SPSS 26.0统计软件进行数据分析。使用Image J、GraphPad Prism 8软件处理图像,符合正态分布的计量资料结果用[AKx-D]±s表示,数据间比较采用单因素方差分析及析因设计的方差分析。
2结果
2.1C-PC对TGF-β1诱导的HeLa细胞增殖活力[CM)]的影响
CCK-8检测显示,C-PC处理HeLa细胞24、48 h,细胞增殖活力均受到明显抑制,且呈浓度依赖性(F=189.300、127.400,P<0.05),处理24、48 h的IC50值分别为255.4、387.0 mg/L,设置实验C-PC的工作浓度为200 mg/L。细胞平板克隆实验结果显示,培养15 d时,对照组、TGF-β1处理组、C-PC处理组、TGF-β1+C-PC共同处理组HeLa细胞集落形成数分别为405.0±14.7、620.0±37.2、364.3±20.3、140.3±13.0,TGF-β1处理组细胞的集落数较对照组明显增多,TGF-β1+C-PC共同处理组细胞集落数量则较TGF-β1处理组明显下降,C-PC单独处理组较对照组形成集落数量明显减少(FTGF-β1=176.718,P<0.001;FC-PC=248.265,P<0.001;FTGF-β1×C-PC=0.047,P=0.792)。见图1。
2.2C-PC对TGF-β1诱导的HeLa细胞迁移影响
Transwell实验结果显示,对照组、TGF-β1处理组、C-PC处理组、TGF-β1+C-PC共同处理组细胞迁移数分别为94.2±9.1、129.4±14.8、57.8±7.5、89.2±6.4,TGF-β1处理组细胞迁移能力较对照组显著增强,TGF-β1+C-PC共同处理组细胞迁移能力较TGF-β1处理组明显减弱,C-PC单独处理组与对照组相比细胞迁移能力明显受抑制(FTGF-β1=44.543,FC-PC=58.923,P<0.001;FTGF-β1×C-PC=0.145,P=0.708)。见图2。
2.3各组HeLa细胞中迁移相关基因转录因子的mRNA表达比较
qPCR检测结果显示,加药处理48 h后,TGF-β1处理组HeLa细胞内迁移相关因子[STBX]Slug、Snail、Zeb1、Twist的mRNA表达显著高于对照组,TGF-β1+C-PC共同处理组相关转录因子mRNA表达较TGF-β1处理组明显下降,而C-PC单独处理组与对照组相比相关转录因子mRNA表达水平显著降低([STBX]Zeb1:FTGF-β1=34.906,FC-PC=20.194,P<0.01;FTGF-β1×C-PC=4.301,P=0.077。[STBX]Slug:FTGF-β1=47.541,FC-PC=47.504,P<0.01;FTGF-β1×C-PC=3.682,P=0.091。Snail:FTGF-β1=25.335,FC-PC=16.115,P<0.01;FTGF-β1×C-PC=1.849,P=0.223。Twist:FTGF-β1=21.407,FC-PC=36.926,P<0.01;FTGF-β1×C-PC=3.062,P=0.118)。见表2。
2.4各组HeLa细胞迁移相关蛋白表达比较
Western blot结果显示,TGF-β1处理组HeLa细胞内Vimentin、N-cadherin蛋白表达水平显著高于对照组,TGF-β1+C-PC共同处理组较TGF-β1处理组明显降低,而C-PC单独处理组则显著低于对照组,差异均具有显著意义(Vimentin:FTGF-β1=75.186,FC-PC=94.592,
FTGF-β1×C-PC=5.581,P<0.05;N-cadherin:FTGF-β1=570.129,FC-PC=1 071.323,FTGF-β1×C-PC=87.994,P<0.01)。TGF-β1处理组细胞内E-cadherin的表达水平较对照组显著降低,TGF-β1+C-PC共同处理组较TGF-β1处理组明显升高,而C-PC单独处理组与对照组相比显著升高,差异有显著性(FTGF-β1=470.038,FC-PC=286.287,FTGF-β1×C-PC=41.870,P<0.01)。见图3、表3。
3讨论
宫颈癌是女性中第四大常见癌症,并且是世界上一些贫穷国家癌症死亡的主要原因[8]。大多数宫颈癌病人被诊断时已经是晚期且已发生转移,治愈难度高。因此,一直以来,寻找特异性高、副作用小的天然抗癌药物是国内外研究的热点。
癌症晚期病人癌细胞易发生浸润迁移,转移癌比原发癌的治愈难度更大,病死率更高。TGF-β在人类癌症发展过程中的作用具有二重性,在癌前细胞中,TGF-β主要起抑癌作用;而在癌症晚期,TGF-β信号转导发挥促进肿瘤细胞迁移的作用[9]。因此,抑制TGF-β的促细胞迁移作用能够有效抑制晚期肿瘤的发展。
C-PC能够抑制多种癌细胞的增殖和迁移,促进其凋亡。JIANG等[10]研究发现,C-PC能够抑制三阴性乳癌MDA-MB-231细胞增殖、迁移,同时能够激活p38 MAPK和JNK信号通路,抑制ERK通路,诱导细胞凋亡。LIU等[11]研究发现,C-PC抗肝癌的作用机制包括肿瘤发生早期的血细胞损伤、线粒体介导的凋亡及自噬抑制,为肿瘤的治疗提供了相对安全的途径。JI等[12]研究表明,C-PC可逆转TGF-β1诱导的宫颈癌细胞上皮向间充质转化,下调TGF-β/samd信号通路诱导的肿瘤细胞周期G0/G1阻滞。HAO等[13]首次提出C-PC通过下调非小细胞肺癌细胞的RIPK1/NF-κB活性发挥抗增殖和抗迁移功能。LIU等[14]构建能够靶向作用于HeLa细胞C-PC/CMC-CD55sp纳米微球,提高了C-PC抑制癌细胞增殖并诱导凋亡的效率。但有关C-PC对于转移性宫颈癌的作用及机制研究的报道较少。本文研究通过TGF-β1诱导宫颈癌HeLa细胞转移,探讨C-PC对宫颈癌细胞转移的作用及其机制。研究结果显示,C-PC能够明显抑制TGF-β1诱导的HeLa细胞增殖和迁移。
大部分癌细胞的增殖迁移能力较强,癌变细胞钙黏蛋白表达的变化表现为E-cadherin表达减少和N-cadherin表达增加。已有研究发现,E-cadhe-rin蛋白表達的丧失与晚期肿瘤细胞运动性增加、转移能力增强密切相关[15]。NAVARRO等[16]研究结果表明,诱导增加缺乏E-cadherin的癌细胞中E-cadherin的表达量可以阻止肿瘤的进展和侵袭,因此E-cadherin成为经典的肿瘤抑制因子。与E-cadherin对肿瘤细胞的进展和侵袭抑制作用相反,N-cadherin赋予肿瘤细胞更强的迁移和侵袭能力,该作用与E-cadherin的表达无关[17-18]。研究显示,N-cadherin的异常表达与恶性肿瘤的转化、黏附、凋亡、血管生成、侵袭转移等多方面密切相关,N-cadherin可能成为肿瘤侵袭转移的治疗靶点[19]。Vimentin是中间丝蛋白质的一种,对细胞的活动性有重要的作用,Vimentin能够促进癌细胞迁移,在运动细胞和侵袭细胞中的表达水平较高[20]。本研究结果显示,TGF-β1诱导HeLa细胞内N-cadherin、Vimentin高表达,E-cadherin低表达,C-PC则能逆转HeLa细胞内的这种变化。本实验还检测了TGF-β1和C-PC对迁移相关标志性因子[STBX]Twist、Zeb1、Slug、Snail表达的影响,结果显示,TGF-β1诱导HeLa细胞内[STBX]Twist、Zeb1、Slug、Snail表达水平升高,C-PC与TGF-β1共处理则降低了这些因子的表达水平。Twist表达的增加与肿瘤的侵袭和转移直接相关,并介导E-cadherin的丢失,Slug是Twist诱发的癌细胞转移的重要递质[21],Snail在E-cadherin启动子上发挥阻遏活性[22],Snail和Twist协同作用控制Zeb1的表达量[23]。
综上所述,TGF-β1可以诱导宫颈癌HeLa细胞的增殖、迁移,而C-PC能够明显逆转TGF-β1诱导的HeLa细胞增殖和迁移,其机制主要与C-PC降低迁移相关因子的表达及调节E-cadherin、Vimen-tin和N-cadherin的蛋白表达水平有关。而C-PC是如何作用于癌细胞实现这一功能的是我们接下来研究的重点。本文研究结果为宫颈癌的晚期临床治疗提供了新思路。
[参考文献]
[1]COHEN P A, JHINGRAN A, OAKNIN A, et al. Cervical cancer[J]. Lancet, 2019,393(10167):169-182.
[2]MITTAL V. Epithelial mesenchymal transition in tumor metastasis[J]. Annual Review of Pathology, 2018,13:395-412.
[3]XIE F, LING L, DAM H V, et al. TGF-β signaling in cancer metastasis[J]. Acta Biochimica et Biophysica Sinica, 2018,50(1):121-132.
[4]JIANG L Q, WANG Y J, YIN Q F, et al. Phycocyanin: a potential drug for cancer treatment[J]. Journal of Cancer, 2017,8(17):3416-3429.
[5]THANGAM R, SURESH V, ASENATH PRINCY W, et al. C-Phycocyanin from Oscillatoria tenuis exhibited an antioxidant and in vitro antiproliferative activity through induction of apoptosis and G0/G1 cell cycle arrest[J]. Food Chemistry, 2013,140(1-2):262-272.
[6]ZHU C H, LING Q J, CAI Z H, et al. Selenium-containing phycocyanin from Se-enriched Spirulina platensis reduces inflammation in dextran sulfate sodium-induced colitis by inhibiting NF-κB activation[J]. Journal of Agricultural and Food Chemistry, 2016,64(24):5060-5070.
[7]WANG Y J, JIANG L Q, YIN Q F, et al. The targeted antitumor effects of C-PC/CMC-CD59sp nanoparticles on HeLa cells in vitro and in vivo[J]. Journal of Cancer, 2017,8(15):3001-3013.
[8]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018,68(6):394-424.
[9]HUANG J J, BLOBE G C. Dichotomous roles of TGF-β in human cancer[J]. Biochemical Society Transactions, 2016,44(5):1441-1454.
[10]JIANG L Q, WANG Y J, LIU G X, et al. C-Phycocyanin exerts anti-cancer effects via the MAPK signaling pathway in MDA-MB-231 cells[J]. Cancer Cell International, 2018,18:12.
[11]LIU Z J, FU X, HUANG W, et al. Photodynamic effect and mechanism study of selenium-enriched phycocyanin from Spi-rulina platensis against liver tumours[J]. Journal of Photochemistry and Photobiology B, Biology, 2018,180:89-97.
[12]JI H H, LIU G X, HAN J J, et al. C-phycocyanin inhibits epithelial-to-mesenchymal transition in Caski cells[J]. Cancer Cell International, 2020,20:292.
[13]HAO S, LI S, WANG J, et al. C-phycocyanin suppresses the in vitro proliferation and migration of non-small-cell lung can-cer cells through reduction of RIPK1/NF-κB activity[J]. Marine Drugs, 2019,17(6): E362.
[14]LIU G X, XU X H, JIANG L Q, et al. Targeted antitumor mechanism of C-PC/CMC-CD55sp nanospheres in HeLa cervical cancer cells[J]. Frontiers in Pharmacology, 2020,11:906.
[15]MENDONSA A M, NA T Y, GUMBINER B M. E-cadherin in contact inhibition and cancer[J]. Oncogene, 2018,37(35):4769-4780.
[16]NAVARRO P, GMEZ M, PIZARRO A, et al. A role for the E-cadherin cell-cell adhesion molecule during tumor progression of mouse epidermal carcinogenesis[J]. The Journal of Cell Biology, 1991,115(2):517-533.
[17]MROZIK K M, BLASCHUK O W, CHEONG C M, et al. N-cadherin in cancer metastasis, its emerging role in haematolo-
gical malignancies and potential as a therapeutic target in cancer[J]. BMC Cancer, 2018,18:939.
[18]HAZAN R B, QIAO R, KEREN R, et al. Cadherin switch in tumor progression[J]. Annals of the New York Academy of Sciences, 2004,1014:155-163.
[19]CAO Z Q, WANG Z, LENG P. Aberrant N-cadherin expression in cancer[J]. Biomedicine & Pharmacotherapy, 2019,118:109320.
[20]BATTAGLIA R A, DELIC S, HERRMANN H, et al. Vi-mentin on the move: new developments in cell migration[J]. F1000Research, 2018,7:1796.
[21]WANG Y F, SHI J, CHAI K Q, et al. The role of snail in EMT and tumorigenesis[J]. Current Cancer Drug Targets, 2013,13(9):963-972.
[22]HERRANZ N, PASINI D, DAZ V M, et al. Polycomb complex 2 is required for E-cadherin repression by the Snail1 transcription factor[J]. Molecular and Cellular Biology, 2008,28(15):4772-4781.
[23]GEORGAKOPOULOS-SOARES I, CHARTOUMPEKIS D V, KYRIAZOPOULOU V, et al. EMT factors and metabolic pathways in cancer[J]. Frontiers in Oncology, 2020,10:499.
(本文編辑黄建乡)

