发酵牛肉香肠肽的抗氧化稳定性研究
罗小婵,张永东,孔祥颖,张伟,臧容宇,余群力*,韩玲
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(张掖市畜牧兽医推广站,甘肃 张掖,734000)3(青海省海北藏族 自治州畜牧兽医科学研究所,青海 海北,812200)4(甘肃康美现代农牧产业集团有限公司,甘肃 临夏,731500)
近年来,随着人们食品安全意识的提高,抗氧化肽因安全性高、易吸收、活性强等优点引起了研究者的广泛关注[1-2]。目前,已有部分抗氧化肽作为功能性食品和药品实现了工业化生产[3-4]。抗氧化肽由蛋白质降解产生,在加工和贮藏过程中会发生水解、氧化、脱酰胺、环化等反应,导致肽链结构发生改变,进而影响其生物活性[5]。抗氧化肽的稳定性与溶液的酸碱性、温度和盐离子浓度等密切相关[6-7],因此,对其在不同环境下稳定性的研究极其重要。
发酵肉制品是指在自然或人工控制的环境中,利用微生物或酶的作用使原料肉发生一系列复杂变化,形成具有良好的贮藏性和独特风味、色泽与质地的肉制品,其在生产过程中蛋白质会发生强烈水解而产生具有生物活性的肽类物质[8]。郭世良等[9]酶解得到发酵酸肉肽,并发现强酸强碱、高温、高糖、高NaCl及铜、锌离子不利于其抗氧化活性的保持。ZHU等[10]用盐酸浸提得到金华火腿抗氧化肽,发现其在酸性和中性条件下抗氧化活性较好,模拟胃肠消化会降低其活性。栾晓旭等[5]用磷酸浸提法从猪肉发酵香肠中提取到多肽,并发现在高温和酸碱性环境中多肽活性丧失较快,糖类和NaCl会提高其自由基清除活性。可见,发酵肉制品中多肽抗氧化稳定性的研究主要集中在发酵酸肉、腌制火腿和猪肉香肠上,而以牛肉为原料制作的发酵香肠研究较少;同时,香肠制作方式不同,多肽提取方法不同,其抗氧化稳定性也可能产生差异。因此,以牛肉为试材制备发酵香肠,并探究其多肽在不同环境的稳定性显得尤为重要。
本试验采用盐酸浸提法从发酵牛肉香肠中得到具有强抗氧化活性的多肽,研究热处理、pH值、金属离子、常温贮存时间及模拟胃肠消化对其抗氧化活性的影响,为发酵牛肉香肠肽作为功能性食品和抗氧化剂的开发、生产和应用提供一定的理论和试验依据。
1 材料与方法
1.1 材料与试剂
牛后腿肉,采自甘肃康美现代农牧产业集团有限公司;猪背膘、肠衣、食盐等,购于江苏雨润肉食品有限公司;发酵剂(包括乳酸片球菌与戊糖片球菌),科汉森食品添加剂有限公司;DPPH、亚硝酸钠、抗坏血酸、胃蛋白酶、胰蛋白酶,日本Solarbio公司;浓硫酸、浓盐酸、三氯乙酸、水杨酸等(分析纯),乙腈、甲醇、正己烷等(色谱纯),兰州新区鑫鑫尚信试剂经销部。
1.2 仪器与设备
H2050R全自动高速冷冻离心机,北京海天友诚科技有限公司;RE-1001型旋转蒸发仪,上海亚荣生化仪器厂;SPectramax M2型酶标仪,美国美谷分子仪器有限公司;FR-500型组织匀浆机,宁波新芝科器研究所;UV-8000T型紫外可见分光光度计,上海元析仪器有限公司;Rigol L3000高效液相色谱仪,德国SYKAM公司;ES2030冷冻干燥机,宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 发酵牛肉香肠的制备
工艺流程如下:
原料肉预处理→瘦肉绞碎、肥肉切丁→添加辅料、搅拌腌制→灌肠→发酵→干燥成熟→真空包装→成品
操作要点:牛后腿肉要求新鲜,无筋膜、淤血及其他杂质,与猪背部脂肪一起漂洗干净,将瘦肉搅碎,肥肉切丁,按m(肥)∶m(瘦)=2∶8混合,以混合后的肉质量为基础,其他配料按盐2.5%、抗坏血酸0.05%、亚硝酸钠0.005%、蔗糖1%、葡萄糖1%、水10%和发酵剂0.025%添加(均为质量分数)不断搅拌直至调料均匀,颜色均一,肉馅之间有黏连性,然后在4 ℃腌制12 h。将腌制后的肉馅灌入肠衣,灌装过程中应注意排气,防止肠体爆裂,灌装后的肠体应饱满紧绷,无肉眼可见气泡。肠体清洗干净后在24 ℃和92%相对湿度下发酵3 d,然后在14 ℃ 和77%相对湿度条件发酵并干燥32 d。取样时,应去除肠衣,避免裸露产品表皮黏上白霉。
1.3.2 多肽的提取[10]
准确称取20 g样品,加入120 mL 0.06 mol/L HCl,匀浆(10 000 r/min,20 s×3),静置(4 ℃,2 h),离心(10 000 r/min,4 ℃,20 min)。上清液经纱布过滤后加入4倍体积30%乙醇,静置过夜(12 h),相同条件下再次离心,上清液经旋转蒸发、冷冻干燥得到多肽粉末。
1.3.3 体外抗氧化能力的测定
按照ZHU等[10]的方法测定DPPH自由基清除能力;参考冯美琴等[11]的方法测定羟自由基清除能力和铁还原抗氧化能力(ferric reducing antioxidant power,FRAP);参照YANG等[12]的方法测定清除超氧阴离子自由基的能力。
1.3.4 乳化活性与乳化稳定性的测定
参照GUO等[13]的方法测定乳化活性(emulsifying activity index,EAI)与乳化稳定性(emulsifying stability index,ESI)。以9∶1的体积比将多肽溶液与大豆油混合,乳化1 min后立即在距烧杯底5 mm处吸取30 μL乳化液,均匀分散在3 mL 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,测定500 nm处吸光度值,同时以0.1% SDS溶液作为空白。计算如公式(1)和公式(2)所示:
(1)
(2)
式中:A0、A10,静置0、10 min的吸光度;D,稀释倍数;c,肽溶液的质量浓度,g/mL;φ,油相体积分数;10 000,校正系数。
1.3.5 起泡特性与泡沫稳定性
参考张京涛等[14]的方法,多肽起泡特性的计算如公式(3)和公式(4)所示:
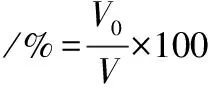
(3)

(4)
式中:V0、V30分别表示匀浆液静置0、30 min的泡沫体积。
1.3.6 游离氨基酸组成的测定
将100 μL样品、氨基酸标准品溶液(17种,2.5 μmol/mL)、三乙胺乙腈溶液(pH>7.0)混合,加入10 μL 正亮氨酸内标溶液和50 μL异硫氰酸苯酯乙腈溶液,静置1 h(25 ℃),再加入200 μL正己烷,静置10 min,下层溶液用0.45 μm滤膜过滤后上样分析。高效液相色谱采用Kromasil C18反相色谱柱(250 mm×4.6 mm,5 μm);进样量为10 μL;柱温为40 ℃;流速为1 mL/min;无水乙酸钠-乙腈水溶液(pH 6.5)作为流动相A;80%乙腈水溶液作为流动相B。
1.3.7 发酵牛肉香肠肽体外抗氧化能力的稳定性研究
1.3.7.1 热处理对多肽抗氧化活性的影响
将多肽在室温、40、60、80、100 ℃温度下分别处理20 min 以及在100 ℃条件下分别处理0、10、20、30、40 min,冷却至室温测定DPPH自由基清除率、FRAP。
1.3.7.2 pH对多肽抗氧化活性的影响
用HCl和NaOH(1 mol/L)调整多肽溶液pH值分别为3.0、5.0、7.0、9.0、11.0,室温振荡反应2 h,测定DPPH自由基清除率、FRAP。
1.3.7.3 金属离子对多肽抗氧化活性的影响
配制质量浓度为2 g/L的肽液,分别添加0、50、100、150、200、250 mg/L的NaCl和KCl,室温振荡反应2 h,测定样品的抗氧化能力。
1.3.7.4 贮存时间对多肽抗氧化活性的影响
将多肽提取液在常温下分别存放0、1、2、3、4 d,然后按照上述方法测其活性,研究贮存时间对其抗氧化活性的影响。
1.3.7.5 模拟胃肠消化对多肽抗氧化活性的影响
参照ZHU等[10]的方法并稍作修改。将多肽液pH值用HCl(1 mol/L)调至2.0,添加胃蛋白酶(3 000 U/mg),保持温度37 ℃,持续酶解2 h,酶解液置于沸水浴中灭酶10 min,冷却至室温后离心(4 ℃、6 000 r/min,10 min)。将上清液分为2份,1份用于测定多肽液经模拟胃消化后抗氧化活性的变化,另1份用NaOH(1 mol/L)调pH至7.0,添加胰蛋白酶(250 U/mg),保持温度37 ℃,持续酶解2 h后灭酶,冷却,离心,收集上清液,-20 ℃贮存备用。
1.4 数据处理与统计分析
每个处理做3次重复试验,数据采用SPSS 19.0软件进行显著性分析,结果以平均值±标准差表示,P<0.05表示差异显著,采用Origin 9.0软件进行绘图。
2 结果与分析
2.1 热处理对发酵香肠肽抗氧化活性的影响
热处理是食品加工中常用的手段,在较高温度下多肽能否保持高活性,是评价其是否具有商业潜力的重要因素[6]。由图1-a可知,常温时DPPH自由基清除活性为69.8%,100 ℃时清除活性为72.2%,升高了2.4%。这可能是因为高温处理虽然改变了多肽的空间构象,但其肽链并没有断裂,只是部分二级结构展开,暴露出一些活性位点,使DPPH自由基清除活性增强[15]。FRAP值在40 ℃时显著下降(P<0.05),之后温度对其无显著影响(P>0.05)。图1-b是同一温度不同处理时间对样品抗氧化能力的影响。DPPH自由基清除活性和FRAP值在加热10 min时显著下降(P<0.05),20 min后加热时间对DPPH自由基清除活性无显著影响(P>0.05),FRAP在30 min时最高。肖岚等[16]发现牦牛血低聚肽的羟自由基清除活性在100 ℃处理5 h仍有84.32%,与本实验结果一致。因此,发酵牛肉香肠肽具有较好的热稳定性,在其提取和加工处理中,热处理并不会影响其活性。
2.2 pH对发酵香肠肽抗氧化活性的影响
pH可通过影响肽的电离势和电子转移能力来影响肽的抗氧化活性[5]。由图2可知,在pH为3.0时,发酵香肠肽的DPPH自由基清除活性和FRAP值最高,分别为91.64%和0.306,之后随着pH上升显著下降(P<0.05)。在中性环境(pH 7.0)时,DPPH自由基清除活性仍能保持70%以上,当其处于碱性环境(pH 11.0),清除活性较pH 3.0下降了46.56%。因此,发酵香肠中多肽的DPPH自由基清除活性对碱性环境更敏感,肽类物质在碱性环境下会发生脱酰胺或外消旋反应,从而导致多肽活性下降[5]。综上所述,发酵牛肉香肠肽的耐碱性较弱,为了保持较好的抗氧化活性,应避免其处于强碱性环境中。
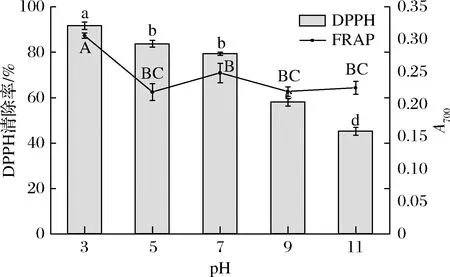
图2 pH对发酵香肠肽抗氧化活性的影响Fig.2 Changes in antioxidant activities of peptides extracted from fermented sausages in different pH
2.3 金属离子对发酵香肠肽抗氧化活性的影响
食品体系中金属离子广泛存在,摄入适量金属离子对机体的生理平衡有重要意义[6]。由图3-a可以看出,随着Na+浓度的提高,多肽的DPPH自由基清除活性显著上升,当Na+质量浓度为150 mg/L时,DPPH自由基清除活性达到最大值84.77%;相反地,FRAP值随Na+浓度升高显著降低(P<0.05);当Na+质量浓度为200 mg/L时,DPPH自由基清除活性和FRAP值均能达到较高水平。可能是因为NaCl溶液电离产生的Cl-和Na+能中和香肠多肽表面的电荷,使水化膜遭到破环,暴露出的供氢或供质子体与自由基结合,抗氧化活性随之增强[9]。
图3-b反映的是K+浓度对多肽抗氧化能力的影响。当K+的质量浓度为50 mg/L时,DPPH自由基清除活性达到最大值86.87%,但此时FRAP下降至最低值;当K+的质量浓度为150 mg/L时,DPPH自由基清除活性和FRAP值均维持在较高水平。PEREIRA等[17]研究指出肽与含有NaCl的食品基质之间的相互作用有利于肽生物活性的维持;孙浩等[7]研究发现K+会提高苦荞抗氧化肽AFYRW的·OH清除率,这与本实验的结果相一致。综上,适量的Na+、K+会增强发酵牛肉香肠肽的抗氧化活性,Na+质量浓度为200 mg/L,K+质量浓度为150 mg/L时抗氧化活性最好。

a-Na+浓度对抗氧化活性的影响;b-K+浓度对抗氧化活性的影响图3 Na+、K+浓度对发酵香肠肽抗氧化活性的影响Fig.3 Changes in antioxidant activities of peptides extracted from fermented sausages in different Na+ and K+ contents
2.4 贮存时间对发酵香肠肽抗氧化活性的影响
发酵香肠肽在提取分离过程中易长时间暴露在空气中,对活性产生影响。图4为其室温下处理0、1、2、3、4 d的结果。当处理1 d时,与对照相比DPPH自由基清除活性上升了约10%,当处理2 d时,活性下降显著(P<0.05),之后随处理时间延长无显著变化(P>0.05),FRAP整体变化差异不显著(P>0.05)。可能是因为肽段暴露在空气中发生了氧化反应或吸湿后发生了水解反应,导致多肽结构和氨基酸组成发生改变,使活性降低[18]。因此,对发酵牛肉香肠肽进行提取和分离时,应注意控制温度和时间,避免其长时间暴露在空气中。

图4 贮存时间对发酵香肠肽抗氧化活性的影响Fig.4 Changes in antioxidant activities of peptides extracted from fermented sausages in different storage time
2.5 模拟胃肠消化对发酵香肠肽活性的影响
2.5.1 模拟胃肠消化对发酵香肠肽乳化活性与乳化稳定性的影响
由图5可知,EAI与ESI的变化相似,经过2 h模拟胃消化后,EAI和ESI显著升高62%和16%(P<0.05)。这可能是因为肽段在胃蛋白酶的作用下持续水解,分子质量变小,一些疏水性基团暴露出来,增强了与油的结合能力,从而提高多肽乳化性[19]。在添加胰蛋白酶后,EAI和ESI显著下降(P<0.05),但EAI仍保持在80%以上,此时与消化前相比EAI升高了43%,ESI降低了18%。可能是因为随着胰蛋白酶的进一步作用,小分子肽水解过度,疏水基团暴露过多,打破了形成表面活性层的平衡,降低了乳化性能[13]。总的来说,模拟胃肠消化对香肠肽的乳化活性有一定提高,但不利于乳化稳定性。
2.5.2 模拟胃肠消化对发酵香肠肽起泡特性的影响
蛋白质起泡性与蛋白质的分子大小及表面极性基团有关,分子大小越合适,极性基团越多,起泡性就越高[20]。香肠肽仍以蛋白质为主体物质,可见其具有一定的乳化性能。由图6可知,多肽起泡性和泡沫稳定性经2 h模拟胃消化后显著升高(P<0.05),经第二阶段模拟肠道消化后又显著降低(P<0.05),较消化前起泡性和泡沫稳定性分别升高15%和11.7%。在一定酶解范围内,分子质量越小溶解性越好,此时更多的肽分子参与液膜的形成,起泡性增强,但肽链太短会使泡沫表面黏弹性降低,液膜间作用变弱,最终导致起泡性随分子质量减小反而下降[14]。总的来说,香肠多肽经模拟胃肠消化后具有较好的起泡特性。

图5 模拟胃肠消化对发酵香肠肽乳化特性的影响Fig.5 Effects of simulated gastrointestinal digestion on emulsifying properties of peptides extracted from fermented sausages

图6 模拟胃肠消化对发酵香肠肽起泡特性的影响Fig.6 Effects of simulated gastrointestinal digestion on foaming characteristics of peptides extracted from fermented sausages
2.5.3 模拟胃肠消化对发酵香肠肽抗氧化活性的影响
由图7可知,经2 h模拟胃消化后,DPPH自由基清除活性增加至74.2%(P<0.05),这可能是因为在模拟胃消化过程中暴露出更多的疏水性氨基酸侧链[8]。再经过第二阶段模拟肠消化后,DPPH自由基清除活性又显著下降至57.23%(P<0.05)。可能是因为经胰蛋白酶进一步酶解后,部分活性多肽裂解,疏水基团暴露过度,导致抗氧化活性降低[9]。清除超氧阴离子自由基的能力与DPPH自由基清除活性变化相似,经胃蛋白酶消化后,清除率从45.5%显著升高到74.5%,再经胰蛋白酶消化后又显著下降至64.1%(P<0.05)。羟自由基清除活性在2个消化阶段均显著升高(P<0.05),这与张淼[21]发现玉米蛋白水解物经体外消化后羟自由基清除能力显著增加的结果相似。模拟消化结束后,FRAP值从0.439显著增加至0.518(P<0.05),这可能与酶解液中显著增多的中性和酸性氨基酸有关[22]。经过模拟胃肠消化,多肽的羟自由基、超氧阴离子自由基清除活性及FRAP值分别升高31.86%、18.6%和0.079(P<0.05)。综上,发酵香肠中多肽含有抗氧化活性片段,且其被人体吸收后仍能发挥较大作用。

图7 模拟胃肠消化对发酵香肠肽抗氧化活性的影响Fig.7 Effects of simulated gastrointestinal digestion on antioxidant activities of peptides extracted from fermented sausages
2.5.4 模拟胃肠消化对发酵香肠肽游离氨基酸的影响
模拟胃肠消化对多肽游离氨基酸含量的影响如表1所示。总体来看,经模拟消化后,总游离氨基酸含量从322.146 mg/L显著增加到389.123 mg/L(P<0.05),这可能是因为胃蛋白酶和胰蛋白酶破坏了多肽的二级结构,将其水解成更小分子的肽,同时生成大量游离氨基酸[23]。研究表明,氨基酸在抗氧化反应中起重要作用,其作为电子供体,能够直接与自由基结合,形成有利于发挥抗氧化活性的构象[24]。经过2段酶解后,多肽液中Val、Pro、Ala、Leu、Tyr等疏水性氨基酸含量显著增高(P<0.05),Arg、Lys等具有金属离子螯合能力的氨基酸也显著增多(P<0.05)。

表1 模拟胃肠消化对发酵香肠肽游离氨基酸组成的影响 单位:mg/L
3 结论
本试验探究了多种加工贮存条件及模拟胃肠消化对发酵牛肉香肠中多肽抗氧化稳定性的影响。结果表明,热处理对发酵香肠多肽抗氧化活性无显著影响;酸性和中性环境有利于其抗氧化活性的保持;Na+、K+可促进多肽的抗氧化活性;长时间室温贮存不利于多肽抗氧化活性的保持;模拟胃肠消化后疏水性氨基酸增多,多肽抗氧化活性、乳化活性、起泡性和泡沫稳定性增强。发酵牛肉香肠肽具有较好的抗氧化稳定性,这为其合理开发及有效利用提供理论依据。

