三种滇黄精资源多糖及代谢相关酶活性的关系
张 磊,李彦莹,朱新焰,王家金,徐 哲,钱华丽,季鹏章,
(1. 云南中医药大学中药学院/云南省南药可持续利用研究重点实验室,昆明 650500;2. 云南省农业科学院药用植物研究所,昆明 650203)
【研究意义】中药黄精基源之一的滇黄精(PolygonatumkingianumColl. et Hemsl.)是云南道地药材,分布于云南、四川、贵州、广西等省(区),常见于海拔620~3650 m的阴湿林地、水沟边和灌木丛。多糖作为滇黄精品质的指标性成分,2020版《中国药典》规定,在黄精药材中含量不得少于7%[1]。黄精多糖作为主要活性成分,对人体具有抗肿瘤、抗氧化、抗炎抗菌、调节血糖血脂、抗病毒、增强免疫力及改善记忆力等作用[2-5],由葡萄糖、单一果糖、半乳糖等构成[6-11]。蔗糖是光合产物的主要运输形式,为代谢提供呼吸底物。蔗糖合成酶(Sucrose synthetase, SS)和磷酸蔗糖合成酶(Sucrose phosphate synthase, SPS)在糖代谢过程中将蔗糖转化为尿苷二磷酸葡萄糖(Uridine diphosphate glucose, UDPG)和果糖,蔗糖转化酶将蔗糖转化为果糖和葡萄糖,它们对糖代谢过程有着重要作用[12]。【前人研究进展】研究发现铁皮石斛、枸杞的多糖含量与SPS、SS、酸性转化酶(Acid invertase, AI)和中性转化酶(Neutral invertase, NI)有显著的相关性[13-15];尿苷二磷酸葡萄糖焦磷酸化酶(Uridine diphosphate glucose pyrophosphorylase, UGPase)是微生物多糖合成关键酶,几种药用植物分析表明UGPase等酶与多糖的合成有较强的相关性,如黄芪、灵芝多糖含量与UGPase、α-磷酸葡萄糖变位酶(α-glucophosphatase, α-PGM)和磷酸葡萄糖异构酶(Phosphoglucose isomerase, PGI)相关[16-17]。【本研究切入点】黄精多糖是黄精的主要有效成分,研究滇黄精种质资源多糖变化规律,对滇黄精良种选育、质量控制、道地药材品质挖掘有着重要意义。【拟解决的关键问题】以滇黄精种质资源为研究对象,筛选多糖差异显著的滇黄精资源进行多糖含量变化及其糖代谢相关酶活性的关系研究,旨在揭示差异种质滇黄精多糖变化及其糖代谢相关酶活性的关系,发掘不同种质滇黄精多糖合成差异的关键酶。
1 材料与方法
1.1 试验材料
13份滇黄精种质资源,为多年生野生植株,分别采集于滇黄精的主要产区:云南省昆明市、文山州、大理州、德宏州、普洱市、临沧市等地(表1),经云南中医药大学徐福荣研究员鉴定为百合科植物滇黄精(Polygonatumkingianum)。上述资源种植于云南中医药大学滇源基地。按照滇黄精规范化栽培技术统一种植管理,于2019年11月采集,备用。

表1 滇黄精资源信息
1.2 滇黄精种质资源多糖含量及组分测定
1.2.1 多糖含量的紫外分光光度计测定 (1)溶液前处理。参照2020版药典[1]中对黄精多糖含量测定进行优化:取新鲜滇黄精块茎切块,于45 ℃烘干,打粉过50目筛,精确称取0.2 g放200 mL烧杯中,加80%乙醇150 mL,用塑料膜封口,沸水浴1 h,趁热过滤,用80%热乙醇洗涤滤渣3次,将洗涤过的滤渣和滤纸放入干净烧杯中,加水150 mL,用塑料膜封口,沸水浴1 h,趁热过滤,将洗液和滤液合并倒入200 mL容量瓶中定容,备用。
(2)对照品溶液制备。取无水葡萄糖对照品33 mg,加水定容至100 mL。
(3)标准曲线制备。取对照品溶液0、0.2、0.4、0.6、0.8、1.0 mL,分别置25 mL具塞试管中,加水至2 mL,混匀,放置冰水浴中缓慢加入0.2%蒽酮—硫酸溶液至10 mL,摇匀,放冷后沸水浴10 min,立即取出冰水浴10 min,在582 nm处对吸光度进行测定。将浓度作为横坐标(x)、吸光度作为纵坐标(y)绘制标准曲线。
(4)多糖测定。取供试液1 mL,平行重复3次,置25 mL具塞试管中,参照(3)标准曲线制备的方法,从“加水至2 mL”进行测定,根据标准曲线计算滇黄精多糖含量。
1.2.2 多糖含量的HPLC测定 参照秦垂新等[18]适当调整。
(1)对照品溶液的制备。取对照品加水配制成单糖混合对照品溶液(各单糖浓度为10 g/L)。取混合对照品溶液500 μL加入5 mL的安瓶中,加入0.2 mol/L氢氧化钠溶液500 μL摇匀,加入0.5 mol/L PMP 500 μL,70 ℃反应60 min。取出,自然冷却,加入0.2 mol/L盐酸溶液500 μL混匀,转移至5 mL离心管中。加入三氯甲烷2 mL混匀,3000 r/min离心10 min,弃三氯甲烷层,多次重复直至三氯甲烷层无色,水层为对照品溶液。
(2)供试品多糖溶液的制备。将本品50~60 ℃减压干燥,粉碎,过20目筛,称取粉末2.5 g,加入80%乙醇100 mL,超声提取1 h,滤过,用80%乙醇将滤器与滤渣洗涤3次,每次10 mL,将滤纸连同滤渣置于烧瓶中,加水100 mL,回流提取1 h,取出,趁热抽滤,用热水将烧瓶与残渣洗涤4次,每次10 mL,将滤液与洗液合并,浓缩至10 mL,自然冷却,5000 r/min离心20 min,取上清液转移至10 mL量瓶中,加水定容,摇匀。加入无水乙醇40 mL,慢加快搅,置5~10 ℃冰箱中放置12 h, 5000 r/min离心10 min,弃上清液,用80%乙醇将沉淀洗涤2次,每次10 mL,5000 r/min离心10 min,再用无水乙醇洗涤2次,每次10 mL,5000 r/min离心10 min,弃上清液,加热水溶解沉淀,转移至5 mL量瓶中,自然冷却后加水定容,摇匀,得粗多糖溶液。
(3)多糖溶液的三氟乙酸(Trifluoroacetic acid, TFA)部分酸水解方法。取粗多糖溶液500 μL,置于5 mL安瓶中,加入0.4 mol/L TFA溶液500 μL,封口后置110 ℃水解7 h,取出,自然冷却,水浴蒸干,残渣加入甲醇1 mL搅拌,蒸干以去除TFA,重复多次,加热水溶解沉淀,转移至1 mL量瓶中,自然冷却,加水定容,摇匀,得粗多糖水解溶液。
(4)1-苯基-3-甲基-5-吡唑啉酮(1-Phenyl-3-methyl-5-pyrazolone, PMP)衍生化方法。吸取(3)项中粗多糖水解溶液500 μL,置于5 mL安瓶中,加入0.2 mol/L氢氧化钠溶液100 μL混匀,加入0.5 mol/L PMP 500 μL,在70 ℃下衍生反应60 min。取出,自然冷却,加入0.2 mol/L盐酸溶液500 μL,转移至5 mL离心管中,加水至1 mL混匀。加入三氯甲烷1 mL,混匀,3000 r/min离心10 min,弃三氯甲烷层,多次重复直至三氯甲烷层无色,水层为供试品溶液。
(5)色谱条件。HPLC: Agilent 1260。色谱柱:Agilent ZORBAX Eclipse XDB C18(4.6 mm×250 mm, 5 μm), 流动相0.1 mol/L磷酸盐缓冲溶液(pH 6.8)-乙腈(85∶15)检测波长250 mm, 柱温40 ℃,流速0.8 mL/min。
1.3 代谢酶活性测定
1.3.1 AI、NI、SS、SPS酶活性测定 参照陈梓云[13]的方法适当调整。SS、SPS提取:称取滇黄精样品0.7 g于研钵中,液氮快速研磨成粉末,转移至另一研钵,加入3 mL提取剂迅速研磨均匀,再以4 mL提取剂清洗研钵,将洗液一并倒入离心管中,2 ℃离心10 min(12 000 r/min),取上清液进行酶活测定;NI、AI提取:取滇黄精样品0.7 g,液氮研磨成粉末,迅速转入另一研钵,加入3 mL提取剂,快速研磨均匀,另取4 mL提取剂冲洗研钵,将洗液一并转入离心管,3 ℃离心10 min(12 000 r/min),取上清液进行测定。
1.3.2 UGPase酶活性测定 酶提取:取滇黄精新鲜植株块茎1 g,液氮研磨成粉末,迅速转入另一研钵,加入提取剂6 mL,快速研磨均匀,另取提取剂4 mL冲洗研钵,将洗液一并转入离心管,3 ℃离心20 min(3000 r/min),取上清液进行测定。提取剂包括0.1 mol/L磷酸缓冲液(pH 7.5),2.5 mmol/L MgCl2,2.5 mmol/L DTT,2.5% PVPP。测定:采用酶联免疫法和酶标仪测定。
1.4 数据分析
采用软件GraphPad Prism 7进行作图,使用软件SPSS Statistics 19.0进行差异显著性检验和相关性分析。
2 结果与分析
2.1 滇黄精种质资源的多糖含量分析
不同产地的滇黄精资源多糖含量存在显著差异。东川H1、东川H2、马关H4、文山H5、永平H6、文山H7、临翔H8、广南H9、广南H10、广南H11、广南H12、梁河H13、思茅H14的多糖含量分别为7.63%、10.50%、15.23%、12.01%、11.27%、19.15%、16.45%、22.02%、9.87%、19.22%、29.36%、13.69%、10.2%(图1)。广南H12多糖含量最高(29.36%),东川H1多糖含量最低(7.63%),广南H12多糖含量是东川H1的4倍,两份种质多糖含量存在极显著差异。据此,选择H1代表低含量多糖种质、H9代表中含量多糖种质、H12代表高含量多糖种质进行多糖组分及其相关酶活性的分析。
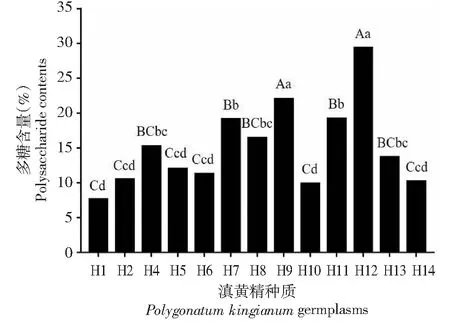
不同字母表示具有显著性差异(大写字母:P<0.01;小写字母:P<0.05)。下同
2.2 H1、H9和H12糖分含量变化特征
滇黄精糖分主要有果糖、蔗糖和葡萄糖等。H1、H9和H12的果糖含量分别为1.18%、6.00%和8.20%;蔗糖含量分别为10.12%、18.33%和25.42%;葡萄糖含量分别为0.25%、0.63%和0.68%。H1、H9和H12种质的蔗糖、果糖和葡萄糖含量均存在显著差异,并随多糖含量增加而增加(图2)。

图2 不同种质滇黄精种质多糖组分及含量分析
2.3 H1、H9和H12代谢酶活性及特征
H1、H9和H12种质5种酶活性由高到低顺序为NI>AI>SPS>SS>UGPase,其中NI活性最高,UGPase活性最低;NI酶活性为606.67~623.33 mg/(g·h);AI酶活性为473.33~506.67 mg/(g·h);SPS酶活性为36.00~99.60 mg/(g·h);SS酶活性为3.59~30.07 mg/(g·h);UGPase酶活性为20.75 ~ 23.07 μg/(g·h)。H1、H9和H12多糖含量分别为7.63%、22.02%和29.36%。5种酶活性变化与多糖含量变化均呈由低到高的趋势(表2,图3)。
5种酶活性H1为最低,H12为最高。H1、H9和H12中SPS、SS的变化差异最大,SPS活性最高和最低值相差近3倍,SS活性最高和最低值相差近9倍;H1、H9和H12中AI、NI活性变化小,AI活性最高值与最低值仅相差33.34活性单位,且H9和H12基本一致;H1、H9和H12种质间UGPase活性呈平缓递增(表2、图3)。
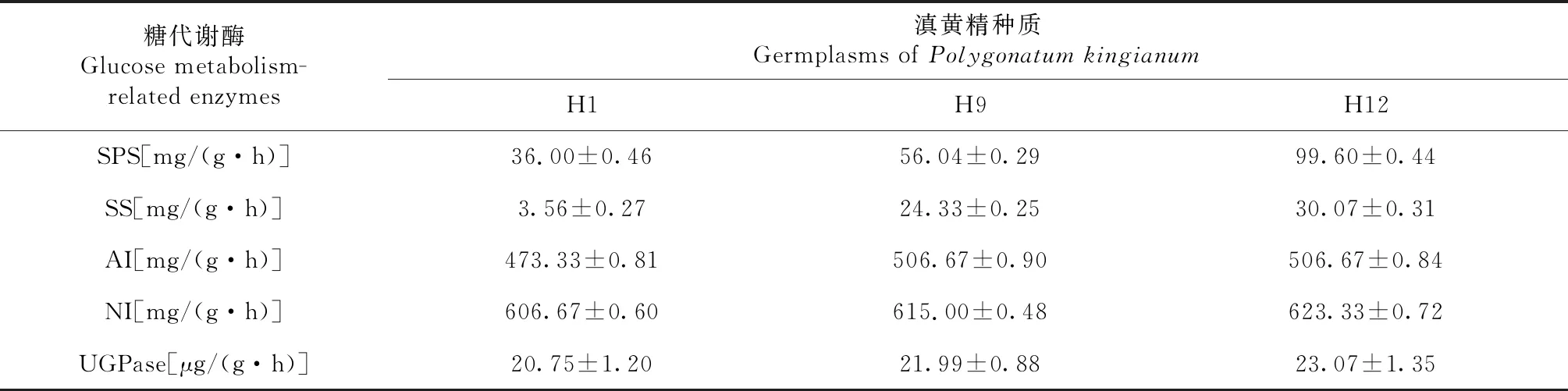
表2 不同种质滇黄精蔗糖相关代谢酶活性
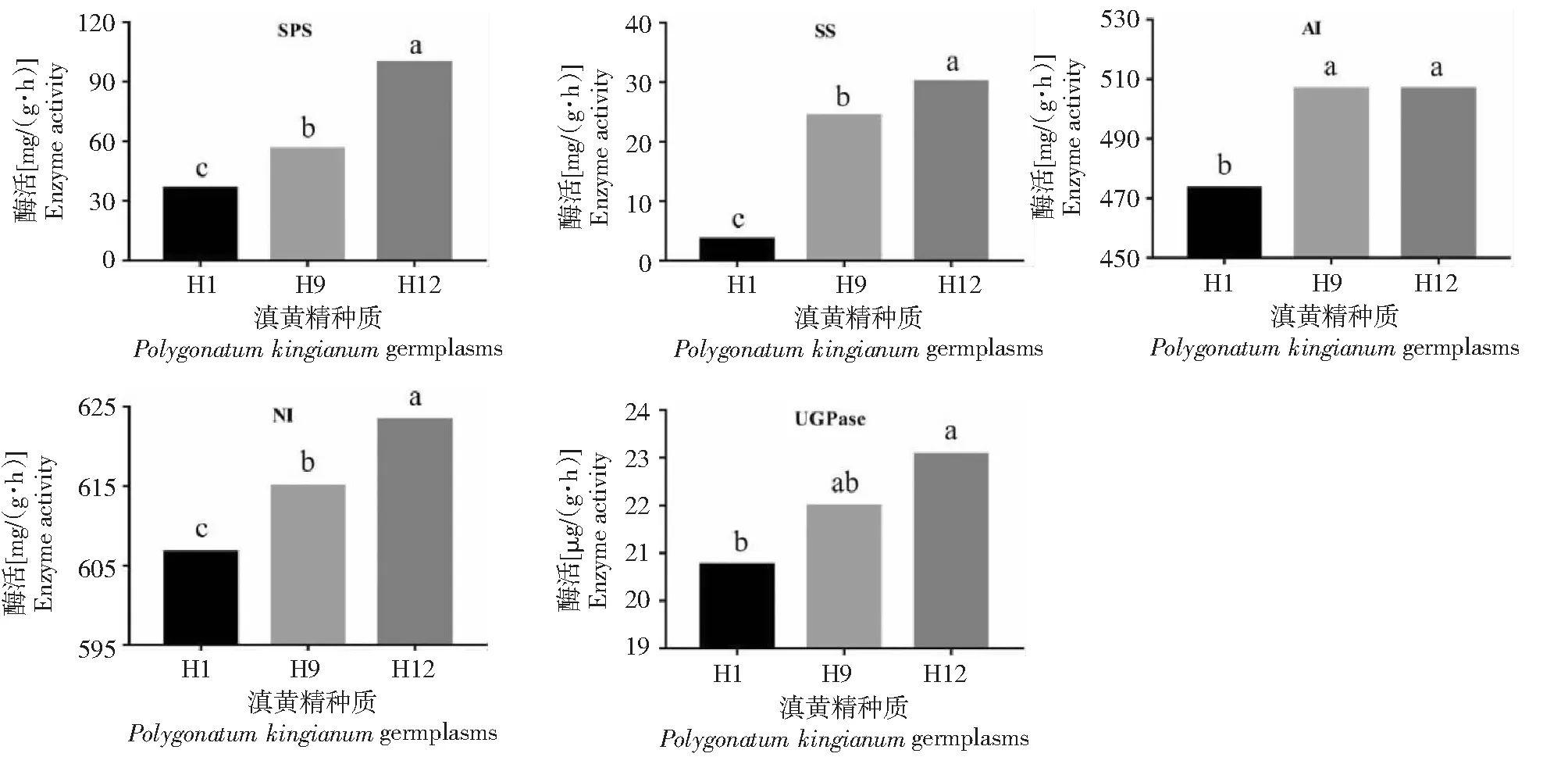
图3 不同滇黄精种质5种酶活性分析
2.4 多糖与代谢酶活性相关性分析
对H1、H9和H12进行多糖组分及其相关代谢酶活性相关性分析,由表3可知,滇黄精种质中,蔗糖含量与UGPase活性呈极显著正相关,相关系数为1.000;蔗糖与NI的活性呈显著正相关,相关系数为0.999;蔗糖与其他酶活性无显著相关性;NI活性与UGPase活性呈显著正相关,相关系数为0.999;果糖、葡萄糖与SPS、SS、AI、NI呈正相关,但不显著。
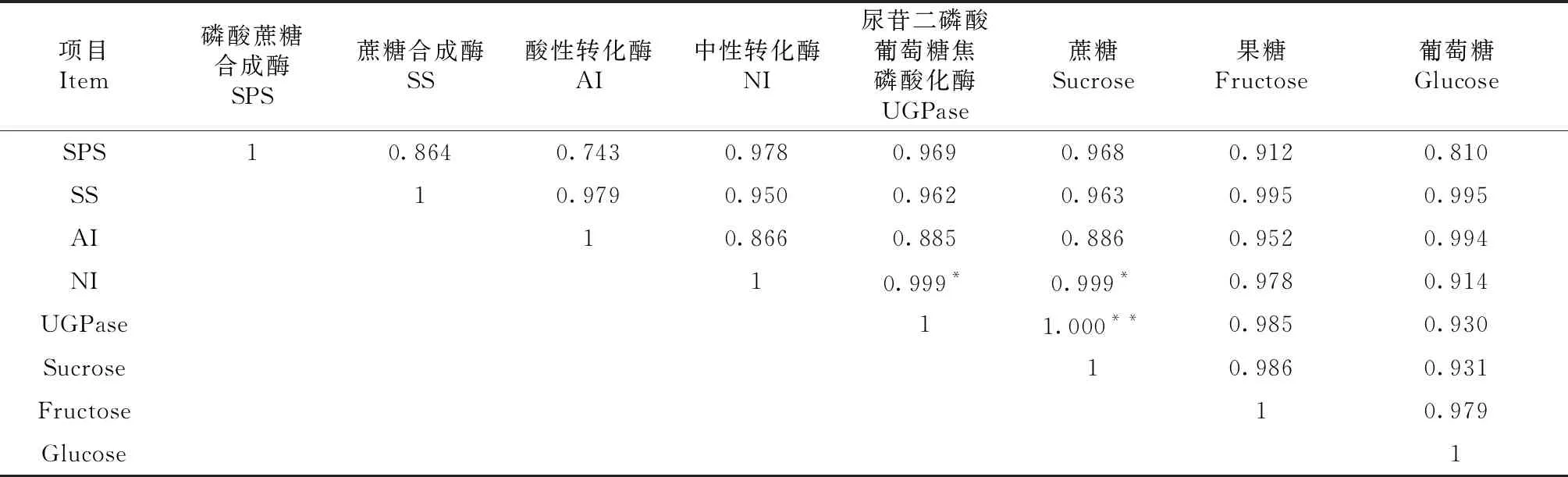
表3 多糖组分与多糖代谢酶活性相关性分析
3 讨 论
云南是滇黄精的主要分布中心,种质资源非常丰富。滇黄精药用部位为根茎,滇黄精根状茎近圆柱形或近连珠状、结节有时作不规则菱状,肥厚、直径1~5 cm,新鲜根茎富含水分。王彩步等[19]发现云南不同滇黄精资源多糖含量存在差异,在6.70%~14.28%;通过研究,13份种质多糖含量为7.63%~29.36%,差异也明显。进一步分析,滇黄精H1、H9和H12块茎蔗糖含量均高于果糖、葡萄糖,其中葡萄糖含量最低、蔗糖含量差异最大,表明蔗糖代谢是滇黄精多糖代谢的主要代谢途径之一。酶活性分析:不同种质的5种酶活性差异明显,表明不同种质的多糖积累会有差异,可能与其遗传基因和酶活性表达差异有关;通过不同种质多糖含量和相关酶活性的相关性分析发现,滇黄精块茎中蔗糖含量与UGPase、NI酶活性呈极显著正相关。
UGPase是植物中糖代谢的主要酶类之一,催化尿苷三磷酸和一磷酸葡萄糖可逆反应形成尿苷二磷酸—葡萄糖和焦磷酸,其中尿苷二磷酸—葡萄糖是高等植物中糖合成途径中关键成分,是多糖类合成的葡萄糖基供体[20]。Spychalla等[21]发现,UGPase多集中在根茎等非光合作用的贮藏组织中。吴晓俊等[22]认为,UGPase在植物的非光合作用组织, 尤其是储藏组织中的含量较高。吴晓俊等[16]通过分析黄芪毛状根中UGPase活性与多糖含量的关系,发现UGPase是黄芪多糖合成的关键酶;蔗糖转化酶不可逆催化蔗糖水解为葡萄糖和果糖,是蔗糖代谢关键酶之一[12]。Bachelier等[23]认为,位于细胞壁中的蔗糖转化酶能调节蔗糖从韧皮部卸出从而控制吸收累积,而位于液泡中的转化酶可以调节蔗糖和己糖的贮存。在甜瓜快速膨大的幼嫩组织中,转化酶活性非常高[24]。可溶性NI为碗豆的生长提供足够的己糖[25],NI在草莓果实发育的中期阶段最高,而后下降,但成熟时活性大于AI[26]。赵建华等[14]对不同果色枸杞果实糖含量和蔗糖代谢酶活性分析,发现红色与黑色枸杞己糖含量与NI呈显著相关。
通过研究验证了上述结果,滇黄精的块茎中UGPase活性较高,其多糖含量和UGPase活性呈正相关;滇黄精块茎中NI活性较高,其多糖含量和NI活性呈正相关。表明不同种质滇黄精中蔗糖的积累、形成与UGPase、NI这两种酶的活性密切相关,NI活性和UGPase活性的提高有利于滇黄精中蔗糖的积累。通过研究初步阐明了不同种质滇黄精多糖含量及其相关代谢酶的特征和变化关系,但相关分子机理仍不清楚,需要开展转录组、代谢组等分子机理研究,探明不同种质滇黄精多糖积累的分子机制。
4 结 论
以滇黄精种质资源为对象,对多糖差异显著的滇黄精种质的多糖含量变化及其糖代谢相关酶活性的相关性进行研究,发现不同产地的滇黄精资源多糖含量差异明显;蔗糖、果糖和葡萄糖含量随滇黄精多糖含量的增加而增加;5种酶活性由高到低顺序为NI>AI>SPS>SS>UGPase,且酶活性随多糖含量升高而升高;UGPase、NI与滇黄精蔗糖积累呈显著的正相关(P<0.05)。推测NI、UGPase是不同种质滇黄精多糖合成的关键酶。研究结果可为滇黄精良种选育、质量控制、道地药材品质挖掘提供参考。

