4种LED光源对1龄赤点石斑鱼生长和发育的影响
徐文刚,刘立明,王九龙,于文松,张建柏,征矢野清,唐永政
( 1.烟台大学 海洋学院,山东 烟台 264005; 2.烟台市海洋经济研究院,山东 烟台 264003; 3.长崎大学 环中国东海环境资源研究所,日本 长崎 851-2213 )

鱼类成长周期中,内分泌系统中的脑—垂体—性腺轴(BPG轴)分泌的激素能够调节其生长、发育、繁殖、新陈代谢和能量平衡[12]。研究表明,光质能改变鱼类昼夜节律,调节BPG轴中与生长相关激素的分泌而影响生长[12-13]。生长激素(GH)在脑垂体中合成,主要调节生长和新陈代谢,生长抑素前体-Ⅰ(PSS-Ⅰ)在脑中合成并能抑制生长激素的合成和分泌,神经肽Y(NPY)则能刺激食欲并影响昼夜节律[12]。光质通过调节鱼类GH、PSS-Ⅰ和NPY基因的合成而影响其生长[14]。Shin等[15]报道,绿光和蓝光比红光更能有效促进克氏双锯鱼(Amphiprionclarkii)中GH基因的合成而加速其生长。
光质不仅能影响鱼类的生长,也能通过调节BPG轴中与繁殖相关激素的合成而影响其繁殖。已有研究表明,光质能调节河鲈(Percafluviatilis)[16]和星点东方鲀(Takifuguniphobles)[17]脑垂体中促性腺激素(GtHs)的分泌而影响其性成熟。GtHs基因中的β亚基单元有两种类型:促卵泡激素(FSHβ)和黄体生成素(LHβ),FSHβ和LHβ基因受到下丘脑中促性腺激素释放激素(GnRH)的调节[12]。近年研究表明,脑中分泌的Kisspeptin激素处于上游调控阶段,能够调节GnRH和GtHs基因的合成和分泌。Kisspeptin基因中的Kiss1和Kiss2基因与其受体G蛋白偶联受体54(GPR54)结合后直接刺激GnRH神经元,从而促进GtHs基因的合成,其功能与鱼类的BPG轴相对应[18-19]。Shin等[20-22]报道,光质不仅能影响金鱼(Carassiusauratus)繁殖系统中各激素的合成和分泌,也能影响红鳍东方鲀(T.rubripes)的生长和星点东方鲀[17]的成熟。因此,笔者以日本海域较具代表性的赤点石斑鱼为研究对象,探究不同光质LED光源对其1龄个体生长和性腺发育的影响;同时也探究不同光质对试验鱼脑和脑垂体中与生长相关的基因如GH、PSS-Ⅰ和NPY,以及与繁殖相关的基因如Kiss1、Kiss2、GPR54、sbGnRH、FSHβ和LHβ表达量的影响,以期为未来石斑鱼工业化高效养殖、资源保护及人工繁殖方面提供基础生物学资料和理论依据。
1 材料与方法
1.1 试验材料和设计
取168尾1龄左右赤点石斑鱼[体质量(42.29±0.77) g,体长(15.6±0.07) cm],其中8尾作为试验开始前的对照样本,余下160尾饲养在4个装有开放式流水系统和曝气装置的500 L水槽中,每个水槽放置40尾试验鱼,待其适应水温和摄食等条件后开始试验,试验时间为2018年7月24日至9月23日。各组试验鱼暴露在白光色温3000 K、红光590 nm、蓝光480 nm、绿光520 nm 4种不同光质LED光源下饲养2个月,并在四周覆盖黑色塑料布以避免自然光干扰。每个水槽放置8个0.72 W的LED灯,固定在距水面22~25 cm处,光照度约580 lx,光照周期为12L∶12D。试验期间水温为22.3~28.8 ℃(图1),盐度29~31,pH 7.9~8.3,溶解氧>5 mg/L,24 h增氧。试验期间每日早晚各投喂1次,观察试验鱼的摄食情况并记录每日摄食量和水温的变化,所用饲料为Ohitome EP2 (日清丸红饲料,日本)。试验期间无个体死亡。
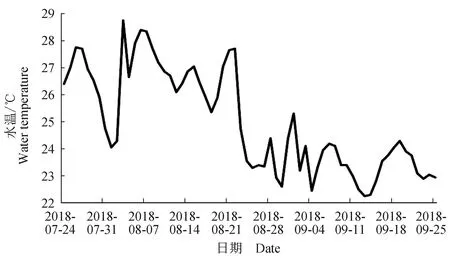
图1 7月24日至9月23日试验期间海水水温的变化
1.2 采样方法
1.2.1 体长和体质量的测定
试验开始时、试验1个月和2个月后,分别测量各水槽中每尾鱼的体长和体质量,并按下式计算肥满度(CF)、体质量增加率(wWGR,%)和特定生长率(RSG,%/d):
CF=100m/L3
(1)
wWGR=(mt-m0)/m0×100%
(2)
RSG=(lnmt-lnm0)/t×100%
(3)
式中,L为体长,m为体质量,mt为终末平均体质量,m0为初始平均体质量,t为饲育时间。
1.2.2 样品的采集
试验开始前对对照样本中的8尾鱼进行采样,试验结束时各光质组再分别取8尾鱼作为试验样本。使用2-苯氧乙醇将鱼麻醉后,测量其体长和体质量,然后取出性腺,称量质量后将其立即置于波恩试剂中,固定24 h后于70%乙醇中保存,用于组织学分析。随后打开头盖骨,取脑和脑垂体。由于所采集的脑部样品较大,将脑短暂保存于液氮后移至-80 ℃冰箱中长期保存,脑垂体置于RNAlater试剂(Ambion Inc.,Invitrogen Life Technologies,Japan)中4 ℃低温保存,1周后废弃RNAlater试剂,移至-80 ℃冰箱中长期保存,用于分子生物学试验。
1.2.3 性腺的组织学观察
组织学分析步骤参照文献[23]的方法,对赤点石斑鱼性腺进行常规梯度乙醇脱水、二甲苯透明、石蜡包埋和连续切片,厚度为5 μm。采用苏木精—伊红染色,中性树胶封片,Olympus FX380型光学显微镜观察并拍照,以个体中卵母细胞最发达阶段为性腺发育阶段。参照文献[24-25]的方法对性腺发育进行分期。
1.2.4 总RNA的提取与反转录
取冻存的赤点石斑鱼脑和脑垂体,参照TRIzol试剂盒(Life Technologies Corp.,USA)说明书进行总RNA提取,经1%琼脂凝胶电泳检测RNA完整度,用NanoDrop 2000分光光度计(Thermo Scientific Inc.,美国)检测RNA浓度。根据Transcriptor first strand cDNA synthesis(Roche Diagnostic GmbH,Mannheim,德国)说明书操作,取1 μg脑及脑垂体总RNA为反转录模板合成第一链cDNA,用于PCR扩增试验。
1.2.5 脑和脑垂体中各基因实时荧光定量PCR的检测
脑中PSS-Ⅰ、NPY、Kiss1、Kiss2、GPR54和sbGnRH基因以及脑垂体中GH、FSHβ和LHβ基因表达量的测定方法为根据基因库中各基因序列用Primer 3 Plus软件设计荧光定量引物,由Fasmac公司(Kanagawa,日本)合成,引物序列见表1。各基因的测定参照EvaGreen 2×qPCR MasterMix-Rox(Abm Inc.,加拿大)试剂盒上的说明书操作。PCR反应体系:cDNA模板2 μL,5 μL EvaGreen 2×qPCR MasterMix,上下游引物(10 pmol/μL)各0.3 μL,2.4 μL灭菌超纯水,总计10 μL。在CFX96 TouchTMReal-Time系统上(BioRad,美国)进行PCR反应,条件为:95 ℃预变性 10 min;94 ℃变性 45 s,58 ℃退火45 s,72 ℃延伸1 min,40个循环;95 ℃ 5 s,65 ℃ 1 min熔解;最后50 ℃冷却30 s。PCR反应后获得熔解曲线,检测数据用相对定量法进行统计分析,β-actin作为内参基因。

表1 实时荧光定量PCR反应中引物序列
1.3 数据处理
试验数据以平均值±标准差表示。采用SPSS 22.0软件对试验数据进行比较分析。并用Kolmogorov-Smirnov法进行正态分布检测,利用单因素方差分析,检验体长、体质量、肥满度以及各基因表达量的差异,运用Tukey′s HSD多重比较检验各组数据间的差异显著性,P<0.05时认为差异显著。
2 结果与分析
2.1 不同光质条件下赤点石斑鱼生长指数的差异
试验期间不同光质条件下赤点石斑鱼各生长指数的变化见表2。由表2可见,试验1个月后白光组鱼的体长显著高于蓝光和绿光组(P<0.05),体质量和肥满度显著高于其他光质组(P<0.05)。试验结束时,白光组鱼的体长显著高于蓝光和绿光组(P<0.05),体质量显著高于绿光组(P<0.05),但肥满度差异不显著(P>0.05)。试验结束时白光组鱼的体质量增加率高于其他光质组。

表2 试验期间不同光质条件下赤点石斑鱼各生长指数的变化
2.2 不同光质条件下试验鱼性腺发育的变化
试验开始时,试验鱼性腺发育处于染色质核仁期卵母细胞阶段(图2a)。卵巢内可见染色质核仁期卵母细胞,其直径略大于卵原细胞。卵母细胞核较大,占据卵母细胞大部分面积。试验结束时,各光质条件下试验鱼性腺发育均处于周边核仁期卵母细胞阶段(图2b1~b4)。卵母细胞细胞质体积增加且呈强烈嗜碱性;卵黄核出现且直径增加,核内有少量核仁分布。

图2 试验开始和结束时各光质条件下赤点石斑鱼的性腺发育
2.3 不同光质条件下试验鱼脑和脑垂体中与生长和繁殖相关各基因表达量的变化
试验鱼脑和脑垂体中PSS-Ⅰ、NPY和GH与生长相关基因表达量的变化见图3。试验结束时白光组试验鱼脑中PSS-Ⅰ基因表达量显著高于试验开始时的表达量(P<0.05);试验结束时各光质组NPY基因表达量均显著高于试验开始时的表达量(P<0.05);GH基因表达量在试验开始和结束时差异不显著(P>0.05)。
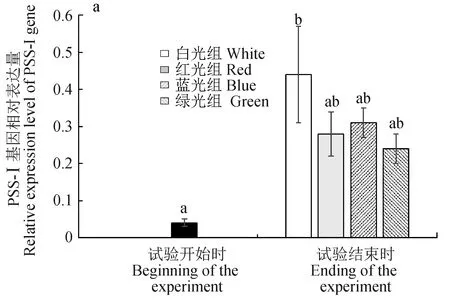
图3 试验开始和结束时不同光质条件下赤点石斑鱼脑和脑垂体中PSS-Ⅰ(a)、NPY(b)和GH(c)基因表达量的差异
试验鱼脑和脑垂体中Kiss1、Kiss2、GPR54、sbGnRH、FSHβ和LHβ与繁殖相关基因表达量的变化见图4。试验结束时,各光质条件下试验鱼脑中GPR54基因表达量均显著高于试验开始时的表达量(P<0.05),白光和蓝光组sbGnRH基因表达量显著高于试验开始时的表达量(P<0.05),但各光质条件下脑中Kiss1基因表达量在试验开始和结束时差异不显著(P>0.05)。试验开始时,试验鱼脑中Kiss2基因表达量太低未检测到,但试验结束时各光质条件下的表达量均有所增加。试验开始和结束时,各光质条件下试验鱼脑垂体中FSHβ和LHβ基因表达量差异不显著(P>0.05)。
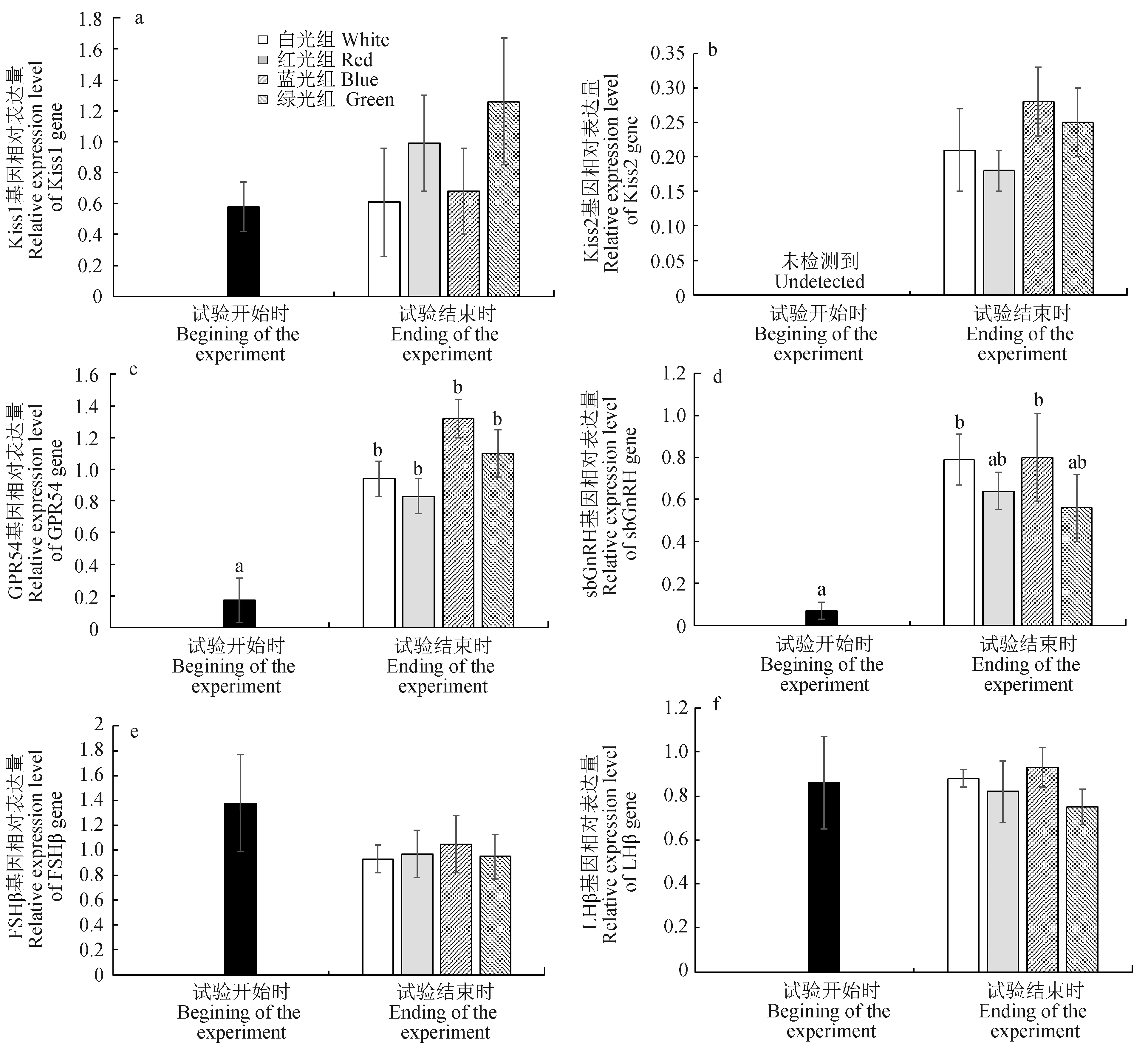
图4 试验开始和结束时不同光质条件下赤点石斑鱼脑和脑垂体中Kiss1(a)、Kiss2(b)、GPR54(c)、sbGnRH(d)、FSHβ(e)和LHβ(f)基因表达量的差异
3 讨 论
3.1 光质对试验鱼生长的影响
本试验中,赤点石斑鱼暴露在不同光质下2个月后,其体长、体质量和体质量增加率顺序为白光组>红光组>蓝光组>绿光组,其中白光组最高,绿光组最低。已有研究表明,水温13.6~16.7 ℃时,赤点石斑鱼暴露在蓝光下10周后比其他光质更能促进其体质量的增加[26]。此外,褐石斑鱼(E.bruneus)[27]暴露在绿光下生长率最高,而点带石斑鱼(E.coioides)[28]暴露在红光下死亡率最低。这些研究结果表明,当石斑鱼暴露在不同光质下,由于水温、环境和物种等因素的差异,光质对其生长的影响也有所不同。除石斑鱼外,光质也能影响其他鱼类的生长。研究表明,绿光有利于豹纹鳃棘鲈(Plectropomusleopardus)[13]的摄食、生长和存活,而黄光对红鳍东方鲀仔稚鱼[29]的生长和发育具有促进作用,红光和绿光不适合其生存。Luchiari等[30]报道,红光可能对尼罗罗非鱼(Oreochromisniloticus)的生长有害;而Volpato等[31]的研究表明,红光能刺激其进食,也有报道表明,蓝光更能促进其体长和体质量的增加[32]。以上的试验结果表明,不同LED光质能够影响鱼类的生长,同时,鱼类的生长还受鱼种、年龄、生理阶段、饲养条件和温度等条件差异的影响。
本试验中,白光组幼鱼肥满度在第1个月显著高于其他光质组,但2个月后差异却不显著。试验中第1个月的平均水温为26.7 ℃,此水温为赤点石斑鱼的最适生长条件,而第2个月的平均水温仅为23.4 ℃。已有研究表明,恒温26 ℃条件有助于加速赤点石斑鱼的生长[10]。对斑点叉尾(Ictaluruspunctatus)[33]和大口黑鲈(Micropterussalmoides)[34]的研究表明,在试验条件下,高水温能促进其生长。本试验中可能由于较高的水温和白光的综合作用使白光组幼鱼在第1个月获得较高的肥满度。
3.2 光质对试验鱼脑和垂体中与生长相关基因表达量的影响
试验结束时,各光质条件下试验鱼脑中的NPY基因表达量均显著高于试验开始时,表明4种光质均能有效促进赤点石斑鱼的食物吸收、新陈代谢和能量平衡。本试验中,虽然试验鱼暴露在白光下2个月后其体长和体质量均显著高于其他光质条件下,但白光组的GH基因表达量与其他光质条件下和试验开始时均无显著差异,而PSS-Ⅰ基因表达量却显著高于试验开始时。研究表明,GH基因主要用于调节鱼类的生长,而PSS-Ⅰ基因能够抑制GH基因的分泌[35]。本试验中,虽然白光组试验鱼脑中PSS-Ⅰ基因表达量显著增加,但其可能对GH基因的分泌没有很强的抑制作用,因此对试验鱼生长的抑制作用有限。已有研究表明,鱼类的生长受到内分泌因素如皮质醇、甲状腺激素以及与繁殖相关激素的综合影响,导致生长激素复杂的调节机制[36]。因此,进一步的研究需明确GH和PSS-Ⅰ基因具体的调节机制。
3.3 光质对试验鱼性腺发育以及脑和垂体中与繁殖相关基因表达量的影响
试验结束时,各光质条件下试验鱼性腺从染色质核仁期卵母细胞发育至周边核仁期卵母细胞,且各组试验鱼的GPR54基因表达量以及白光和蓝光组sbGnRH基因表达量均显著高于试验开始时,而FSHβ和LHβ基因在试验开始和结束时的表达量无显著差异。研究表明,内分泌系统中的Kiss、GnRH和GtHs基因在赤点石斑鱼[10]、星点东方鲀[37]、欧洲舌齿鲈(Dicentrachuslabrax)[38-39]和海鲈(Moronesaxatilis)[40]成熟和繁殖过程中起重要作用。此外,在鲑鱼[41]、星康吉鳗(Congermyriaster)[42]、鳗鲡(Anguillajaponica)[43]和欧洲舌齿鲈[44]中,FSHβ基因对性腺早期发育如精子和卵子的生长具有重要影响,而LHβ基因主要调控性腺发育的成熟阶段如排卵和排精等行为,表明FSHβ和LHβ基因与多数鱼类的性腺发育密切相关,且主要作用于青春期和成熟期。Tanaka等[45]报道,在人工养殖条件下,赤点石斑鱼在2龄进入青春期,3龄达到性成熟。而本试验中的赤点石斑鱼仅为1龄,性腺尚处于初级卵母细胞发育阶段,两者均远离成熟期。因此,与BPG轴功能相对应的Kiss、GnRH和GtHs基因的角色和功能在此阶段可能并不明显,即使GPR54和sbGnRH基因表达量显著增加,可能也无法有效地诱导FSHβ和LHβ基因的合成与分泌,导致FSHβ和LHβ基因表达量无显著差异。类似结果也出现在对河鲈的研究中,当未成熟的雄性和雌性河鲈暴露在白光、红光、绿光或蓝光下10 d后,FSHβ和LHβ基因表达量无显著差异,原因可能是鱼的繁殖周期尚未开始[16]。然而,当金鱼暴露在白光、红光和绿光下4个月后,绿光下金鱼脑和垂体中Kiss1、GPR54、GnRH、FSHβ和LHβ基因表达量却显著增加,其性腺也处于成熟卵母细胞发育阶段,表明Kiss1、GPR54、GnRH、FSHβ和LHβ基因在其繁殖系统中起重要作用[20]。因此,进一步的研究需明确不同光质LED光源对成熟期赤点石斑鱼繁殖系统发育的影响。

