红鳍东方鲀幼鱼中性别分化相关基因的表达分析
姜洁明,沈旭芳,刘 鹰,4,张 琦,周慧婷,王 佳,闫红伟,王辰奇,刘 奇
( 1.大连海洋大学,辽宁 大连 116023; 2.设施渔业教育部重点实验室,辽宁 大连 116023; 3.辽宁师范大学,辽宁 大连 116029; 4.青岛海洋科学与技术试点国家实验室,山东 青岛 266237 )
红鳍东方鲀(Takifugurubripes),属鲀形目、鲀科、东方鲀属,是一种重要的海水经济鱼类。主要分布于西北太平洋区,从日本、俄罗斯和韩国沿海至我国东海均有分布,其味道鲜美、营养丰富,深受人们青睐。在日本和韩国,河鲀消费市场广阔,尤以红鳍东方鲀的消费量最大[1]。自2016年起,我国有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀(T.obscurus)加工经营,有力地促进了国内河鲀产业的发展[2]。
红鳍东方鲀是雌雄异体鱼类,虽然生长性能没有明显性别差异,但经济价值却有很大差异。一般雄鱼2年性成熟,雌鱼需要3年。在繁殖季节,红鳍东方鲀性腺质量可占体质量的20%~30%,其卵巢含有剧毒无法食用,但雄鱼的精巢无毒,且非常美味,我国称之为“西施乳”,日本称为“白子”,市场售价高达1400元/kg。因此,开发全雄育种将促进国内河鲀产业发展,并会带来巨大的经济效益[3]。解析出红鳍东方鲀的性别决定和分化的分子机制,将为全雄育种提供理论基础。
红鳍东方鲀具有XX/XY性别决定系统[4],其全基因组序列早在2002年就已公布[5]。它被认为是重要模式生物,其遗传性别可由抗缪勒氏激素受体Ⅱ型(amhr2)基因上的一个单核苷酸多态性(SNP)位点判定[6],可通过高分辨率熔解曲线分析(HRM)或直接测序法检测该SNP位点,从而有效判别其性别[7]。前期研究发现,红鳍东方鲀(孵化温度14 ℃,逐渐升温至24 ℃时)性腺一般在孵化后40 d逐渐出现卵巢腔,55~77 d出现输精管[8-9]。但由于红鳍东方鲀繁殖周期较长,且在发育早期,性腺微小难以分离,有关红鳍东方鲀性别分化的分子机制研究依然较为匮乏。
前期已分离出红鳍东方鲀未分化期(40 d)微小性腺组织,采用RNA-seq技术筛选出大量XX和XY个体差异表达基因。其中包括在其他鱼类性别决定及分化过程中也具有重要作用的基因,如doublesex和mab-3相关转录因子1(dmrt1)、性腺体细胞衍生因子(gsdf)、细胞色素P450第19家族A亚家族多肽1a(cyp19a1a)和叉头框蛋白L2(foxl2)基因等[10]。笔者拟在前期研究工作的基础上,以不同发育时期的性腺作为试验对象,查明上述基因的表达规律,以期为后续解析这些基因的功能奠定基础。
1 材料与方法
1.1 试验材料
红鳍东方鲀鱼卵购自大连某养殖厂,鱼卵质量150 g。
1.2 试验方法
1.2.1 养殖与样品采集
养殖试验设置3个生物学重复,分别将鱼卵置于300 L圆形养殖桶中曝气孵化。自孵化后第3天开始投喂轮虫,第12天开始投喂轮虫的同时添加卤虫(Artemia),第23天开始同时投喂配合饲料(海童1号沉降型饲料,三通生物工程,潍坊)和生物饵料,且配合饲料的投喂比例逐渐增多,生物饵料的投喂比例逐渐减少,第35天至第80天,仅投喂配合饲料。试验期间饱食投喂,日投喂2~4次。日换水2次,每次换水1/2,水中不断充气,光照周期为12L∶12D,水温(19±1) ℃。
在孵化后40、60、80 d,从3个生物学重复中各取30尾幼鱼做组织学切片,观察其性腺发育情况。每个取样点取60尾(20尾/桶),经麻醉,解剖出性腺。将每尾红鳍东方鲀的性腺分别放入装有100 μL RNAlater动物组织RNA稳定保存液(Ambion,美国)的离心管中,立即保存在-80 ℃冰箱中,用于RNA提取。同时,将所采集性腺相对应的每尾红鳍东方鲀的肌肉组织保存于无水乙醇中,-20 ℃冰箱保存,用于性别鉴定。
1.2.2 性腺组织学切片
样品经过梯度乙醇脱水,二甲苯透明、石蜡包埋,之后连续切片(5 μm),37 ℃烘片3 h后室温下冷却,然后用二甲苯脱蜡、复水,再经苏木精—伊红染色,脱水,二甲苯透明并封片。使用显微镜(卡尔蔡司,德国)观察性腺组织学结构、拍照[11]。
1.2.3 性别鉴定和RNA提取
用蛋白酶K处理(55 ℃,2 h)红鳍东方鲀肌肉组织后,用TIANamp海洋动物DNA试剂盒(天根,中国)提取基因组DNA。用琼脂糖凝胶电泳检测其质量后,为确定amhr2基因第9外显子上SNP的基因型,使用amhr2基因特异性引物SDexonF(5′-CAGATGCACACAAACCACCT-3′)和SDexonR(5′-TCCCAGTGTTGCGGTATGTA-3′)进行PCR扩增。扩增体系(共50 μL):ddH2O 30.5 μL,10×PCR Buffer 5 μL,dNTP Mix(2.5 mmol/L)8 μL,上、下游引物(10 mol/L)各2 μL,Taq DNA聚合酶(5 U/μL)0.5 μL,模板DNA(10倍稀释后使用)2 μL。PCR流程为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后在72 ℃延伸10 min,4 ℃保存。琼脂糖凝胶电泳检测之后,测序PCR产物。根据测序结果进行性别鉴定(图1),如果amhr2基因的SNP位点是杂合型,则对应个体为雄性;如果SNP位点是纯合型,则对应个体是雌性。将每个养殖桶性别相同的个体性腺组织混合后作为一个样本,分别用于RNA提取,使用RNeasy Mini RNA试剂盒(QIAGEN,德国)提取性腺组织中的总RNA,琼脂糖凝胶电泳检验其完整性,检测其浓度。提取的RNA置于-80 ℃冰箱中保存备用。
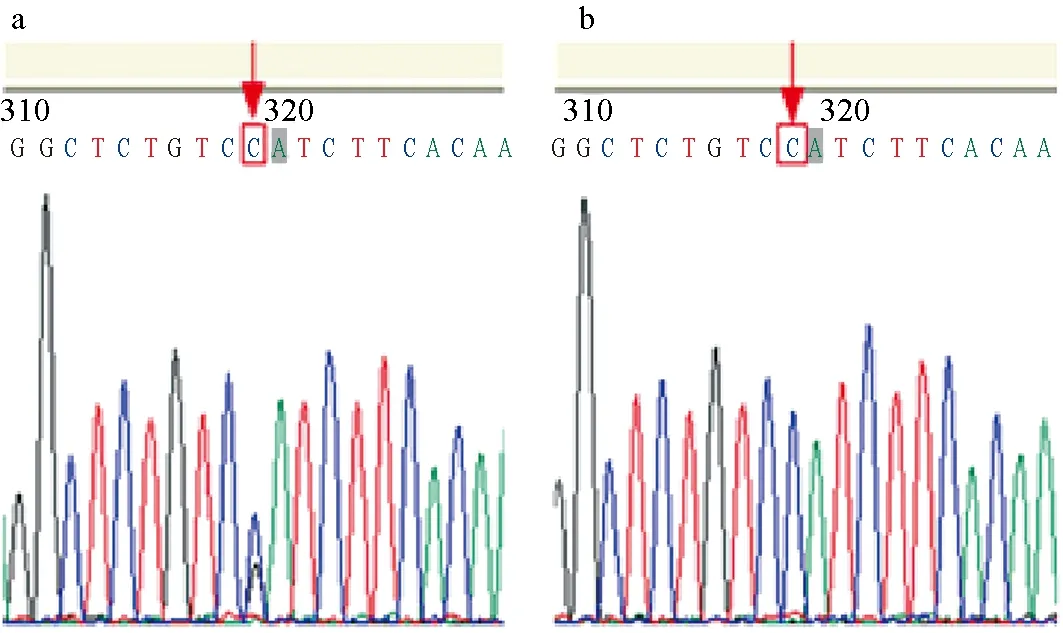
图1 雄性(a)和雌性(b)红鳍东方鲀的amhr2质谱图区别
使用实时荧光定量PCR(qRT-PCR)对3个取样时期(3个生物学重复)的2种遗传性别的共18个样品中的基因表达进行分析,分析的基因为文献[10]中筛选的在雄性红鳍东方鲀未分化性腺中2个雄性高表达的基因(gsdf、dmrt1)和2个雌性高表达的基因(cyp19a1a、foxl2),以及DNA甲基转移酶1(dnmt1)和amhr2基因。使用Primer Premier 5.0设计引物(表1)。用DNA酶Ⅰ预处理1 μg RNA(37 ℃,30 min),然后采用1st Strand cDNA Synthesis 试剂盒,进行cDNA的合成。使用β-actin做内参基因。使用Applied Biosystems 7900 HT Real-Time PCR System进行qRT-PCR。qRT-PCR反应体系(10 μL)为:ddH2O 6.15 μL,10×Ex Taq PCR Buffer 1 μL,dNTP Mix (2.5 mmol/L) 0.8 μL,上、下游引物(10 mol/L)各0.5 μL,Ex Taq DNA 聚合酶(5 U/μL)0.05 μL,模板cDNA 1 μL。具体步骤为:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后在72 ℃延伸10 min[10,12]。绘制熔融曲线,保证每对引物都能扩增出单一的PCR产物。

表1 试验用引物序列
1.2.5 统计分析
表达量的计算用2-ΔΔCt法处理。采用统计软件IBM SPSS 19.0(IBM,美国)中的t检验分析XX和XY个体性腺之间的基因表达量的差异显著性,使用Duncan′s多重检验法检验不同发育时期基因表达的显著性差异,显著性设定为P<0.05。
2 结 果
2.1 红鳍东方鲀性腺组织学观察
红鳍东方鲀性腺的组织学切片见图2。在孵化后40 d时,XX和XY个体未观察到形态上的性别分化,所有幼鱼均为未分化的性腺(表2)。孵化后60 d时,在观察的30尾鱼中,14尾雌性,16尾雄性,XX个体的卵巢腔开始形成,卵原细胞开始产生,XY个体的性腺为椭圆形或圆形,性腺中开始有大量精原细胞形成;孵化后80 d时,在观察的30尾鱼中,18尾雌性,12尾雄性,XX个体的卵巢内能够清楚地观察到由卵巢生殖上皮向卵巢腔凸起形成的产卵板和完整的卵巢腔,在产卵板上有大量的卵原细胞和少量的卵母细胞,在XY个体的精巢中,能够清楚地观察到完整的精巢结构,精巢由精小囊组成,内含精母细胞或精原细胞(图2)。
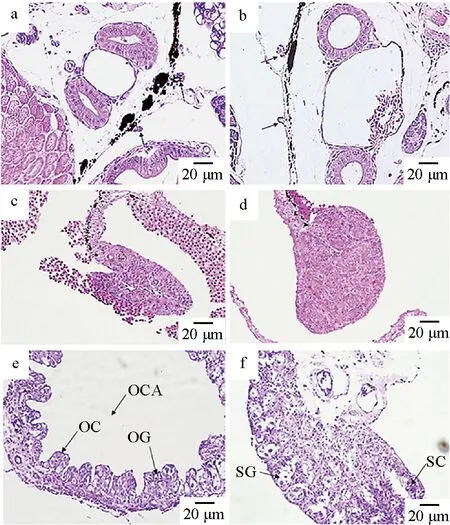
图2 孵化后40、60、80 d红鳍东方鲀性腺组织学观察结果

表2 不同采样时期红鳍东方鲀幼鱼性别比例
2.2 性别分化相关基因的表达量
采用qRT-PCR对XX和XY红鳍东方鲀幼鱼性腺中amhr2、dmrt1、gsdf、cyp19a1a、foxl2、dnmt1基因的表达模式进行分析,结果见图3。孵化后40、60 d,amhr2基因在XX和XY个体性腺中的表达量差异不显著(P>0.05),孵化后80 d,amhr2基因的表达量显著上升(P<0.05),且XX个体显著高于XY个体(P<0.05)(图3a)。在孵化后40、60、80 d,XY个体性腺中dmrt1的表达量均显著高于XX个体性腺中的表达量(P<0.05),且自孵化后40 d开始显著升高,在XX个体性腺中,dmrt1基因在孵化后80 d的表达量也显著高于在孵化后40、60 d的表达量,而孵化后40 d与60 d的表达量差异不显著(P>0.05)(图3b)。孵化后40、60、80 d,gsdf基因在XY个体性腺中的表达量也均显著高于在XX个体性腺中的表达量(P<0.05),且自孵化后40 d开始,其在XY个体性腺中表达量显著增加。自孵化后60 d开始,gsdf基因在XX个体性腺中表达量显著上升(P<0.05)(图3c)。孵化后40 d开始,cyp19a1a基因在XX个体性腺中的表达量均显著高于在XY个体性腺中的表达量,但在XX个体性腺中,孵化后60 d的表达量显著低于孵化后40、80 d的表达量(P<0.05)。在XY个体性腺中,cyp19a1a基因表达量从孵化后40 d开始逐渐上升,但在整个采样期间差异不显著(P>0.05)(图3d);foxl2基因的表达模式与cyp19a1a基因相同,整个采样期间,在XX个体性腺中的表达量均显著在高于XY个体性腺中的表达量(P<0.05),且在XX个体性腺中,孵化后80 d的表达量显著高于40、60 d的表达量;而在XY个体性腺中,foxl2基因在整个取样时期的表达量差异不显著(图3e)。孵化后40、60 d,dnmt1基因在XX和XY个体性腺中的表达量差异不显著(P>0.05),但在孵化后80 d, XY个体性腺中的表达显著高于XX个体性腺中的表达量(P<0.05)。同时,在XX个体性腺中,dnmt1基因在整个取样期间的表达差异不显著(P>0.05)(图3f)。
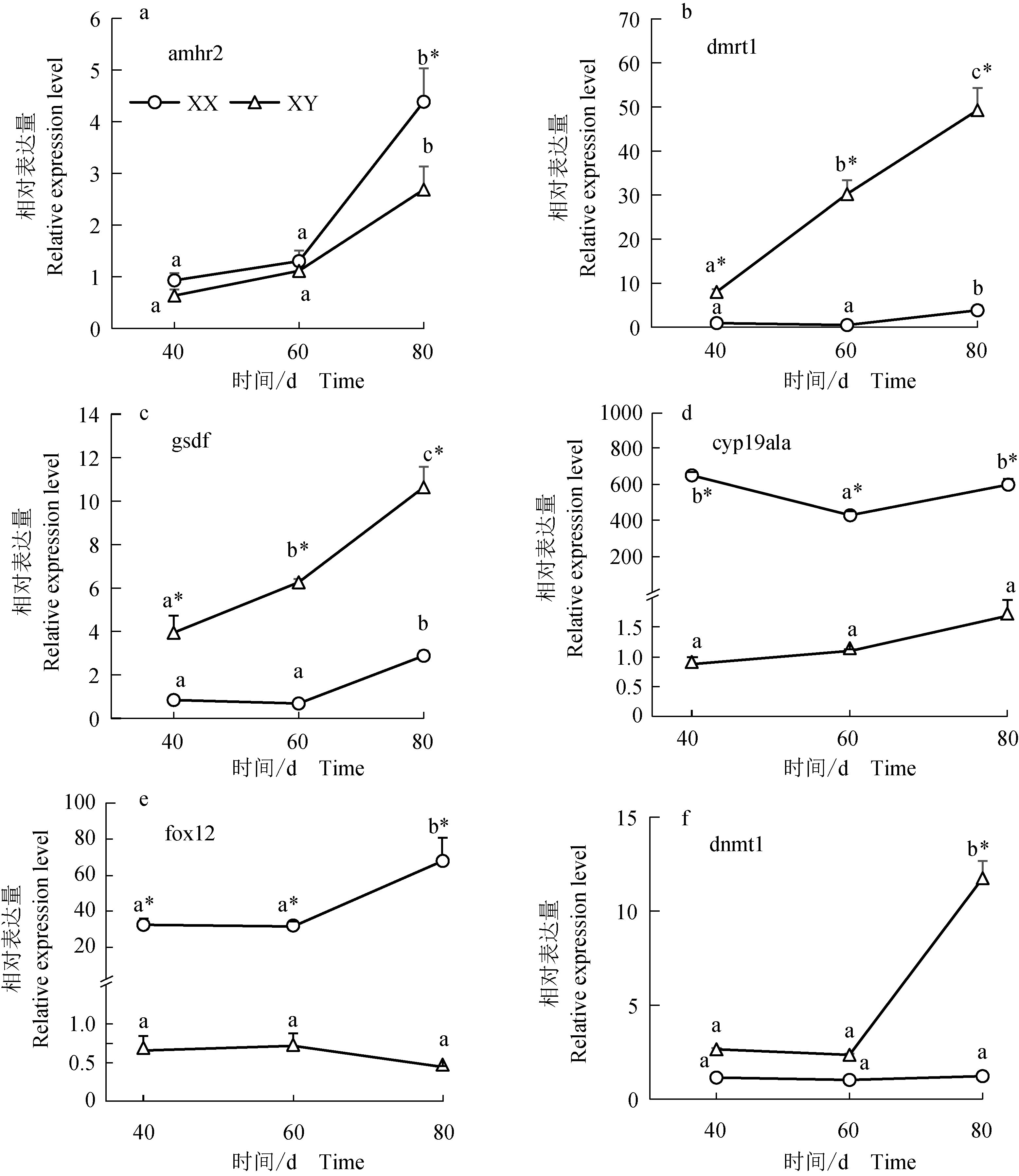
图3 孵化后40、60、80 d XX和XY红鳍东方鲀性腺中amhr2(a)、dmrt1(b)、gsdf(c)、cyp19a1a(d)、foxl2(e)以及dnmt1(f)基因表达水平
3 讨 论
在性别决定和分化这个复杂的过程中,一般认为,鱼类未分化的性腺最初具有向精巢或卵巢发育的双向潜能,当性别决定的“总开关”通过性别决定基因起始后,一类保守的性别决定和分化的遗传网络随之激活,这类下游性别相关基因能调控性类固醇激素的表达,从而控制着性腺发育最终分化为一个有功能的性腺并与性别表型相对应[13]。
3.1 性别决定位点所在基因amhr2基因表达
哺乳动物中有缪勒管结构,其形成是由于双潜能性腺分化为精巢之后,精巢支持细胞会产生抗缪勒氏激素(amh)抑制缪勒管的形成,抗缪勒氏激素主要通过amhr2在哺乳动物和其他脊椎动物生殖器官的发育和维持中发挥重要作用。鱼类无缪勒管结构,但是有的鱼类性腺中仍然发现有amh和amhr2基因表达[14]。Hattori等[15]在研究银汉鱼(Odonthesteshatcheri)时发现,将Y染色体特异性基因(amhy基因)敲除,会使XY个体发生由雄性到雌性的性别逆转,同时foxl2和cyp19a1a基因表达上调。使用CRISPR/Cas9基因敲除技术对尼罗罗非鱼(Oreochromisniloticus)进行amhr2基因外显子2和3进行突变,会导致由雄性到雌性的性别逆转[16]。Morinaga等[17]对XX青鳉(Oryziaslaatipes)进行amhr2基因突变,在纯合突变体中发现生殖细胞过度增殖导致腹部增大,因此卵巢增大。对成年鱼的研究结果显示,XX和XY突变体均不育,与野生对照型相比,寿命更短。通过对硬骨鱼中amh和amhr2基因突变体的研究,发现amh通路在生殖细胞增殖中有重要作用。在硬骨鱼类中,amh通路也控制性别,因此,amh在硬骨鱼生殖细胞发育中的生物学功能可能先于缪勒管的形成[18]。Kamiya等[6]在对红鳍东方鲀的研究中发现,amhr2基因中的一个错义SNP位点突变可能是其主要性别决定的候选基因。在这个位点(G/C)上,雄性是杂合子,而雌性是纯合子,在这个SNP位点上可以造成一个氨基酸的突变(His/Asp384)。前期结果表明,amhr2基因在2~10月龄雌雄红鳍东方鲀性腺中均有表达,表达部位在生殖细胞周围的体细胞中。笔者测定了红鳍东方鲀性别分化期雌雄性腺中amhr2基因的表达量,结果显示,amhr2基因的表达量在孵化后80 d显著上调,且卵巢中的表达量显著高于精巢中的表达量(P<0.05),说明amhr2基因不但在精巢分化中起作用,在卵巢形成中可能也起到一定作用。已有研究表明,amh及其受体在鱼类性别决定及分化过程中具有重要的作用[15-18],检测红鳍东方鲀性腺分子分化关键期amhr2基因的表达,有助于阐明性别分化早期的调控网络,并为性腺功能相关基因的研究提供新的信息。后续还应在红鳍东方鲀研究中采用基因敲除技术对amhr2上性别连锁的SNP位点进行突变,验证其在这一物种的功能。
3.2 雄性性别分化相关基因表达
Dmrt1基因为动物界中参与雄性性别决定和精巢分化的保守基因[19],它被证明是青鳉的性别决定因素[20]。在迄今研究的所有雌雄异体鱼类中,dmrt1基因的表达模式总是与精巢发生和进一步分化密切相关,与性别决定系统无关[19]。Dmrt1基因总是在鱼的精巢中高表达,在卵巢中低表达,青鳉中dmrt1基因的突变会诱导雌雄性别逆转[21]。对斑马鱼(Daniorerio)进行dmrt1基因突变,结果表明,XY个体表现出精巢发育缺陷和生殖细胞凋亡[22]。本试验结果表明,dmrt1基因在XY个体性腺中随着性腺发育表达量急剧增加,在孵化后80 d时表达量最高,在XX个体中孵化后80 d的表达量显著高于孵化后40、60 d,dmrt1基因在孵化后40、60、80 d XY个体中的表达量均显著高于XX个体。因此,这一功能基因正如在其他物种中所报道的那样,可能在红鳍东方鲀的精巢分化以及雄性性腺发育中同样发挥着重要作用。然而,本试验结果与Yamaguchi等[9]的报道存在一定差异。Yamaguchi等[9]认为,dmrt1基因在性别分化期仅在支持细胞中有一定量表达,并不存在性别二态性,因此认为dmrt1基因不参与红鳍东方鲀的精巢分化,而是在精子发生过程中仅仅参与精原细胞的增殖。原因可能是Yamaguchi[9]的研究仅依据逆转录PCR,而本试验中采用实时荧光定量PCR技术开展分析,结果更准确。
gsdf是一个仅在鱼类中发现的新的转化生长因子-β(TGF-β)超家族成员,且是硬骨鱼特有的性腺发育的功能基因。其首先在虹鳟(Oncorhynchusmykiss)[23]中被发现,并被确定为虹鳟精子发生的关键基因。在青鳉中,Y染色体上的gsdf基因已被证实是性别决定基因[24],青鳉中的gsdf-/-纯合突变诱导XY个体性腺进行卵巢分化[25-26]。Jiang等[27]认为,在尼罗罗非鱼中,gsdf基因是dmrt1基因的下游基因,gsdf基因可能通过抑制雌激素的产生诱导精巢分化。本试验中,gsdf基因也与dmrt1基因一样,在孵化后40、60、80 d XY个体中的表达量显著高于XX个体(P<0.05)。推测gsdf基因在红鳍东方鲀精巢分化中具有重要的作用,但其功能如何与其他性别分化相关基因(如dmrt1、cyp19a1a基因等)之间的上下游联系仍需深入研究。
3.3 雌性性别分化相关基因表达
雌激素在鱼类的性别分化中起着重要作用,由cyp19a1a基因编码的芳香化酶通过催化雄激素转化为17β-雌二醇(E2),负责雌二醇的合成[28]。已有研究表明[10],与类固醇生成途径相关的性腺差异表达基因cyp19a1a在卵巢中高表达;笔者用实时荧光定量PCR进一步分析了此基因在孵化后40、60、80 d的红鳍东方鲀性腺中的表达,结果显示cyp19a1a基因在孵化后40、60、80 d的XX个体中表达水平均显著高于在XY个体中的表达水平(P<0.05);本试验结果与在其他鱼类中的结果类似,表明cyp19a1a基因在红鳍东方鲀卵巢分化中具有重要作用且在鱼类性腺分化中的功能具有保守性。对雌性斑马鱼进行cyp19a1a基因的敲除导致了全雄性表型[29]。Wu等[30]对斑马鱼进行dmrt1和cyp19a1a基因的双突变,结果显示,cyp19a1a基因通过抑制dmrt1基因的表达在决定卵巢分化中起作用。此外,编码cyp19a1a激活转录因子的foxl2基因在雌性中的表达水平显著高于雄性,这可能是cyp19a1a基因在雌性中表达水平高于雄性的原因之一[31]。本试验中,XX个体性腺中foxl2基因的表达量在孵化后40、60、80 d均显著高于XY个体(P<0.05),推测foxl2基因可能通过调控cyp19a1a基因的表达进而影响其性别。在尼罗罗非鱼中,foxl2-/-的XX个体表现出雌—雄逆转,证明了foxl2基因在雌性分化中的作用[32]。在斑马鱼中,已分离到2个foxl2基因(foxl2a和foxl2b),在foxl2a-/-和foxl2b-/-突变体中,卵巢的初始分化和卵母细胞发育都是正常的,而纯合子foxl2a-/-/foxl2b-/-双突变体在早期表现出完全的雌—雄性别逆转[33]。在金钱鱼(Scatophagusargus)中,只有一个foxl2基因存在,而且它是雌性偏向的,表明其在卵巢发育中也具有保守的功能[34]。综上所述,foxl2基因在红鳍东方鲀卵巢分化中可能有着十分重要的作用,但其功能和作用机制仍需进一步分析。
4 结 论
本试验结果显示,dmrt1、gsdf基因在红鳍东方鲀幼鱼XY个体性腺中显著高表达(P<0.05),而cyp19a1a、foxl2基因在XX个体性腺中显著高表达(P<0.05)。笔者揭示的性别决定及分化关键作用基因的表达规律,可为后续解析这些基因的功能奠定重要基础,也可为其他鱼类繁殖生理学研究提供理论参考。此外,对相关基因的功能尚需进一步深入研究。

