离子交换膜在高中电化学中的应用研究
左松
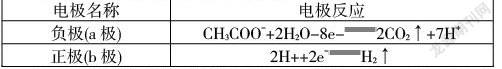
摘要:为了提高学生对电化学知识的学习效率,针对电化学中离子交换膜的应用展开分析。首先介绍离子交换膜,分析应用化学教学中运用离子交换膜的基本要求,指导学生学会判断离子交换膜以及计算物质量的方法。最后,分别从原电池、电解池装置两个方面,以例题分析的方式,探讨离子交换膜的应用,加强学生对电化学知识点的理解,旨在提升高中电化学部分的教学质量。
关键词:离子交换膜;高中;电化学;原电池
离子交换膜是高中化学“电化学”部分的重要知识点,离子交换膜一般分为阳离子交换膜(质子交换膜)、阴离子交换膜。因为工业电化学中离子交换膜有非常普遍的应用,所以这一知识点也在高中化学教学中得到重视,同时也是高考的常考点和重难点。本文结合电化学教学现状,针对离子交换膜的应用模型进行分析,总结有利于学生理解离子交换膜的有效措施。
一、离子交换膜
离子交换膜是一种高分子膜,其中包括离子基团,溶液中的离子的选择性透过性非常高,应用离子交换膜时,主要是通过其离子选择性透过膜,因此也可称其为离子选择性透过膜。人教版高中化学选修四中“电化学”这一部分知识点中,离子交换膜可以完成离子选择性定向迁移,维持溶液浓度、电荷之间的平衡性。将一些物质隔离,以免其形成的反应会对产品纯度造成影响,或者引发危险事故。
二、离子交换膜应用条件
(一)明确离子交换膜类型
电化学教学中,针对离子交换膜的判断首先应该指导学生了解其用途,例如用于制取物质、规避电极产物产生反应。最后学生可以在教师的辅助下,得出电极反应式,以此为依据对电极周围存在剩余的离子作出判断,遵循溶液电中性原则,初步判断离子移动的根本方向,从而明确离子交换膜所属种类。例如课堂上教师和学生共同分析制备Cl、H、NaOH产品的装置,分析该装置主要是为了避免Cl、NaOH溶液发生副反应,而且阴极区OH无法进入到阳极区溶液,要想使溶液为电中性,此时便需要运用到阳离子交换膜。
(二)计算离子交换膜离子量
依然以制备Cl、H、NaOH产品装置为例,当外电路转移2mol e时,此时阳极溶液便会有Cl减少2mol,当有2mol Na剩余的情况下,阳极溶液正电荷则会增加。阴极形成2mol的OH,此时阴极溶液负电荷量便会增加2mol,使溶液为电中性。如果外电路转移2mole,那么阳极溶液内部的2mol Na会穿过阳离子交换膜,随之进入到右侧的阴极区溶液,此时外电路转移电子物质量和穿过阳离子交换膜Na携带电荷物质量一致。由此可见,利用离子交换膜,其中离子携带电荷穿过阳离子交换膜的物质的量和外电路中通过的电子的物质的量相同。
三、高中电化学教学中的离子交换膜应用
(一)应用于原电池
电化学教学中,运用离子交换膜,教师可以指导学生选择性通过离子,一方面加强电荷平衡性,构建闭合回路,另一方面還可以避免两极区域物质产生直接反应,使电池电流效率得到提升。在原电池中运用离子交换膜,发挥离子交换膜盐桥作用,但对比常规形式的盐桥,无需定时替换或者再生,在此基础上进行了延伸,运用效果更为理想。 为此,下面根据例1分析原电池中离子交换膜的应用,帮助学生理解。
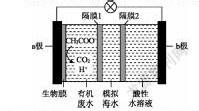
例1:(2020·山东卷,10改编)微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CHCOO-的溶液为例)。下列说法错误的是( )。
A.负极反应为CHCOO-+2HO![]() 2CO↑+7H
2CO↑+7H
B.隔膜2为阳离子交换膜,隔膜1为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
解析: 结合图示可知放电时的电极反应如下:
根据上述分析可知,A项错误;该电池工作时,Cl向a极移动,Na向b极移动,即隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B项正确;电路中转移1 mol电子时,向a极和b极分别转移1 mol Cl和1 mol Na,则模拟海水理论上可除盐58.5 g,C项正确;电池工作时负极产生CO,正极产生H,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2∶1,D项正确。
(二)应用于电解装置
电解装置在电化学的教学中十分常见,按照实际要求可以采取1种或者若种离子交换膜,电解池隔离为若干个室。随后,限制离子迁移便可完成向产品的制备。为了让学生更加高效地理解电解装置中离子交换膜的应用,针对例2展开分析。
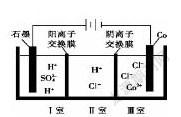
例2.(2021·广东卷,16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。图示为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )。
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:2Co+2HO![]() 2Co+O↑+4H
2Co+O↑+4H
解析 該装置为电解池,其中石墨为阳极,Co为阴极。阳极区水电离出的OH放电,电极反应式为2HO-4e-![]() O↑+4H+,生成的H+通过阳离子交换膜由Ⅰ室移向Ⅱ室,Ⅰ室H+浓度增大,pH减小,Ⅱ室H+浓度增大,pH减小,A项不正确;阴极区Co放电,电极反应式为2Co+4e-
O↑+4H+,生成的H+通过阳离子交换膜由Ⅰ室移向Ⅱ室,Ⅰ室H+浓度增大,pH减小,Ⅱ室H+浓度增大,pH减小,A项不正确;阴极区Co放电,电极反应式为2Co+4e-![]() 2Co,由得失电子守恒得出关系式:2H2O~4e-~2Co可知,生成1 mol 钴,Ⅰ室有1 mol水放电,溶液质量减少18 g,B项不正确;移除离子交换膜后,Cl会在石墨电极处发生氧化反应生成Cl,C项不正确;电解总反应为2Co+2HO
2Co,由得失电子守恒得出关系式:2H2O~4e-~2Co可知,生成1 mol 钴,Ⅰ室有1 mol水放电,溶液质量减少18 g,B项不正确;移除离子交换膜后,Cl会在石墨电极处发生氧化反应生成Cl,C项不正确;电解总反应为2Co+2HO![]() 2Co+O↑+4H+,D项正确。
2Co+O↑+4H+,D项正确。
结束语:
综上所述,电化学作为高中化学学科的重要知识点之一,在该部分的教学过程中运用离子交换膜,一方面应该让学生学习判断离子交换膜类型的方法,另一方面则要熟悉离子交换膜运用的原理,在求解相关化学习题过程中,弄清楚离子交换膜的作用,提高学生电化学知识的学习效果。
参考文献:
[1]孙小芳,王世存.中美高中化学教材“电化学”的对比研究[J].化学教育(中英文),2021,42(17):95.
[2]黄鸣春,薄一琳.高中化学“电化学”主题的基本课程问题探析[J].化学教学,2021(08):27-32.
[3]莘赞梅.高中电化学的教学问题探讨及建议[J].化学教学,2020(03):41-44.

