增液通腑逐瘀方对脓毒症大鼠肠道菌群紊乱和免疫失衡的调节作用*
高薇薇,高万朋,关鹏,王枭
天津中医药大学第二附属医院,天津 300000
脓毒症(sepsis)是机体对感染的反应失调而导致危及生命的器官功能障碍,是感染、烧伤、创伤、休克等急危重患者的严重并发症[1-2],其本质是促炎和抗炎反应严重失衡导致的组织器官的损伤[3]。脓毒症可以导致肠道免疫屏障紊乱,主要表现为过度的炎症反应导致肠屏障完整性受损以及肠道免疫抑制引起的肠道菌群紊乱和移位[4],并可形成恶性循环,促进或加重脓毒症多器官功能障碍。增液通腑逐瘀方在增液承气汤基础上加味而成,可明显改善脓毒症患者胃肠功能及预后[5-6],但其分子生物学机制尚不完全明确。脓毒症肠道免疫失衡和肠道菌群紊乱是脓毒症肠屏障损伤的重要环节,本文通过观察增液通腑逐瘀方对脓毒症大鼠肠道免疫细胞Th17/Treg平衡和肠道菌群比例的影响,探讨其对脓毒症肠道免疫和肠道菌群平衡的调理作用,以及脓毒症肠屏障损伤可能的发病机制,为增液通腑逐瘀方调理肠道免疫和肠道菌群以防治脓毒症及其并发症提供新的思路和研究方向。
1 材料
1.1 动物SPF级雄性SD大鼠40只,体质量(200±10) g,动物合格证号:SCXK(京)2020-2004,购自北京华阜康生物技术有限公司。大鼠喂养于天津中医药大学实验动物中心,保持环境恒温恒湿,自由饮水,饲料固定,适应性喂养1周。本次动物实验均经天津中医药大学第二附属医院伦理委员批准,伦理编号:ZYEFS-QMJH202014。
1.2 药物与试剂玄参、麦冬、生地黄、生大黄、芒硝、红藤、败酱草(天津中医药大学第二附属医院饮片药房)。Anti-Rat CD4 FITC、Anti-Rat CD25 APC、Anti-Mouse/Rat Foxp3 PE、Anti-Mouse/Rat IL-17A PE(美国eBioscience公司,批号:553654、558642、553102、506906);BBL培养基、LBC培养基、EC培养基、EMB培养基 (青岛高科园海博生物技术有限公司,货号:HB0396、HB0385、HB0133、HB0107)。
1.3 仪器SORVALL LEGEND MACH 1.6/R型冷冻离心机(美国Thermo Fisher Scientific公司,离心半径:8 cm);IX2-SLP型倒置显微镜(日本Olympus公司);BD FACS Calibur型流式细胞仪(美国BD Biosciences公司);WMZK-02型厌氧箱(浙江义乌冷冻机总厂);ASV-3023型全自动高压灭菌锅(日本Sakura公司)。
2 方法
2.1 药物制备增液通腑逐瘀方由玄参20 g,麦冬20 g,生地黄20 g,生大黄(后下)15 g,芒硝(冲)10 g,红藤30 g,败酱草30 g组成。将除大黄、芒硝外的药物用水浸泡0.5 h,武火煎至水开后改文火煎 45 min,加入大黄,再煎15 min,加入芒硝搅匀后冷却至室温,将汤液滤出,分别制成浓度为 0.5 g·mL-1及 1 g·mL-1的药液。
2.2 动物模型建立、分组与药物干预采用随机数字表法将40只SPF级雄性SD大鼠分为假手术组、模型组及增液通腑逐瘀方低剂量组、增液通腑逐瘀方高剂量组,每组10只。除假手术组外,其余组大鼠采用盲肠结扎穿孔术(cecal ligation and puncture surgery,CLP)建立脓毒症模型[7],具体如下:大鼠经体积分数2%戊巴比妥钠麻醉后,采取前腹正中切口,取出盲肠,使用4号丝线在距离盲肠末端 1.5 cm处进行结扎,用18号针头在盲肠结扎处远端穿透3次,挤出肠管内排泄物少许,并留置橡皮引流条以防针孔闭合,然后回纳腹腔,逐层关腹。假手术组仅开腹取出盲肠翻动后再次还纳腹腔,不进行结扎和穿刺。增液通腑逐瘀方低剂量组(0.5 g·mL-1)、高剂量组(1 g·mL-1)大鼠术前及术后24 h分别以 5 mL·kg-1的剂量灌胃给予增液通腑逐瘀方溶液,模型组及假手术组灌胃给予同体积生理盐水,每天1次,连续3 d。观察各组大鼠72 h内的生存情况。
2.3 HE染色评估肠黏膜损伤程度在距回盲部15 cm处取2 cm回肠,制作组织切片并进行HE染色,光学显微镜下观察。通过Digimizer彩色网像分析系统确定肠黏膜绒毛高度、肠腺隐窝深度、黏膜厚度以及绒毛表面积。每只动物取5张不连续的病理切片,每张切片顺次取光学显微镜下奇数视野观测10个小肠绒毛,取平均值。肠绒毛表面积=πdh(d为绒毛中段直径,h为肠绒毛高度)。根据Chiu′s肠黏膜损伤评分法[8],对小肠黏膜损伤程度进行分级。评分标准如下:0分:肠黏膜绒毛正常;1分:绒毛顶端上皮下出现囊状间隙,并伴有毛细血管充血;2分:上皮下间隙扩大,中度固有层水肿,中央乳糜管扩张;3分:固有层明显水肿,肠黏膜上皮层细胞变性、坏死,少数绒毛顶端脱落;4分:上皮细胞层变性、坏死、脱落、部分绒毛脱落,固有层裸露,毛细血管扩张、充血;5分:绒毛脱落、固有层崩解,出血或溃疡形成。
2.4 辅助性T细胞17(T helper cell 17,Th17,CD4+IL-17+)及调节性T细胞(regulatory T cell,Treg,CD4+CD25+Foxp3+)的检测取出结肠,去除肠道上粘连的脂肪,并用弯剪剪除Peyer′s Patch(PP结),纵向剪开肠道,用PBS清洗预消化的肠段2~3次,用剪刀将肠段剪至1~2 mm,置预冷的含体积分数10%胎牛血清的RPMI 1640培养液中,100目不锈钢细胞筛轻轻研磨,400目尼龙网过滤并于800 r·min-1离心10 min。细胞重悬在适量培养液中,即获得肠道固有层淋巴悬液。加细胞悬液于大鼠淋巴细胞分离液进行分层,2 000 r·min-1离心20 min,轻取界面细胞,培养液洗1次,细胞重悬在适量的培养液中。在混匀的细胞悬液中加入10 μL FITC-抗CD4单抗,孵育30 min。PBS清洗后加入300 μL固定液,避光孵育15 min。PBS清洗后,加入破膜液并于 3 000 r·min-1离心5 min,弃上清。加入20 μL PE-抗IL-17单抗,室温避光孵育30 min,随后PBS清洗,1 000 r·min-1离心5 min,弃上清。用0.3 mL PBS重悬细胞上流式细胞仪检测Th17细胞比例。在混匀的细胞悬液中加入10 μL FITC-抗CD4单抗、10 μL APC-抗CD25单抗,孵育30 min后利用PBS清洗。每管加入0.5 mL的Foxp3固定液混匀,静置20 min。PBS清洗后1 000 r·min-1离心 5 min,弃上清,每管加入0.5 mL Foxp3穿孔液重悬细胞,静置15 min后1 000 r·min-1离心5 min。弃上清,随后加入10 μL PE-抗Foxp3抗体室温避光孵育30 min。孵育结束后PBS清洗,1 000 r·min-1离心5 min,弃上清。用0.3 mL PBS重悬细胞上流式细胞仪检测Treg细胞的比例。
2.5 肠道菌群检测无菌状态下取盲肠内容物后加灭菌生理盐水稀释10倍,振荡使之均质化,再进行10倍稀释,取25 μL稀释液分别接种在各类选择性培养基上,将EMB培养基及EC培养基放入需氧环境中,35 ℃培养24 h后计数;BBL培养基、LBC培养基放入厌氧环境中,35 ℃培养48 h之后计数。根据菌落形态、涂片分析及耐氧实验结果计算各菌群每克粪便中菌落形成单位(Logl0nCFU·g-1)。
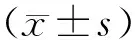
3 结果
3.1 增液通腑逐瘀方对脓毒症大鼠72 h生存数量的影响假手术组和增液通腑逐瘀方高剂量组72 h内有10只大鼠存活,增液通腑逐瘀方低剂量组有9只大鼠存活,模型组有6只大鼠存活。经χ2检验发现,四组大鼠72 h生存数量差异具有统计学意义(P<0.05)。见表1。

表1 各组大鼠72 h内生存数量
3.2 增液通腑逐瘀方对脓毒症大鼠小肠病理损伤的影响假手术组可见致密紧凑的小肠黏膜绒毛,无绒毛脱落和倒伏;模型组可见部分绒毛脱落以及倒伏,固有层部分脱落,可及裸露的毛细血管扩张,甚至固有层蜕变或被消化、出血及溃疡形成;增液通腑逐瘀方低、高剂量组对于固有层脱落及绒毛倒伏较模型组均有改善作用,其中增液通腑逐瘀方高剂量组改善更明显。与假手术组比较,模型组大鼠肠隐窝深度、绒毛高度、绒毛表面积及黏膜厚度显著降低(P<0.05),Chiu′s评分显著升高(P<0.05);与模型组比较,增液通腑逐瘀方低、高剂量组大鼠肠隐窝数量、绒毛高度、绒毛表面积及黏膜厚度明显升高(P<0.05),Chiu′s评分显著降低(P<0.01)。说明增液通腑逐瘀方对于脓毒症大鼠肠黏膜损伤具有修复作用。见图1,表2。

注:A:假手术组;B:模型组;C:增液通腑逐瘀方低剂量组;D:增液通腑逐瘀方高剂量组图1 增液通腑逐瘀方对脓毒症大鼠小肠病理损伤的影响(HE染色,×100)
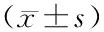
表2 增液通腑逐瘀方对脓毒症大鼠小肠病理损伤的影响
3.3 增液通腑逐瘀方对脓毒症大鼠结肠 Th17/Treg水平的影响与假手术组比较,模型组大鼠结肠Th17细胞、Th17/Treg比值明显升高(P<0.05),Treg细胞比例明显降低(P<0.05);与模型组比较,增液通腑逐瘀方低、高剂量组大鼠结肠Th17细胞、Th17/Treg比值明显降低(P<0.05),Treg细胞比例明显升高(P<0.05)。表明增液通腑逐瘀方对脓毒症大鼠肠道过度的炎症反应具有抑制作用,见表3。
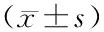
表3 增液通腑逐瘀方对脓毒症大鼠结肠Th17/Treg的影响
3.4 增液通腑逐瘀方对脓毒症大鼠肠道菌群的影响与假手术组比较,模型组大鼠肠道双歧杆菌、乳酸菌的含量以及厌氧菌/需氧菌比例明显降低(P<0.05),大肠杆菌及肠球菌含量明显增高(P<0.05);与模型组比较,增液通腑逐瘀方低剂量组、高剂量组大鼠双歧杆菌、乳酸菌的含量以及厌氧菌/需氧菌比例明显增高(P<0.05),大肠杆菌及肠球菌含量明显降低(P<0.05)。表明增液通腑逐瘀方具有维持肠道菌群平衡的作用,见表4。
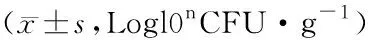
表4 增液通腑逐瘀方对脓毒症大鼠肠道菌群的影响
3.5 Th17/Treg与厌氧菌/需氧菌相关性分析采用Spearman相关性分析考察Th17/Treg与厌氧菌/需氧菌的关系发现,Th17/Treg与厌氧菌/需氧菌存在负相关关系(rs<0,P<0.05)。
4 讨论
增液通腑逐瘀方在增液承气汤基础上加味而成,该方由玄参、麦冬、生地黄,大黄(生)、芒硝、红藤、败酱草组成,具有益气养阴、通腑泻热、活血化瘀的功效。方中大黄推陈致新、解毒化瘀、通经活络,实验研究证实,大黄对维持肠道免疫及肠道微生态平衡具有积极的作用;大黄素可抑制炎症信号通路的激活进而保持肠道机械屏障的完整,还可以减少细菌移位,保持肠道菌群平衡[9]。
肠道菌群平衡在肠道免疫中发挥重要作用[10],与肠道免疫系统维持着一种平衡而又微妙的共生关系,以保持肠道内环境的稳定[11-12]。乳酸杆菌、双歧杆菌、肠球菌、大肠杆菌是肠道常驻菌群,能阻止细菌、毒素和其他有害物质入侵,抵抗潜在致病性的需氧菌或外袭菌在黏膜上定植形成感染,降低病原体毒素,杀死并抑制外袭菌[13]。脓毒症发生时,机体肠道菌群失调、紊乱,表现为厌氧菌数量减少,而需氧菌数量增多,厌氧菌、需氧菌比值明显下降[14],肠道定植抵抗力降低,潜在性病原体(包括条件致病菌)定植和入侵,引起肠道黏膜的免疫应答,一旦这种免疫反应超过了机体的接受能力,便可能引发肠道免疫功能失调,从而引发局部或全身性炎症性疾病[15-16]。本次研究发现,增液通腑逐瘀方具有维持肠道菌群平衡的作用,可以抑制脓毒症肠道菌群紊乱和菌群移位的发生,对于维持肠道稳态具有积极的作用。
Th17细胞和Treg细胞之间的平衡对维持肠道免疫平衡具有重要意义。Th17主要分泌白细胞介素-17(interleukin-17,IL-17)、IL-22及少量的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6和IL-23等促炎介质[13],可抑制肠道致病菌在肠道内的繁殖,防止肠道菌群移位[17-18]。Treg细胞被称为抑制性T淋巴细胞,主要分泌IL-10和转化生长因子-β(transforming grawth factor-β,TGF-β)[19],抑制炎症因子及免疫应答过度激活对肠道屏障的损伤,进而维持肠道屏障的完整性[20]。研究表明,Th17/Treg 失衡与脓毒症和各种炎症性疾病有关[21]。Th17/Treg比值的改变可提示肠道免疫功能紊乱,若这种免疫功能紊乱不能被纠正,则可能进一步加重脓毒症多脏器功能障碍,延长疾病病程,增加死亡风险[22-26]。因此,调节 Th17/Treg平衡可能是治疗脓毒症的有效措施[27]。本次研究发现,Th17/Treg与厌氧菌/需氧菌存在负相关关系。肠道免疫平衡与肠道菌群的稳态密切相关,为中药整体调节观的微生态学提供了实验证据[28]。因此,肠道免疫及肠道微生态平衡对于保持肠道屏障完整性以及改善脓毒症及多脏器功能障碍的预后具有重要意义[29]。
综上,增液通腑逐瘀方可以修复脓毒症导致的肠黏膜损伤,调节肠道菌群紊乱,促进免疫平衡。其既可以抑制致病菌在肠道内的过度繁殖,又可以抑制过度的炎症反应对肠屏障的损伤,进而维持肠道生态平衡,防止肠道菌群移位对肠屏障和全身的二次伤害,促进肠道功能恢复,体现了中药治疗的多途径多靶点和整体观的特点,为探索中药调节肠道菌群途径及免疫功能提供新的证据。

