低温等离子体促进人牙龈上皮细胞在钛表面的黏附
张敏 敖小刚 郑铮 陈文川
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院修复科,成都 610041
种植修复因其突出的优点成为牙列缺损或缺失患者主要选择的修复方式。Brånemark 等[1]首次提出“骨结合”的概念,认为骨结合是种植体修复成功的关键。然而,种植修复的长期稳定性除与骨结合相关外,软组织与种植体基台之间的生物封闭也起到至关重要的作用[2],并对远期成功率有重要意义。从解剖上看,种植体周围的软组织封闭主要由两方面组成:上皮组织封闭与纤维组织封闭。上皮组织封闭位于纤维组织封闭上方,与口腔环境直接接触,是抵抗外界环境中有害物质侵入种植体的第一道屏障。种植体周围上皮(peri-implant epithelium,PIE)是种植体周围软组织生物封闭的关键:与结合上皮(junctional epithelium,JE)类似,PIE 通过半桥粒(hemidesmosomes,HDs)和基底板(internal basalt lamina,IBL)附着于种植体表面[3-4]。
然而,与JE 相比,PIE 的封闭能力相对较弱,形成时间较长,易受到细菌外界刺激的攻击[5]。因此,近年来学者们也开展了诸多研究,主要针对种植体基台表面的改性,包括基台的涂层[3,6]、选择性激光烧结[7]、极化处理[8]、直接等离子体喷涂[9]。虽然在这些方面取得了一些积极的进展,但在临床中应用改性的钛基台的技术尚未成熟。其主要原因是改性后的基台增加人牙龈上皮细胞(human gingival epithelial cells,HGECs) 黏 附 的同时,也可能增加细菌在基台表面定植的风险,其有效性有待进一步证实[10]。
考虑到这些局限性,从细胞角度思考,通过一种特殊且安全的方法来提高牙龈上皮细胞的黏附相关活性成为一种可靠方案。近年来,低温等离子体(non-thermal atmospheric plasma,NTAP)已广泛应用于生物医学工程,包括伤口愈合[11-12]、癌症治疗[13]、创口止血[14]、干细胞分化[15-16]、组织再生[17-18]、杀菌[19-20]、牙齿美白[21]、根管治疗[22]等方面。Langmuir[23]在1927年首次提出术语“低温等离子体”,定义为一种电离气体,它电离时温度接近室温,这是能直接处理活细胞的理论基础[24-25]。Lou 等[11]研究发现,He/Ar-NTAP 通过激活上皮-间充质转化(epithelial-to-mesenchymal transition,EMT)和细胞周期进程能有效诱导角质形成细胞的增殖和迁移。同时,基于本课题组之前的研究[26],发现NTAP 可以作为牙周炎治疗的补充疗法,有效去除根面及袋内的生物膜。
鉴于NTAP 这些积极作用,探索NTAP 是否对HGECs 在钛表面的黏附也具有促进作用。因此,本研究采用NTAP 处理HGECs 细胞,然后在扫描电子显微镜(scanning electron microscope,SEM)下直接观察细胞黏附情况,并研究HDs 和IBL 中黏附相关蛋白层粘连蛋白α3(Laminin α3)、整合素蛋白β4 (Integrin β4) 和网蛋白(Plectin) 的变化。
1 材料和方法
1.1 钛片的制备
本研究使用的四级工业纯钛(成都欣航丰科技有限公司),直径15.0 mm 或34.0 mm,厚度为1.0 mm。它们依次经粒度200、400、600、800、1 200 和2 000 号的SiC 砂纸进行打磨抛光,然后在超声震荡下,用丙酮、75%的乙醇和蒸馏水分别处理15 min,重复3 次。最后,样品在60 ℃真空干燥,消毒24 h后备用。
1.2 细胞培养
HGECs 购自于上海沪震生物科技有限公司,在四川大学口腔疾病研究国家重点实验室培养和保存。HGECs 在口腔角质细胞培养基(oral keratinocyte medium,OKM)(ScienCell 公司,美国)中培养,加入1%青霉素/链霉素溶液(Hyclone 公司,美国)。这些细胞在37 ℃、5%CO2的孵箱中传代培养。取生长状态良好的2~3 代,0.25%胰酶溶液进行消化,放置于孵箱中1 min 后加入含血清的培养基终止消化,1 000 r·min-1下离心5 min,弃上清,培养基重悬,显微镜下计数板计数,调整细胞浓度至每毫升1×105个,接种于35 mm 培养皿并加入适量OKM培养基。
1.3 NTAP处理
该装置由四川大学和美国密苏里大学等离子体研究中心研发制造并提供。以氩气(Ar)作为载体,流速3 000 sccm·min-1。氧(O2)作活性气体,流速30 sccm·min-1。开启电源启动装置,混合气体经设计的手柄喷嘴生成非热等离子火焰。在细胞处理过程中,每次实验直接在培养皿中照射细胞。培养皿中含有相应密度(每毫升1×105个)的细胞悬液。直径35 mm的培养皿中加入3 mL OKM培养基,NTAP 处理时,手柄喷嘴距离培养皿约10 mm。处理的过程中呈Z 形匀速移动手柄喷嘴,尽可能地达到均匀处理。照射后将细胞悬液混匀,接种于相应已放置钛片的孔板。
1.4 筛选适宜的处理时间
HGECs分别经NTAP处理0、10、20、30、60 s后,接种于已放置钛盘的24 孔板,细胞密度为每毫升1×105个,加入1%青霉素/链霉素双抗溶液。各组细胞分别孵育4 和24 h。在预设的时间点去除原有培养基,PBS轻轻洗涤3次。避光条件下,使用细胞计数试剂盒-8 (cell count kit-8,CCK-8)(东仁公司,日本)对细胞黏附的数量进行评估。在每个样品孔中加入500 μL 新鲜配制含10%的CCK-8试剂的OKM 培养液,然后在细胞培养箱中继续避光培养2 h。最后,轻轻水平摇晃孔板混匀反应液,从每个孔中吸取100 μL 溶液到无菌96 孔板内,每个样品孔均设置3个复孔,测定在450 nm处的光密度(optical density,OD)值。
1.5 最佳处理时间下细胞黏附数量
将接受最佳NTAP处理时间(Plasma组,结果参考1.4)或未接受NTAP 处理的HGECs(Control组)以密度为每毫升1×105个接种于24孔板的钛表面,培养方式同1.4,分别培养4、12、24 和48 h。在预设时间点去除原培养基,用PBS洗涤3次。使用CCK-8 对细胞进行评估。采用CCK-8 标准操作对结果进行检验。
1.6 最佳处理时间下细胞黏附和形态
接受最佳时间处理的Plasma 组和Control 组的HGECs 接种于24 孔板的钛表面,细胞密度为每毫升1×105个,分别在培养4、12、24、48 h 时间点用2.5%戊二醛溶液固定12 h,PBS冲洗3次。然后在乙醇(35%、50%、75%、85%、95%、100%)中依次脱水,每次10 min。脱水后使用醋酸异戊脂溶液进行置换,临界点干燥后对样本进行喷金处理,最后将处理完成的样本放置于SEM 下观察细胞的黏附形态。细胞附着于钛表面是实现软组织封闭的第一步。
1.7 最佳处理时间下基因表达
接受最佳时间处理的Plasma 组和Control 组HGECs 分别以细胞密度为每毫升1×105个接种于6孔板的钛表面,分别孵育4、12、24、48 h。取出相应培养时间点的孔板置于冰上进行操作。使用Trizol(北京索莱宝科技有限公司)法裂解细胞并提取总RNA。使用Prime Script RT Master Mix(TaKaRa 公司,日本)逆转录合成cDNA,然后使用Light Cycler 480(Roche 公司,瑞士)与SYBR Premix Ex TaqⅡ(TaKaRa 公司,日本)进行实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)。以HGECs的引物为模板,采用Laminin α3、Integrin β4 和Plectin 特异性引物进行聚合酶链反应(polymerase chain reaction,PCR),磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为内参,所用引物序列见表1。

表1 qRT-PCR的引物序列Tab 1 Primer sequences for qRT-PCR
1.8 最佳处理时间下的蛋白表达
Plasma 组和Control组的HGECs 接种于直径为34.0 mm 钛盘的6 孔板。同样,细胞培养4、12、24和48 h后。样品用PBS洗涤,用含有1 mmol·L-1苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)(北京索莱宝科技有限公司)的RIPA 裂解液(radio immunoprecipitation assay,RIPA)(北京索莱宝科技有限公司)吹打裂解,BCA 法测定蛋白浓度。将蛋白样品转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜(Roche 公司,瑞士)上、5%脱脂牛奶在TBST 缓冲液中封闭2 h,然后用抗Laminin α3、抗Integrin β4 或抗Plectin 在4 ℃下孵育过夜。用TBST 冲洗,然后用相应的二抗IgG-HRP(上海Abcam公司)室温孵育1 h。最后,用电化学发光(electrochemiluminescence,ECL)(Bio-Rad 公司,美国)溶液显影,然后在膜上曝光1 min,采集条带,采用quantity one 分析胶片的灰度值。
1.9 数据分析
采用SPSS 24.0 软件包对所有定量结果进行分析。采用单因素方差分析(ANOVA)进行统计分析,然后采用Student Newman Keuls(ANK)方法确定多重比较的显著性差异。P<0.05 被认为有统计学意义。
2 结果
2.1 NTAP的最佳处理时间
不同NTAP 处理时间下HGECs 在钛表面的黏附结果见图1。培养4 h 时,与0 s 组相比,10、20、30 s 组细胞黏附数量明显增加。然而,60 s 组出现了下降。不同组间,20 s照射对促进细胞黏附作用最大,与其他组比较差异有统计学意义(P<0.05),其中OD值为0.32±0.03,而对照组OD值为0.19±0.01。培养24 h 时,HGECs 黏附数量增加趋势相似,HGECs 黏附在20 s 处理时达到最大值,OD 值为1.02±0.10,与其他组比较差异有统计学意义(P<0.05)。以上2 个时间点的细胞培养结果显示,HGECs 在照射20 s 时黏附数量达到最大,因此选择20 s作为下一次实验的最佳处理时间。

图1 不同NTAP作用时间对HGECs黏附的影响Fig 1 Effects of different NTAP treatment time on the adhesion of HGECs
2.2 细胞黏附实验
20 s 为实验的最佳处理时间,故Plasma 组采用20 s 处理时间。随着培养时间的延长,不同组HGECs 在钛表面上的附着和生长均不断增加,呈时间依赖性。Plasma 组细胞黏附率显著高于对照组(P<0.05)(图2)。实验结果表明,NTAP 处理后培养4、12、24、48 h,HGECs 在钛表面上的黏附和增殖比对照组分别增加了1.7、1.5、1.6 和1.5倍。

图2 HGECs在钛表面培养不同时间的黏附Fig 2 Adhesion of HGECs on titanium surface at different times
2.3 细胞形态学观察
SEM 观察不同组HGECs 黏附在钛表面不同的细胞形态。培养4 h,2 组细胞均呈收缩聚集状,黏附面积小,黏附松散,胞体无细胞伪足伸出。培养12 h,2 组进一步伸展,但Plasma组细胞显示较大粘连面积。在更高倍镜的视野下观察,细胞显示出更大的伸展面积,细胞更加扁平,周围更多的丝状伪足锚定在钛片表面。培养24 和48 h,2组HGECs均进一步伸展,表现为不规则的多边形,有更多的触角和伪足。Plasma 组的HGECs 比对照组显示铺展面积更大,伪足数量多和广泛的细胞相互连接(图3)。

图3 SEM观察HGECs细胞的形态Fig 3 SEM observation of the morphology of HGECs
2.4 qRT-PCR 评价Laminin α3、Integrin β4 和Plectin基因的表达
HGECs 黏附在钛表面上4、12、24 和48 h 的Laminin α3、Integrin β4 和Plectin 基因表达分析结果见图4。与Control组相比,Plasma 组Laminin α3 mRNA 表达明显增加。12、24 和48 h 时,可以观察到相似的表达结果,且Laminin α3 mRNA 表达均持续升高。Integrin β4 是HGECs 黏附早期表达的标记基因。在不同的时间内,Integrin β4 基因表达在NTAP 处理后显著增加。在4~48 h,2 组间差异均有统计学意义。在孵育4、12、24和48 h后测定Plectin的表达,NTAP 处理增加其表达水平,趋势同Laminin α3和Integrin β4。
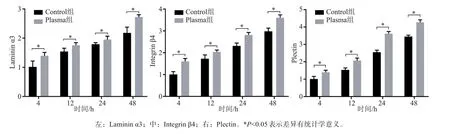
图4 qRT-PCR检测HGECs的基因表达水平Fig 4 Gene expression levels of HGECs detected by qRT-PCR
2.5 Western blot 分 析Laminin α3、Integrin β4 和Plectin的表达
黏附钛表面的细胞通过Western blot 分析HGECs 中Laminin α3、Integrin β4 和Plectin 的蛋白表达水平(图5)。首先培养4 h 时,Plasma 组的3组基因的表达量均高于Control 组,条带灰度定量后测得分别为1.8、2.5 倍和1.35 倍。培养12 h 时,Plasma 组Laminin α3、Integrin β4 和Plectin 分别增加1.2、1.7 和1.4 倍。然而,考虑到NTAP 的作用时间较为短暂(仅20 s),24 h 和48 h 组的差异则不如早期阶段明显。与对照组相比,Plasma 组显著上调HGECs 中早期(12 h)的Lamininα3、Integrin β4 和Plectin 的表达水平,结果与基因表达基本一致。后期差异不明显,可能提示:细胞内的蛋白并非单一因素(NTAP)调控,深入的调控机制还需要进一步研究。

图5 Western blot检测HGECs不同时间的蛋白表达水平Fig 5 Western blot detection of protein expression levels in HGECs at different times
3 讨论
一直以来,众多学者都认为骨结合的成功是种植体的存活准则。但近来,越来越多的临床证据表明,健康稳定的种植体周围软组织结合同样是重要因素。第一道生物屏障的生物封闭能抵抗细菌及其代谢物的侵袭,有利于其下方的骨结合的稳定,保证种植的长期成功率。种植体周围的上皮封闭主要是通过PIE黏附在钛表面形成,其黏附数量的多少和紧密程度与封闭能力密切相关。
在种植体周围上皮封闭的细胞黏附过程中,参与的主要黏附蛋白为Laminin 332(又称Laminin-5)、Integrin α6β4 和Plectin。Laminin 332 主要由α3、β3 和γ2 三条链组成。研究[27]表明,在Laminin 332 的组装过程中,β3γ2 二聚体首先在细胞内合成,然后再与α3 基团进行整合形成三聚体。因此,α3 基团的合成是Laminin 332 三聚体组装过程中的关键因素,提高α3 的表达可促进细胞内Laminin 332 的合成。PIE 形成早期,Laminin 332在上皮与结缔组织交界处,而有研究[28]发现PIE 形成后,可在上皮与种植体之间检测到其存在,推测Laminin 332 可引导上皮向种植体表面迁移,形成HDs并促进生物学封闭。而Integrin α6β4是一种非共价异二聚体,是HDs的跨膜部分,也是Laminin 332的重要受体。本研究仅检测了Integrin β4的表达差异变化,是因为研究表明Integrin α6β4的β4尾部的胞外段能够识别与Laminin α3 的COOH 端的LG 区特异性结合,具有高亲和力,调节细胞的黏附。研究[29]表明β4 在参与细胞间、细胞与基质间的行为调控比α6 更具有重要作用。Plectin 是一种相对分子质量为500 000 膜蛋白,是细胞骨架多功能的连接剂,调节微丝、微管、中间丝的锚定功能,与上皮层的基底膜细胞层具有广泛的联系[27]。它们一起构成类似HDs和IBL的结构,有助于PIE固定在种植体表面。
本研究采用一种新的方法体外处理HEGCs,并在分子和细胞水平上检测细胞的变化。在本实验中,钛片模拟种植体的穿龈部分的纯钛基台。当HGECs 与钛表面发生接触时,细胞会发生一系列的生理反应,如细胞黏附、伸展和迁移等。而这其中,细胞黏附发生得最早。选择Ar作为载气,这与以往的研究[30]报告一致:大多数等离子体射流装置使用惰性气体(He 或Ar)作为工作气体,通常掺杂少量分子气体(N2、O2)。NTAP 处理后,细胞发生黏附、伸展、连接、分泌等一系列生理反应。一般来说,低剂量具有杀菌、刺激细胞、促进增殖和迁移。Kalghatgi 等[31]报告说,低剂量NTAP(30 s 或4 J·cm-2)对内皮细胞相对无损伤,而长时间暴露(60 s 或8 J·cm-2)会导致不可逆且永久性的细胞损伤甚至死亡。Lou 等[11]研究表明,等离子体(工作电压6.5 kV,与培养基表面距15 mm,He/Ar 混合比例为10∶1)能有效激活细胞增殖。本研究中使用的NTAP 的参数(1%O2/Ar,3 000 sccm·min-1)是基于前期的工作[26],其结果验证有效,且对大鼠健康牙龈组织无不良影响。本研究发现,黏附在钛表面的HGECs 的数量比对照组要高,而这种差异在培养数小时后变得显著。SEM 结果显示,NTAP 处理后的HGECs 呈多角形,突起较多,表面积较大,伸长较大。进一步检测NTAP 促进牙龈上皮细胞黏附相关基因(Laminin α3,Integrin β4 和Plectin)的表达,正如推测的那样,NTAP 可促进HGECs 的黏附。纯钛-上皮细胞界限的生物学评价:细胞黏附率和细胞在纯钛界面的超微结构形态是评价材料表面细胞相容性的基本方法。PCR 和Western blot 技术分别从蛋白水平和基因水平检测目的基因的表达情况。
NTAP 在生物医学领域中对各种生物材料的影响均有广泛研究,经证实,它对正常细胞也有积极作用[12,32]。实验中使用的NTAP 的气体温度为27 ℃,因此针对细胞的热效应可以排除。此外,培养基的液体层可以阻挡紫外线对细胞的直接辐射。本实验中NTAP仅直接照射细胞一次,但在短时间试验中便证明NTAP 的处理具有统计学意义。因此,在对细胞相对无损伤的情况下,反复NTAP照射的效果是否能维持更长的时间还有待于阐明。等离子体高度复杂的相互化学作用,反应活性物质被引入或在培养基中产生以及发生二次级联反应[33]。然而,这些高活性分子难以分析。一是因为活性分子存在时间短暂,另一原因是它们会相互作用。在接下来的工作中,需要对NTAP的成分进行精确的机理分析。不可否认的是,目前的研究仍然提供了初步证据,证实NTAP具有可以早期促进上皮细胞黏附和维持生物封闭的潜力。NTAP是一种电离的气体介质,它容易进入常规仪器无法通过扩散到达狭窄、不规则的孔隙和裂缝中,进而达到临床治疗的目的。鉴于基台材料的NTAP表面改性的局限,这种方法可以与其他基台表面改性策略相结合,并可能实现叠加和协同效应。
综上所述,虽然本研究存在一些局限性,但可以得出一些重要的结论。研究发现,与未使用NTAP 处理的相比,一定时间的NTAP 处理能促进HGECs 在钛表面的黏附以及相关黏附相关基因(Laminin α3、Integrin β4 和Plectin)的表达增加。结果表明,NTAP 是提高种植体周围黏膜屏障的生物封闭很有前景的方法。
利益冲突声明:作者声明本文无利益冲突。
——Lights决策树

