干旱胁迫对“波尼”薄壳山核桃叶片生理特性的影响
杨海燕,吴文龙,闾连飞,黄正金,李维林
(1 江苏省中国科学院植物研究所,南京,210014;2 南方现代林业协同创新中心/南京林业大学林学院,南京,210037)
薄壳山核桃(Caryaillinoensis)又名长山核桃、美国山核桃,为胡桃科山核桃属落叶乔木[1],是一个用途广,收益期长(50~70年),经济效益、社会效益和生态效益都很高的优良经济树种,既是重要的木本油料作物,又是绿化树种和材用树种[2-3]。目前,我国的薄壳山核桃(果实)产量远远满足不了市场的需求,主要以进口加工为主,所以,在我国发展薄壳山核桃具有广阔的市场前景。
干旱胁迫是植物最主要的非生物胁迫之一。干旱胁迫对于植物的形态、发育、代谢以及各方面的生理调节都会产生负面影响[4]。我国南方广大地区属于季节性干旱区,主要包括长江流域的江苏、安徽、浙江、江西、湖南、湖北、四川等省。这些地区季节性干旱发生频率高、强度大,而且干旱与炎热基本同步,蒸发量大,严重影响经济树木生理代谢、生长发育、果实产量和品质[5]。薄壳山核桃在生长发育过程中易受到水分亏缺的强烈影响,因此,引种地区只有满足其在水分方面的需求,才能保证其正常生长以及获得较好的果实产量和品质。研究薄壳山核桃响应干旱胁迫的潜在机制,能更好地揭示其抗旱性的本质。本试验模拟自然环境中的干旱胁迫并设置不同的胁迫程度,研究薄壳山核桃在干旱胁迫的生理响应机制,为进一步深入研究薄壳山核桃干旱胁迫调控网络和指导其引种栽培提供帮助。
1 材料与方法
1.1 试验材料试验材料为“波尼”薄壳山核桃采用本砧(即“波尼”实生苗作砧木)培育的健壮且一致的2年生嫁接苗,选自南京绿宙薄壳山核桃科技有限公司六合实验基地。试验在江苏省中国科学院植物研究所温室大棚内进行,单株单盆栽植于棕色硬质塑料盆中。塑料盆高35 cm,上口径22 cm,下口径18 cm。盆栽基质为园土∶蛭石∶珍珠岩=4∶2∶1。盆栽适应2个月后,于7月20日选取18株生长健壮的植株进行干旱胁迫处理,即在棚内平均温度(29±4)℃、相对湿度为(80±20)%的条件下,连续9 d不浇水。分别于不浇水的0、3、6和9 d叶片样品进行生理生化指标测定,并测定土壤(盆栽基质)的含水量。
1.2 试验方法叶片相对含水量(RWC)测定:参考张志良[6]的方法。选取生长一致的功能叶片9张,称量鲜质量(m1),叶片在水中浸泡至恒质量后称量质量(m2),叶片100 ℃杀青,60 ℃烘干至恒质量后称量质量(m3)。RWC=[(m1-m3)/(m2-m3)]×100%。
叶片叶绿素含量测定:采用乙醇提取法[7]。称取叶片鲜样0.2 g,加入3 mL 95%乙醇溶液研磨,8 000 转/min离心10 min,取上清液,定容至8 mL。以95%乙醇为空白,测定波长665、649 nm下的吸光值(A),根据公式(叶绿素a=13.95A665-6.88A649,叶绿素b=24.46A649-7.32A665,叶绿素总量=叶绿素a+叶绿素b)计算提取液中叶绿素浓度,最后计算叶样中叶绿素的含量。
叶片抗氧化系统相关指标测定:超氧阴离子自由基(O2·-)产生速率的测定采用羟胺氧化反应方法[8]。过氧化氢(H2O2)含量的测定采用建成生物有限公司的H2O2试剂盒法,即H2O2可以与钼酸作用生成一种络合物,在405 nm处测定其吸光值。丙二醛(MDA)含量的测定采用硫代巴比妥酸法[9]。可溶性蛋白含量测定采用考马斯亮蓝法[10]。超氧化物歧化酶(SOD)活性的测定采用黄嘌呤氧化酶法[11],以每毫升反应液中SOD抑制率达50%时所对应的SOD量为一个活性单位(U)。过氧化氢酶(CAT)活性的测定采用钼酸盐法[12],以每克材料每秒钟分解1 μmol H2O2的CAT量为一个活力单位。抗坏血酸(AsA)含量的测定采用二联吡啶法[13]。还原型谷胱甘肽(GSH)含量的测定采用DTNB法[13]。
叶片可溶性糖含量测定:参考於新建等[14]的方法。可溶性糖含量测定采用蒽酮比色法(吸取1 mL提取液,加1 mL水和4 mL 0.2 % 蒽酮试剂,沸水浴10 min,冷却后测定620 nm下的吸光值)。蔗糖含量测定采用间苯二酚法(吸取0.9 mL提取液,加入0.1 mL 2 mol/L NaOH沸水浴10 min,冷却后加入1 mL 0.1%间苯二酚和3 mL 10 mol/L HCl,80 ℃水浴60 min,在500 nm下测定其吸光值)。
叶片激素含量测定:采用双抗体夹心法酶联免疫分析[15]进行测定。用纯化的植物激素抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入对应的激素,再与辣根过氧化物酶(HRP)标记的激素抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物3,3′,5,5′-四甲基联苯胺(TMB)显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的激素呈正相关。用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中植物激素的浓度。
土壤(基质)含水量测定:采用电阻式土壤湿度测定仪(土壤墒情速测仪TZS-W)进行测定。主要根据土壤的电导性与土壤水分含量的关系测定土壤湿度,土壤湿度又称土壤含水率,是用土壤含水量占土干重的百分数表示。
1.3 数据分析用DPS 7.05软件进行差异显著性(α=0.05)分析。
2 结果与分析
2.1 叶片相对含水量从图1可以看出,随着干旱胁迫时间的延长,植株叶片逐渐卷曲,叶片颜色从深绿变为淡黄,失水严重。试验结果表明,在干旱胁迫下,叶片相对含水量呈现逐渐下降的趋势,在第9天达到最小值(21.33%),降低为对照(干旱胁迫处理第0天,下同)的29.78%,差异显著(见图2)。

图1 干旱胁迫下各处理时期的植株

注:干旱胁迫处理0、3、6和9 d盆内基质含水量分别为(81.0±3.58)%、(61.2±3.48)%、(41.7±2.11)%和(16.5±2.02)%。图中不同小写字母表示差异显著(p<0.05),图3至图6同。
2.2 叶片叶绿素含量试验结果看出,在干旱胁迫下,叶片叶绿素a含量和叶绿素总量呈逐渐下降的趋势,在第9天达到最小值,与对照相比分别下降了53.98%和56.82%,差异显著(见表1)。说明,植株受到伤害程度比较严重。

表1 干旱胁迫下“波尼”薄壳山核桃叶片的叶绿素含量 mg/g
2.3 叶片自由基水平和MDA含量试验结果可以看出,在干旱胁迫下,叶片超氧阴离子(O2·-)产生速率和过氧化氢(H2O2)含量呈现先升高后下降的趋势,在第6天达到峰值,与对照相比分别增加了10.01%和155.17%,差异显著;MDA含量在前期无显著变化,第9天显著上升,与对照相比增加了52.07%,差异显著(见图3)。

图3 干旱胁迫下“波尼”薄壳山核桃叶片的自由基水平和MDA含量
2.4 叶片蛋白含量试验结果看出,在干旱胁迫下,叶片可溶性蛋白含量呈现先升后降的趋势;在第6天,达到最大值,与对照相比增加了23.87%,差异显著;在第9天,蛋白含量下降,但仍显著高于对照(见图4)。
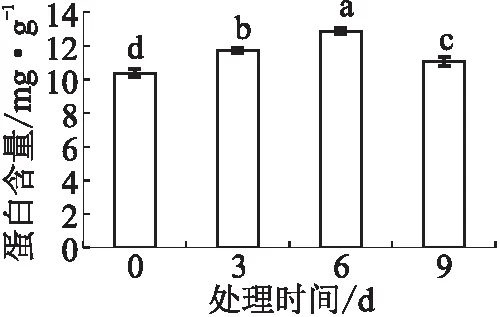
图4 干旱胁迫下“波尼”薄壳山核桃叶片的蛋白含量
2.5 叶片抗氧化系统活力试验结果看出,在干旱胁迫下,叶片SOD活性先升后降,在第6天达到峰值,为对照的153.73%,差异显著,第9天时活性开始下降;CAT活性在第3天即显著下降,为对照的27.70%,此后变化不显著;AsA含量先升后降,在第3天145.06%)和第6天分别升为对照的145.06%和144.93%,之后开始缓慢下降,但均与对照差异显著;GSH含量逐渐上升,均与对照差异显著,在第9天达到峰值(为对照的141.25%)(见图5)。

图5 干旱胁迫下“波尼”薄壳山核桃叶片的抗氧化酶活性和抗氧化物质含量
2.6 叶片可溶性糖含量试验结果看出,在干旱胁迫下,叶片可溶性糖总量在前期比较稳定,在第9天降为对照的56.75%,差异显著;蔗糖是可溶性总糖中的一部分,其含量变化表现为先升后降,第3天、第6天和第9天分别为对照的235.77%、222.00%和143.50%,均显著高于对照(见图6)。
2.7 叶片激素含量试验结果看出,在干旱胁迫下,叶片乙烯(ETH)和水杨酸(SA)含量均呈现出先升后降的趋势,ETH在第3天达到峰值(为对照的115.15%),SA在第6天达到峰值(为对照的115.28%);茉莉酸(JA)含量随着干旱时间的延长逐渐下降,第9天降为对照的76.32%,差异显著;脱落酸(ABA)无显著变化(见表2)。

表2 干旱胁迫下“波尼”薄壳山核桃叶片的激素含量
3 讨论与结论
干旱胁迫是制约作物生长发育以及产量的重要的非生物胁迫之一,也是制约农业生产的重要因素[16]。干旱胁迫严重影响植物的生长发育,甚至会造成植物死亡。叶片相对含水量可以反映植物叶片细胞水分的生理状态,可以用来评估植株抗旱能力的强弱[17]。在本研究中,“波尼”薄壳山核桃叶片相对含水量随着干旱时间的延长而持续下降,表现出较低的抗旱水平。叶片是光合作用的主要器官,其叶绿素含量与光合能力的强弱密切相关。本研究发现,随着干旱时间的延长,“波尼”叶片的叶绿素(总)含量有不断下降的趋势,第9天降为对照的56.82%。这很可能是因为在干旱胁迫下,叶片严重失水,导致叶绿素代谢相关酶活性下降,加快了叶绿素的分解。此外,前人的研究表明,在干旱胁迫下,植物叶片气孔导度降低,从而直接抑制了叶片的光合碳同化能力[18]。
植物在正常生长状态下,活性氧的产生和清除处于动态平衡状态,在干旱胁迫下,植株体内的活性氧自由基大量积累,细胞膜脂过氧化程度加重。在本研究中,随着干旱时间的延长,“波尼”叶片的O2˙-产生速率和H2O2含量呈现先升高后下降的变化趋势,尤其是H2O2含量在干旱胁迫下均显著高于对照。这表明,在干旱胁迫下,“波尼”叶片中的自由基大量积累。MDA是衡量细胞破坏程度的重要指标,MDA含量越高,细胞膜脂过氧化程度越严重[19]。在本研究中,干旱胁迫前6 d,“波尼”叶片MDA含量平稳,而在第9天时显著上升。可见,随着干旱胁迫时间的延长,叶片中产生的自由基对植株产生了显著伤害。植物在干旱胁迫下,会调动自身的抗氧化防御系统来抵抗氧化伤害。植物的抗氧化系统主要包括抗氧化酶和抗氧化物质两大类[20-21]。SOD和CAT是植物体内重要的抗氧化酶,SOD能以O2˙-为基质进行歧化反应,生成H2O2,CAT能够分解H2O2生成H2O和O2,起到清除活性氧自由基,缓解膜系统氧化伤害的作用[22-23]。在本研究中,干旱胁迫下的“波尼”叶片SOD酶活性变化表现为先升后降,CAT活性直线下降。这表明,随着干旱时间的延长,这两种保护酶的活性会受到抑制,其中,CAT对干旱胁迫更加敏感。AsA和GSH是抗氧化系统中重要的非酶系统。AsA和GSH既可以通过AsA-GSH循环清除活性氧自由基,还可以作为抗氧化酶系统的底物参与反应,同时AsA和GSH作为小分子抗氧化物质可以直接与活性氧自由基发生反应,将其还原[23]。在本研究中,干旱胁迫下的“波尼”叶片AsA含量先升后降,GSH含量逐渐上升。说明,这两个物质在“波尼”抵抗干旱胁迫的过程中发挥了重要作用。此外,在干旱胁迫下,植物可以通过增加体内渗透调节物质的含量来提高细胞的保水能力,从而减少对膜系统的伤害,其中,可溶性蛋白和可溶性糖是植物体内重要的渗透调节物质[24]。在本研究中,干旱胁迫下的“波尼”叶片可溶性蛋白含量先升后降,均高于对照;可溶性糖总量虽呈现下降的趋势,但蔗糖含量先升后降,均高于对照。这说明,可溶性蛋白和蔗糖两种物质在“波尼”植株抵御干旱胁迫的过程中发挥了调控功能。
内源激素在植物遭受逆境胁迫时,可以起到重要的调节作用,许多研究表明,乙烯(ETH)、水杨酸(SA)、脱落酸(ABA)和茉莉酸(JA)等植物激素是植物启动防御机制的重要信号物质[25-27]。段梦琪等[25]的研究表明,外施乙烯利可以缓解黑麦草在干旱条件下的胁迫损伤。在本研究中,干旱胁迫下的“波尼”叶片ETH含量呈现先升高后下降的趋势。这表明,ETH可能在一定程度上缓解了“波尼”植株的干旱胁迫伤害,但后期由于干旱胁迫程度加重,超出了植株本身的承受能力,因而ETH出现了下降的趋势。李琬婷等[26]研究表明,外施ABA可以提高干旱胁迫下滇润楠幼苗叶片相对含水量、抗氧化酶活性和脯氨酸含量等,从而增强植株对干旱胁迫的适应性。外施SA可以起到与ABA相似的效果。在本研究中,干旱胁迫下的“波尼”叶片ABA含量无显著变化,SA含量先升后降。这说明,在干旱胁迫前期,SA对“波尼”起到了一定的保护功能。JA作为信号分子,能有效地介导植物的防御反应。金毅等[27]研究发现,外源JA提高干旱胁迫过程中保护物质的含量,从而降低干旱胁迫对大豆机体的损伤。在本研究中,干旱胁迫下的“波尼”叶片JA含量持续下降。这可能是“波尼”叶片的JA合成系统承受干旱胁迫的能力较低,极易被干旱胁迫抑制所致。
综上所述,在干旱胁迫下,“波尼”薄壳山核桃可以通过抗氧化系统、渗透调节物质和激素代谢及时进行响应。在受到轻度干旱胁迫时,“波尼”具有有效的防御能力,植株主要通过提高抗氧化酶(SOD)活性、抗氧化物质(AsA、GSH)含量、渗透调节物质(可溶性蛋白和蔗糖)含量以及激素(乙烯、水杨酸)等信号分子的含量来增强自身对干旱胁迫的抵抗能力,但是随着干旱时间的延长,其叶片相对含水量和叶绿素含量显著下降,自由基大量积累,膜质过氧化程度加重,超出“波尼”的承受能力,植株表现为受到较大的伤害。本研究认为,“波尼”品种对轻度干旱有较强的适应性,可以应对短暂缺水的状况,在本试验中缺水处理第6天时,叶片叶绿素含量仍有对照的78%,SOD活性达到峰值,AsA、可溶性蛋白和水杨酸含量处于高水平,表现出较强的抗旱能力,但此后均显著下降,抗旱能力降低。因此,“波尼”品种是干旱敏感型品种,适合在长江以南雨水比较充沛的地区推广种植。

