猪伪狂犬病毒HN-LD株分离鉴定及部分毒力基因遗传进化分析
王先坤 谭磊 徐凯文 李静




摘要:为了解湖南省伪狂犬病毒(PRV)病原特征及遗传变异情况,从湖南娄底某猪场采集疑似感染伪狂犬病(PR)病料,通过细胞传代、PCR鉴定、间接免疫荧光试验(IFA)等进行病毒分离鉴定;对该毒株的gC、TK和gE基因进行PCR扩增及测序,分析其变异情况。结果表明,临床病料接种PK15细胞后有1份样品出现细胞病变,经过PCR和IFA鉴定结果表明分离的毒株为PRV(命名为HuN-LD株),盲传第6代病毒的滴度为107.5 TCID50/mL。与参考PRV毒株相比,该毒株gE、TK和gC基因序列与国内流行变异株对应序列同源性最高,与其他毒株同源性相对较低。基于gC基因序列构建的系统进化数分析结果表明,该毒株与国内2011年后流行变异株亲缘关系最近,属于同一分支,但与国外流行的毒株(NIA3和Becker等)相隔较远,属于不同分支。提示成功分离得到1株PRV变异株,该结果可为湖南省PRV流行病学研究及疫苗研发等提供科学依据。
关键词:猪伪狂犬病毒;分离鉴定;遗传变异;进化分析;湖南省
中图分类号:S852.65+1 文献标志码: A
文章编号:1002-1302(2022)10-0171-05
猪伪狂犬病(pseudorabies,PR)是由猪伪狂犬病毒(pseudorabies virus,PRV)感染所引起,该病原可感染多种动物,包括猪、牛、羊和犬等,临床症状主要包括腹泻、发热、脑炎和奇痒(猪除外)为主要特征[1-2]。猪为PRV的主要宿主,但不同发育阶段猪群感染该病原后表现临床症状均有所不同:仔猪出现脑炎和腹泻等,育肥猪出现呼吸道症状,种公猪繁殖能力下降,繁殖母猪流产、死胎等[3]。目前,对于PR防控主要依靠使用标记疫苗和相应的鉴别诊断方法,部分国家或地区采用此策略成功控制或净化该病。2011年前,我国主要依靠基于Bartha株研发的基因缺失弱毒疫苗来防控PR,且取得较好效果。自2011年冬季以来,我国部分省市猪场暴发PR,且这些猪场大部分均免疫接种过PRV弱毒疫苗,这提示传统的PRV疫苗无法对目前流行的变异株提供完全保护,而进一步序列分析结果也发现PRV变异株和传统株部分抗原基因存在较大差异[4-5]。
PRV为DNA病毒,成熟的病毒粒子为球形,其基因组全长约为143 kb,可编码多种蛋白。gE、gI、TK、gC和gD等蛋白共同调控PRV的毒力,其中,gE为PRV的主要毒力基因,缺失该基因可导致保持毒株的免疫原性,但毒力会极大下降[6];TK基因编码的胸苷激酶可参与病毒的潜伏感染;gC基因编码的糖蛋白则可诱导细胞免疫,在病毒吸附和释放等过程中发挥重要的作用,且该基因的变化可影响中和抗体的产生[7]。
湖南省生猪养殖业发达,但王昌建等的调查结果显示,2018年湖南省部分地区规模化猪场PRV-gE血清抗体阳性率达21.0%,提示猪伪狂犬病在湖南地区广泛流行,且野毒感染情况较为严重[8]。为初步调查湖南地区PRV流行株病原特征及基因变异情况,本研究首先通过细胞传代、PCR检测、间接免疫荧光检测技术(IFA)对病原进行分离及鉴定,其后测定该毒株的滴度并分析其对小鼠的致病性,最后通过PCR法对该毒株的gE、TK和gC基因序列进行扩增并测序,分析其基因变异情况,并分析其遗传进化关系,以期为湖南省PRV分子流行病学研究提供科学依据。
1 材料与方法
1.1 病料来源、细胞及试验动物
猪肾上皮细胞(PK15细胞),由湖南农业大学动物医学院保存。肾脏、肺脏、脑、淋巴结等组织样品于2019年8月初采集于河南省娄底市某疑似感染猪伪狂犬病的猪场,将样品标记后保存于 -20 ℃,待检。12只4周龄雌性昆明小鼠,购自于湖南斯莱克景达实验动物有限公司。
1.2 主要试剂
DNA/RNA基因组提取试剂盒,购于AXYGEN公司;胰蛋白酶、DMEM培养基和胎牛血清等,购于Gbico公司;ApexHF HS DNA 聚合酶预混液,购于艾克瑞生物有限公司;DL 3000 DNA marker、50×TAE溶液等,购于宝生物工程(大连)有限公司;琼脂糖凝胶DNA回收试剂盒,购于Omega公司;MLV反转录试剂,购于Promega公司;Random Primer和dNTP mix,均购于赛默飞世尔科技公司。
1.3 方法
1.3.1 病毒分离 将组织病料送至湖南农业大学动物医学院,取脑组织、肾脏和淋巴结样品剪碎后置于离心管内,加入适量灭菌PBS溶液和钢珠,匀浆后反复冻融3次,低温(4 ℃)高速(13 000 r/min)离心5 min,获得上清,采用0.22 μm滤膜过滤除菌。取100 μL滤液接种于单层的PK15细胞,2 h后弃去病毒液,采用PBS溶液清洗后加入含2%血清DMEM培养液,37 ℃、5% CO2培养箱中连续培养3 d,期间观察细胞是否出现病变。
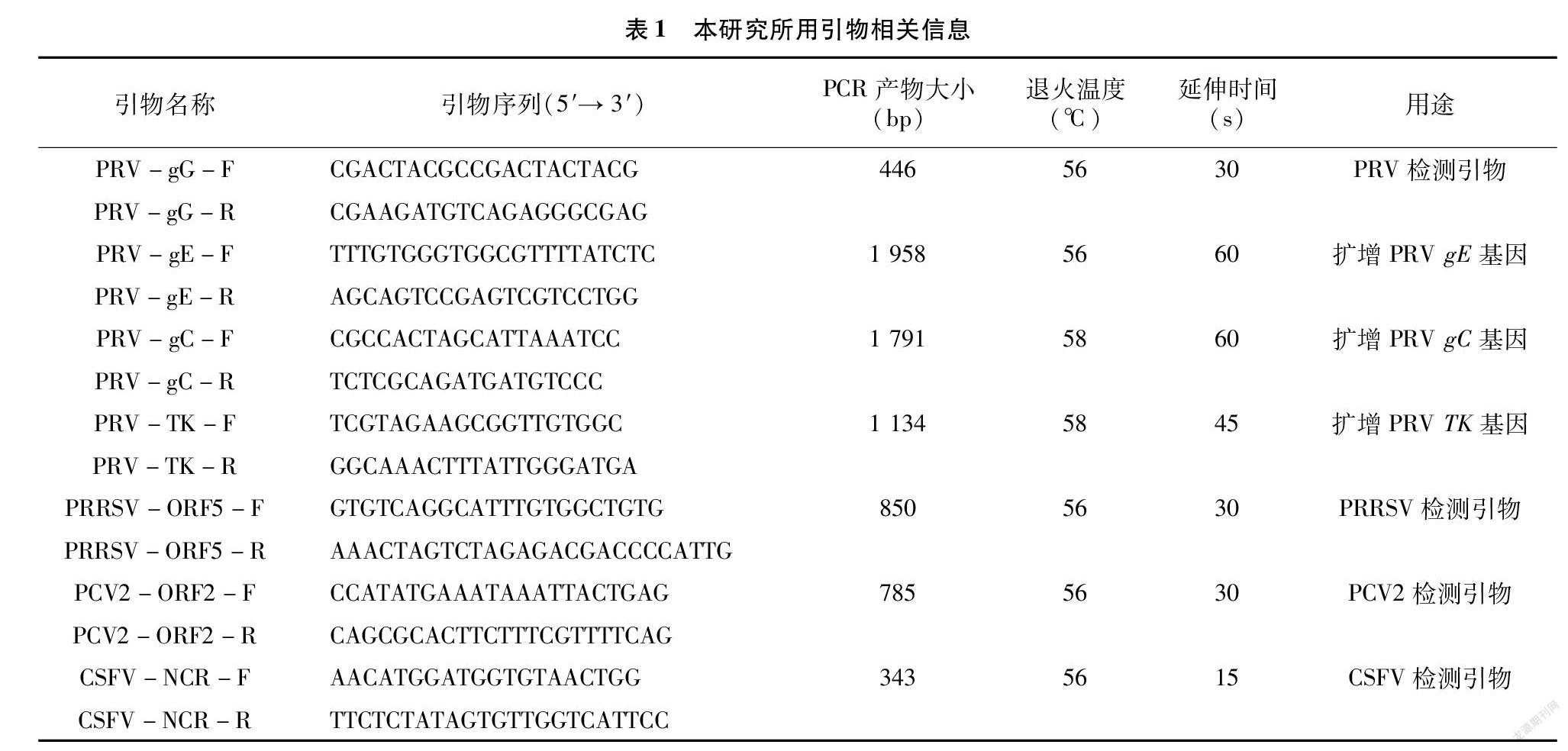
1.3.2 PCR/RT-PCR鉴定、目的基因扩增及分析 当细胞出现明显病变后,收获细胞上清,采用DNA/RNA提取试剂盒提取基因组核酸,根据反转录步骤将基因组中RNA反转录为cDNA。根据GenBank中PRV 全基因序列设计并合成4对特异性引物,采用于PRV的分子鉴定和gE、gC、TK全基因扩增(表1),同时参考猪繁殖与呼吸障碍综合征病毒(PRRSV)的ORF5基因、猪圆环病毒2型(PCV-2)的ORF2基因和猪瘟病毒(CSFV)的NCR基因设计相应的特异性检测引物,引物均由擎科生物科技有限公司合成。
PCR反应体系(25.0 μL):ApexHF HS DNA 聚合酶预混液 12.5 μL、DNA/cDNA模板2.0 μL、上下游引物各0.5 μL及灭菌双蒸水9.5 μL;PCR反应条件为:94 ℃ 1 min;98 ℃ 10 s,56~58 ℃ 15 s,72 ℃ 30~60 s,共35个循环;72 ℃ 7 min。PCR反應结束后取5.0 μL产物经2.0%琼脂糖凝胶电泳检测,将阳性PCR产物送至擎科生物科技有限公司进行双向测序。
测序结果返回后,将序列拼接,同时在GenBank数据库中下载PRV参考毒株的对应序列,用DNA star 5.0软件分析本研究获得毒株的gE、gC和TK基因序列与参考序列的同源性;同时用MEGA 6.0软件中的邻接法构建gC基因序列的遗传进化树,其Bootstrap值设置为1 000。
1.3.3 间接免疫荧光(IFA)鉴定 取适当稀释的病毒上清接种于单层PK15细胞,孵育1 h后弃上清,加入适量含2% NBCS的DMEM培养基 在5% CO2、37 ℃培养24 h后进行间接免疫荧光试验。其具体步骤如下:(1)弃去培养基,采用PBS洗涤3次;(2)加入4%多聚甲醛溶液室温固定15 min,PBS洗涤3次; (3)含0.1% Triton-100 PBS溶液室温孵育10 min,PBS洗涤3次;(4)含3% BSA的PBS溶液室温封闭1 h;(5)采用鼠源PRV-gE单克隆抗体(1 ∶1 000)室温孵育4 h,其后PBS洗涤5次;(6)FITC标记的驴抗鼠荧光二抗(1 ∶3 000)室温孵育45 min,PBS洗涤5次;(7)最后在荧光显微镜下观察结果并拍照保存。
1.3.4 病毒滴度测定 将该毒株纯化后连续扩增传6代,取第6代病毒进行10倍稀释后分别接种于PK15单层细胞(培养于96孔板),每个稀释度作8个重复,每个孔接种100 μL病毒,并设置阴性对照(接种100 μL DMEM培养基)。将96孔板置于细胞培养箱内3 d,其后观察各孔细胞病变情况,并按照Reed-Muench法计算病毒的TCID50。
1.3.5 动物试验 将12只4周龄的雌性昆明小鼠随机分为2组,每组6只小鼠,设置为对照组和试验组。试验组小鼠分别接种100 μL 105 TCID50/0.1 mL 的病毒,接种途径为腿部肌肉注射;对照组小鼠分别于腿部肌肉注射100 μL DMEM培养液。接种后每日观察小鼠临床症状及死亡情况,72 h后将各组存活小鼠处死,取脑组织提取基因组后进行PCR检测。
2 结果与分析
2.1 PCR检测结果
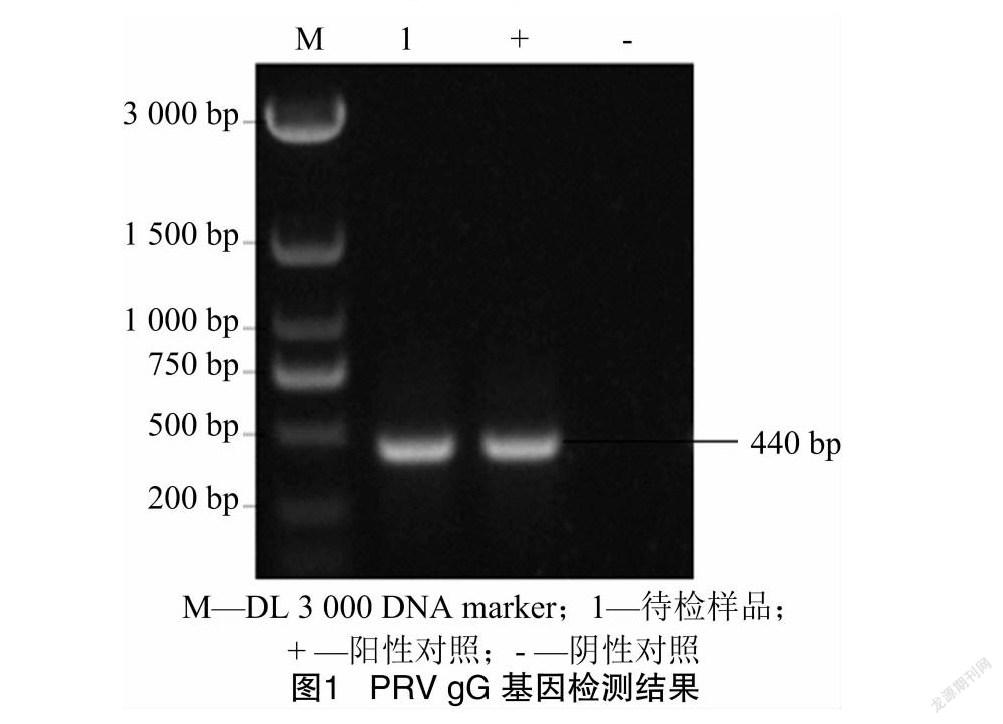
将组织病料处理后,提取组织中病毒核酸,通过PCR/RT-PCR对PRV、PCV2、PRRSV和CSFV特定基因进行检测,由图1可知,样品中仅检出PRV gG特异性核酸,其PCR产物大小约为440 bp,但未检测出其他病原核酸(图略)。
2.2 病毒分离结果
将组织处理后取上清接种于单层PK15细胞,由图2可知,24 h后可见接毒后细胞出现明显病变,主要表现为细胞变圆、融合和拉丝等,而空白对照组细胞未出现细胞病变。
2.3 分离毒株IFA鉴定
将分离的毒株接种于PK15细胞,24 h后进行IFA鉴定。由图3可知,接种病毒的部分PK15细胞可见明显绿色荧光,而对照组细胞未见绿色荧光。由于感染该病毒的细胞可被PRV单克隆抗体特异性识别,因此本研究分离的毒株为PRV(命名为HuN-LD株)。
2.4 PRV目的基因扩增及分析
采用DNA提取试剂盒提取第6代PRV病毒基因组,采用PCR法对该毒株的gE、gC和TK基因进行扩增。由凝胶电泳结果(图4)可知,该毒株的gE、TK和gC基因分别扩增约1 900、1 200、1 800 bp条带,与预期片段大小一致。
基因核苷酸序列同源性分析结果表明,PRV HuN-LD株gE、TK和gC基因与国内流行的PRV变异株(如JS-2012株、HeN1201株、TJ株和JXCH株等)对应序列同源性分别为99.4%~99.9%、99.7%~100.0%和99.8%~100.0%,與国内2011年前流行的毒株(Ea株和Fa株)和国外流行毒株(Bartha株、NIA3株和Becker株等)同源性相对较低。
为进一步分析本研究获得的PRV毒株与其他参考毒株的遗传进化关系,基于PRV gC基因核苷酸序列构建系统种系发育树。由图5可知,所有PRV毒株在系统进化树上可分为2个基因型分支,分别为基因1型和2型,本研究获得毒株(HuN-LD株)与国内流行的变异株(如HN1201株和JS-2012株)聚为同一分支,与国内流行的传统株(Ea株和Fa株)相隔较近,均属于基因2型;而国外流行的毒株(如Bartha株和Becker株)属于基因1型,与本研究获得的毒株所属分支相隔较远。因此,本试验获得的毒株应属于PRV变异株。
2.5 TCID50测定与动物试验
将第6代病毒梯度稀释后接种于96孔板的PK15细胞,培养72 h后通过观察各稀释组出现细胞病变情况计算该病毒的TCID50值。结果显示,该病毒的滴度为107.5 TCID50/mL。将该病毒稀释至106.0 TCID50/mL,给试验组小鼠各接种100 μL,接种24 h后临床观察可见试验组小鼠均出现呼吸急促、奇痒等症状,于36~48 h小鼠全部死亡,而对照组小鼠无异常表现。剖检各组小鼠,可发现接种病毒组小鼠脑组织充血或出血,其他脏器无明显病变,对照组小鼠各组织脏器均正常。进一步PCR验证结果也确定试验组小鼠脑组织存在PRV核酸,而对照组为PRV核酸阴性。
3 讨论
猪伪狂犬病是一种对养猪业威胁巨大的重要传染病之一,该病可导致仔猪出现腹泻、呕吐和神经症状等,伴随高发病率和死亡率;母猪和种公猪出现繁殖障碍,前者一般为流产、死胎等,而种公猪则表现睾丸炎和精液品质下降等,且精液中也可携带病毒,对其他健康待配种猪群造成威胁[9-10]。当前,对于伪狂犬病的防控主要依赖于疫苗免疫接种和相应的鉴别诊断策略,近30年来国外使用基于Bartha株研发的基因缺失疫苗对伪狂犬病的防控取得了较好的效果,但2011年以来部分已接种传统疫苗的猪场仍然暴发伪狂犬病,且进一步测序结果表明这些毒株与传统毒株的抗原基因存在较大差异,这可能是导致传统疫苗对当前流行的PRV变异株防控效果不理想的主要原因[11]。
本研究从湖南娄底某免疫Bartha株仍发病猪场分离获得1株病毒,通过PCR检测、IFA检测和细胞病变情况可将其鉴定为PRV毒株(HuN-LD株);其后将该病毒人工感染昆明小鼠,可导致小鼠出现明显的临床症状和死亡,最终在死亡小鼠脑组织中也检测到了PRV核酸,其结果提示该毒株对小鼠具有较高的致病性,但对猪的致病性还需要进一步试验探究。
PRV属于疱疹病毒科成员,其基因组较大(约143 kb),可编码至少72种蛋白,其中部分编码蛋白与病毒毒力或免疫相关,其中gE、PK等基因主要病毒的毒力或致病性等相关,gC糖蛋白可诱导细胞免疫,在病毒吸附、释放等过程发挥重要作用[3,12]。由于PRV基因组庞大,这导致扩增其全基因组序列分析基因变异情况相对困难,所以研究人员一般通过分析这些与免疫及毒力相关基因序列信息来初步确定毒株基因组变异情况。本研究通过对PRV HuN-LD株的gE、TK和gC基因序列进行扩增与分析,发现与国内流行变异株相比,其核苷酸序列仅部分位点出现碱基替换或变异,提示当前变异株主要毒力或免疫基因在核苷酸或氨基酸水平上具有较高的保守性[3]。
基于gC基因构建PRV系统进化树,分析本研究获得毒株与GenBank收录的国内外具有代表性PRV毒株的遗传进化关系。结果发现,本研究获得的毒株可与国内流行的变异株(如JS-2012株和HN1201株)聚为同一分支,与国内流行的PRV传统株(如Ea株)和国外流行毒株(疫苗株)相距较远,提示本研究分离毒株属于PRV变异株。虽然,目前大部分猪场通过加强免疫接种疫苗(如Bartha或HB-98疫苗)可有效防控PRV野毒感染,但目前我国PRV流行情况仍然不容客观,这可能主要与许多散养户未免疫接种PRV相关疫苗或养殖水平较低等有关[12],但这也提示我们需要研发以PRV变异株为亲本的新型疫苗,这样可能对猪伪狂犬病的防控更为有效。
参考文献:
[1]傅宏庆,姚志兰,刘轶秋,等. 猪伪狂犬病毒YZ株的分离鉴定及遗传进化分析[J]. 扬州大学学报(农业与生命科学版),2020,41(5):36-41.
[2]Tan L,Yao J,Yang Y D,et al. Current status and challenge of pseudorabies virus infection in China[J]. Virologica Sinica,2021,36(4):588-607.
[3]袁献宇,杨龙斌,何赞赞,等. 安徽省猪伪狂犬病毒的分离鉴定及其主要毒力基因分子特征[J]. 浙江农业学报,2020,32(1):43-56.
[4]An T Q,Peng J M,Tian Z J,et al. Pseudorabies virus variant in bartha-K61-vaccinated pigs,China,2012[J]. Emerging Infectious Diseases,2013,19(11):1749-1755.
[5]夏 伟,牟 迪,唐志芬,等. 2016年245個规模猪场7种病毒类疾病病原流行病学调查与2017年防控建议[J]. 养猪,2017(2):89-92.
[6]刘 珍. 猪伪狂犬病病毒变异株的分离鉴定及gE基因缺失株的构建[D]. 扬州:扬州大学,2017.
[7]吴 开. 猪伪狂犬病毒TA-2017的分离鉴定及其主要囊膜糖蛋白遗传变异分析[D]. 泰安:山东农业大学,2018.
[8]王昌建,方 铃,林 源,等. 2018年湖南省规模猪场伪狂犬病血清学调查[J]. 动物医学进展,2021,42(5):132-135.
[9]Szpara M L,Tafuri Y R,Parsons L,et al. A wide extent of inter-strain diversity in virulent and vaccine strains of alphaherpesviruses[J]. PLoS Pathogens,2011,7(10):e1002282.
[10]杨永能. 种公猪精液携带6种繁殖障碍性病原状况调查[J]. 中国猪业,2019,14(5):75-78.
[11]Ye C,Zhang Q Z,Tian Z J,et al. Genomic characterization of emergent pseudorabies virus in China reveals marked sequence divergence:Evidence for the existence of two major genotypes[J]. Virology,2015,483:32-43.
[12]杨涛涛,赵 墩,刘崇灵,等. 湖南省4株伪狂犬病病毒的分离鉴定及其免疫与毒力相关基因的序列分析[J]. 中国畜牧兽医,2016,43(1):50-57.

