CircSHKBP1通过miR-1294调控胃癌细胞增殖、迁移侵袭和凋亡的机制研究
陈媛媛 唐艳 李玲
胃癌(gastric cancer,GC)是世界第五大最常见的癌症,也是全球第三大癌症死亡原因,严重威胁着人类的健康[1]。因此,研究胃癌诊断、预后和药物治疗的靶点具有重要的医学意义。越来越多的证据表明,非编码RNA(non-coding RNA,ncRNA)在胃肠道恶性肿瘤中发挥调节作用。近年来,研究人员利用高通量测序技术和生物信息学在哺乳动物细胞中发现了大量的环状RNA(circular RNA,circRNAs),并证实其参与胃癌细胞的增殖、凋亡和迁移侵袭[2]。近期有研究报道,新发现的环状RNA SH3结构域激酶结合蛋白1(circular RNA SH3 binding protein 1,CircSHKBP1)在胃癌患者组织和血清中的表达均异常上调,并且与胃癌的恶性进展有关[3],但是CircSHKBP1发挥促进癌症恶化的机制尚未清楚。大量研究证实,circRNA通过吸附miRNAs的方式发挥癌症发展中的调控蛋白翻译功能[4]。miR-1294在多种癌症中表达异常下调,发挥抑制癌症恶化的作用,其中包括胃癌[5,6]。但是,CircSHKBP1在胃癌中的调控作用是否与miR-1294相关联,有待进一步研究。本研究拟以胃癌细胞为研究对象,观察过表达CircSHKBP1对胃癌细胞增殖、迁移侵袭和凋亡的影响,旨在揭示其作用机制与CircSHKBP1靶向miR-1294有关,为胃癌的诊断、治疗提供新方向。
1 材料与方法
1.1 实验材料 本实验所用组织标本收集于2019年3月至2021年2月,本医院确诊并行外科手术切除的胃癌标本及其正常组织40例,其中处理T1~T2级的有12例,T3~T4级的有28例。涉及的患者及其家属全部签署知情同意书。本试验跟踪回访调查本医院确诊的90例胃癌患者的5年生存期。正常胃上皮细胞GES1、胃癌细胞MGC803、HGC27、BGC823均购自上海中国科学研究院细胞库。DMEM培养基购自北京康为世纪;胎牛血清购自杭州四季青;CCK-8试剂购自日本同仁化学研究所;胰蛋白酶均购自美国Sellect公司;LipofectamineTM3000购自大连TaKaRa公司;荧光素酶报告基因检测试剂盒购自上海艾博抗贸易有限公司;Transwell小室购自美国Corning公司;膜联蛋白V-异硫氰酸荧光素和碘化丙锭细胞凋亡检测试剂盒(Annexin V-fluorescein isothiocyanate,Annexin V/FITC)购自北京索莱宝公司;ABI 7500型实时荧光定量PCR系统购自美国ABI公司;细胞培养箱购自美国Forma Scientific公司。
1.2 实验方法
1.2.1 组织样本的处理:取出冰冻保存的组织,缓慢融化,无菌研磨,用2倍组织体积的无菌蒸馏水稀释研磨,最后保存备用。将癌旁的正常胃组织标记为正常胃组织组,T1~T2级癌组织标记为T1~T2组,T3~T4级癌组织标记为T3~T4组。
1.2.2 细胞培养与分组:将GES1、MGC803、HGC27、BGC823在培养的时候使用DMEM培养基培养(混有10%胎牛血清)。培养温度为37℃,所用气体为5%CO2,95%O2,隔天换液。将培养48 h的这些细胞分别标记为GES1组、MGC803组、HGC27组、BGC823组。将pcDNA、pcDNA-CircSHKBP1、miR-NC、miR-1294、pcDNA-CircSHKBP1+miR-NC、pcDNA-CircSHKBP1+miR-1294用脂质体LipofectamineTM3000转染或共转染入常规培养的BGC823(转染18 h后,换液培养),分别标记为pcDNA组、pcDNA-CircSHKBP1组、miR-NC组、miR-1294组、pcDNA-CircSHKBP1+miR-NC组、pcDNA-CircSHKBP1 +miR-1294组。用qRT-PCR法检测细胞转染效率(>70%)。
1.2.3 RT-qPCR实验:使用RNA抽提试剂盒提取细胞总RNA,在19℃将其逆转录为cDNA,置于-40℃保存备用。用RT-qPCR试剂盒检测CircSHKBP1、miR-1294的mRNA表达水平。以GAPDH、U6为内参,2-△△Ct法计算CircSHKBP1 mRNA、miR-1294 mRNA的表达。每个样品做3个重复,实验重复3次。引物信息:CircSHKBP1:上游引物,5’-AGGTCAGGCAGAGGAAGTCA-3’,下游引物,5’-CGCGTCATAACTGGTGATGG-3’;miR-1294:上游引物,5’-TATGATCTCACCGAGTCCT-3’,下游引物,5’-CACCTTCCTAATCCTCAGTT-3’;GAPDH,上游引物,5’-GGACCTGACCTGCCGTCTAG-3’;下游引物,5’-TAGCCCAGGATGCCCTTGAG-3’;内参U6用通用引物。
1.2.4 CCK-8实验:将待检测的细胞密度调至约2×105个/ml,使用CCK-8试剂盒检测细胞在490 nm波长下检测细胞OD值。每个样品做3个重复,实验重复3次。细胞增殖率(%)=(OD490处理组/OD490 对照组-1)×100%。
1.2.5 Transwell小室实验:先将待检测的细胞用无血清培养基饥饿处理12 h,再将细胞消化,离心弃上清,用1%血清的培养液调整至105个/ml,待用。取100 μl 置于上室,取600 μl含10%血清的培养液置于下室,常规培养12 h。用甲醇固定结晶紫染色染色后,对细胞拍照计数。每个样品做3个重复,实验重复3次。细胞迁移率(%)=穿膜细胞数/细胞总数×100%;细胞侵袭率(%)=侵袭细胞数/细胞总数×100%。
1.2.6 Annexin V-/FITC实验:Annexin V-/FITC测定法用于评估细胞的凋亡。按照Annexin V-/FITC细胞凋亡检测试剂盒的制造商说明要求操作,用冷PBS洗涤细胞,并用500 μl的结合缓冲液悬浮。接着将5 μl的 Annexin V-FITC和5 μl的碘化丙啶加入到结合缓冲液中,最后在室温下在黑暗环境中孵育5min,上流式细胞仪分析细胞的染色情况。细胞凋亡率为细胞的早期凋亡率与晚期凋亡率之和。
1.2.7 荧光素酶报告基因检测实验:通过预测网站https://circinteractome.nia.nih.gov/预测到CircSHKBP1与miR-1294存在潜在的结合位点。将CircSHKBP1-WT(含CircSHKBP1结合位点)和CircSHKBP1-MUT(不含CircSHKBP1结合位点)的克隆到pGL3荧光素酶报告质粒载体。将BGC823细胞培养24 h后,与报告质粒共转染,转染48 h,用荧光素酶报告基因试剂盒测定荧光活性。

2 结果
2.1 CircSHKBP1在胃癌组织、胃癌细胞中的表达 CircSHKBP1高表达患者的生存期显著低于低表达的患者(P<0.05)。CircSHKBP1mRNA在胃癌组织中的表达较正常胃组织明显上调(P<0.05)。CircSHKBP1mRNA在胃癌细胞中的表达显著高于GES1细胞(P<0.05)。见图1,表1、2。

图1 不同CircSHKBP1表达水平的胃癌患者的生存率
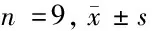
表1 CircSHKBP1 mRNA在胃癌组织中的表达
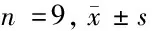
表2 CircSHKBP1 mRNA在胃癌细胞中的表达
2.2 过表达CircSHKBP1的BGC823细胞的增殖、迁移、侵袭和凋亡 与pcDNA组比较,pcDNA-CircSHKBP1组细胞中CircSHKBP1 mRNA表达显著升高(P<0.05),细胞增殖率、迁移率和侵袭率均明显升高(P<0.05),细胞凋亡率显著降低(P<0.05)。见图2,表3。

图2 过表达 CircSHKBP1的胃癌细胞迁移侵袭图和凋亡图;A 过表达CircSHKBP1的胃癌细胞迁移侵袭图(HE×200);B 过表达CircSHKBP1的胃癌细胞凋亡图
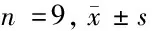
表3 过表达CircSHKBP1的BGC823细胞的增殖、迁移、侵袭和凋亡情况
2.3 CircSHKBP1靶向miR-1294 通过Circinteractome网站预测到CircSHKBP1与miR-1294存在连续的7个结合位点。荧光素酶检测显示,miR-1294组细胞的荧光活性显著低于miR-NC组(P<0.05),与anti-miR-NC组比较,anti-miR-1294组荧光活性变化不明显(P>0.05)。胃癌组织中miR-1294与CircSHKBP1的mRNA的表达水平呈负相关(P<0.05)。见图3、4,表4。
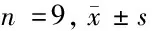
表4 双荧光素酶报告基因检测试验结果

图3 CircSHKBP1与miR-1294的结合位点

图4 胃癌组织中CircSHKBP1和miR-1294的mRNA表达
2.4 miR-1294在胃癌组织和细胞中的表达 与正常胃组织组比较,T1-T2组、T3-T4组胃癌组织中的miR-1294 mRNA的表达水平均显著降低(P<0.05)。与GES1组比较,MGC803、HGC27、BGC823细胞中的miR-1294 mRNA的表达水平也均显著降低(P<0.05)。见表5、6。
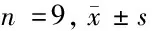
表5 miR-1294在胃癌组织中的表达
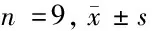
表6 miR-1294 mRNA在胃癌细胞中的表达
2.5 过表达miR-1294的BGC823细胞的增殖、迁移、侵袭和凋亡 与miR-NC组比较,miR-1294组细胞中miR-1294表达显著升高(P<0.05),细胞增殖率、迁移率和侵袭率均显著降低(P<0.05),细胞凋亡率显著升高(P<0.05)。见图5,表7。
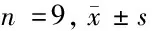
表7 过表达miR-1294对BGC823细胞的增殖、迁移、侵袭和凋亡的调控

图5 过表达miR-1294的BGC823细胞迁移侵袭图和凋亡图;A 过表达miR-1294的BGC823细胞迁移侵袭图(HE×200);B 过表达miR-1294的BGC823细胞凋亡图
2.6 过表达miR-1294逆转CircSHKBP1对BGC823细胞的增殖、迁移、侵袭和凋亡的调控 与pcDNA-SHKBP1+miR-NC组比较,pcDNA-SHKBP1+ miR-1294组细胞的增殖率、迁移率和侵袭率均显著降低(P<0.05),细胞的凋亡率显著升高(P<0.05)。见图6,表8。

图6 过表达miR-1294和CircSHKBP1的BGC823细胞迁移侵袭图和凋亡图;A BGC823细胞迁移侵袭图(HE×200);B BGC823细胞凋亡图
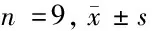
表8 过表达miR-1294逆转CircSHKBP1对BGC823细胞的调控作用
3 讨论
环状RNA(circRNAs)是一类通过反向剪接产生的ncRNAs,具有稳定的环状结构。CircRNA在组织中富集丰富,有数千种circRNAs在肿瘤组织和正常组织中存在差异表达[7]。据报道,CircRNA hsa_circ_0004872、CircRNA-hsa-circ_ 0000670、CircRNA-circ_0026359均在胃癌的发展进程中具有重要的调控作用,并且其作用机制均与靶向吸附miRNA有关[8-10]。最近,Xie等[3]在胃癌的研究中报道,外泌体circSHKBP1表达异常升高,促进胃癌细胞的增殖、迁移侵袭和血管形成,其作用机制与CircSHKBP1吸附miR-582-3p,结合HSP90,进而阻碍STUB1与HSP90的相互作用,抑制HSP90的泛素化有关。
本研究发现,CircSHKBP1在胃癌组织中的表达异常升高,过表达CircSHKBP1具有促进胃癌细胞增殖、迁移侵袭和抑制凋亡的作用,这与Xie等[3]的研究结果相吻合。此结果再次证实了CircSHKBP1在胃癌中的促进癌症恶化的功能,为CircSHKBP1用于胃癌的诊断治疗提供支持。通过荧光素酶检测实验发现,CircSHKBP1可靶向miR-1294,猜测miR-1294可能参与CircSHKBP1在胃癌中的促癌作用。
随着高通量RNA测序技术和新型生物信息学工具的发展,已经在各种生物体中鉴定出了数千种circRNAs。circRNAs可以通过影响转录、mRNA转换以及通过吸附RNA结合蛋白和miRNA来调控基因表达[11,12]。Wu等[13]报道,miR-1294在胃癌组织和细胞中异常下调,作为丰富核转录本1 的靶基因调控miR-1294/AKT1-PI3K/AKT/mTOR信号通路发挥促癌作用。Wang等[14]报道,miR-1294在胃癌患者组织和细胞中表达下调,并且miR-1294高表达组的总生存期明显长于miR-1294低表达组,其还可直接靶向FOXK1调节上皮间质转化。Shi等[15]报道,miR-1294在胃癌组织中的表达明显低于相邻正常组织,这与肿瘤大小、淋巴结转移等临床病理参数相关,此外,miR-1294表达较低的胃癌患者与miR-1294表达较高的患者相比,无病生存(DFS)和总生存(OS)时间更短。
本研究发现,miR-1294在胃癌组织和细胞中的表达水平也是异常降低。进一步研究发现,过表达miR-1294能够抑制CircSHKBP1对胃癌细胞的增殖、迁移侵袭促进和凋亡抑制作用。这个实验结果展示了CircSHKBP1与miR-1294在胃癌中的相互作用关系,为研究CircSHKBP1在胃癌中的作用机制奠定理论基础。
综上所述,CircSHKBP1在胃癌中表达异常上调,并且可促进胃癌细胞发生增殖、迁移侵袭,抑制凋亡的进行,不利于患者生存,产生这种作用的机制与靶向miR-1294相关,为胃癌的临床治疗提供潜在靶点。

