罗氏沼虾成虾中氨基脲的分布特征*
莫梦松 蔡 楠 李来好 王旭峰 王 强 关婉琪 赵东豪
罗氏沼虾成虾中氨基脲的分布特征*
莫梦松1,2蔡 楠2李来好2①王旭峰2王 强2关婉琪2赵东豪2①
(1. 浙江海洋大学食品与药学学院 浙江 舟山 316022;2. 中国水产科学研究院南海水产研究所 农业农村部水产品加工重点实验室 广东省渔业生态环境重点实验室 广东 广州 510300)
从未使用呋喃西林的罗氏沼虾()养殖场采集商品规格虾样品,分离壳、肌肉、肌肉表皮层、内脏和复眼等组织测定氨基脲(semicarbazide, SEM),探究其在商品规格罗氏沼虾不同组织中的本底含量,为质量安全监管提供技术支撑。结果显示,罗氏沼虾各组织中SEM平均含量为(12.90±2.47) μg/kg,其中,外骨骼(复眼、外壳和肢足)中的平均含量分别为(33.29±3.06)、(29.00±5.67)和(28.10±7.08) μg/kg,占总量的77.9%。肌肉中SEM含量最低,平均值为(1.83±0.24) μg/kg。不同组织中SEM含量从高到低依次为复眼>外壳>肢足>肠>鳃>肌肉表皮层>肝>生殖腺>肌肉。鉴于目前的技术手段还难以区分罗氏沼虾体内SEM的来源是内源性还是外源性,因此,建议监管部门在开展罗氏沼虾中呋喃西林残留量的监控时,考虑减去SEM的本底含量,以避免误判情形的发生。
罗氏沼虾;氨基脲;呋喃西林;分布特征
氨基脲(semicarbazide, SEM)又名氨基甲酰肼,是一种有机合成原料,作为药物合成的中间体,可用于生产呋喃西林等药物。呋喃西林具有广谱抗菌作用,对大多数革兰氏阳性菌、革兰氏阴性菌、某些真菌和原虫有杀灭作用(陈杖榴, 2002)。但该药物被认为有潜在的致癌和致突变作用,中国、日本和欧盟等国家或地区已经禁止在养殖业中使用这些药物(Park, 2017; Shendy, 2016)。呋喃西林在用药数小时内迅速代谢为5-硝基-2-糖醛(5-nitro-2-furaldehyde, NF)和SEM (Wang, 2019),其中,SEM可与组织结合,在动物体内持续停留数周,甚至数月(Li, 2010; Tang, 2018; 赵东豪等, 2012),常作为呋喃西林的残留标志物(Zhang, 2016)。欧盟规定动物源性产品中SEM的最低限量要求为1 μg/kg (Shendy, 2016; Wang, 2019)。
针对SEM的检测方法较多(Du, 2014; Li, 2017; Zhang, 2016),其中,液相色谱–串联质谱法(LC-MS/MS)由于具备灵敏度和准确度高的优点,是目前检测动物源性食品中SEM残留的首要推荐方法。该方法的流程:对动物源性组织酸解游离出的SEM进行衍生化反应,再经富集净化浓缩处理后上机测定(Wang, 2019; 于慧娟等, 2012)。然而,SEM衍生物也可能来源于偶氮二甲酰胺和尿素反应,这些化学物质通常用于食品保存(Calle, 2005; Kwon, 2017)。此外,SEM在日本沼虾()、罗氏沼虾()和河蟹()等甲壳类水产品中经常检出,且外壳中SEM含量要高于肌肉(McCracken, 2013; 王鼎南等, 2016),表明甲壳类动物体内SEM来源广泛,难以准确区分内源性产生、食源性引入或非法使用呋喃西林所致等,且SEM在甲壳类动物体内的组织分布特征不明确,缺少相关文献资料,对监管提出了新的要求。
本研究以未使用呋喃西林的罗氏沼虾为研究对象,采集商品规格样品,分离不同组织测定SEM含量,结合同时采集的饲料、水体、底泥及混养的鲫鱼()样品的检测结果,研究SEM在罗氏沼虾体内的组织分布特征,掌握其本底含量水平,在进行罗氏沼虾中呋喃西林代谢物的残留检测时,为区分其究竟是内源性产生还是外源性有目的使用提供科学依据,为避免质量安全监管误判情形的发生提供理论参考,具有重要的现实意义。
1 材料与方法
1.1 样品采集
罗氏沼虾采自广东省养殖规模较大的罗氏沼虾养殖合作社,在合作社内挑选了不同区域的6家养殖场,每家养殖场抽取上市前商品规格的雌虾和雄虾各3 kg,同时,采集池塘底泥、养殖水、饲料及混养的鲫鱼等样品。罗氏沼虾雌虾与雄虾的平均体重分别为(21.00±2.21) g和(48.00±10.20) g,平均生物学体长分别为(9.93±0.31) cm和(11.90±0.47) cm。
将采集的样品进行组织解剖,取肌肉、外壳(背壳和头胸壳)、肌肉表皮层、肝、复眼(眼球和眼柄)、生殖腺(精囊或卵巢)、鳃、肠和肢足(大小触角,大颚、第1小颚和第2小颚,第1~3颚足,第1~3步足,第1~2腹足及尾扇等,即除背壳和头胸壳外的所有外部肢足)等组织样品。将肌肉等样品制成肉糜,外壳和肢足部分(湿样)均制成小颗粒,肌肉表皮层是指肌肉与外壳接触部分剔除肌肉后的纤维薄膜,饲料为某虾用配合饲料和某南美白对虾()配合饲料2种,为合作社养殖罗氏沼虾用饲料。所有制备好的样品–20℃保存,备用。
1.2 化学品与试剂
甲醇、乙腈和乙酸乙酯均为色谱纯(Sigma, 美国);色谱纯2-硝基苯甲醛、甲酸和氨水(上海阿拉丁生化科技股份有限公司);色谱纯乙酸铵、二甲基亚砜和氢氧化钠(上海麦克林生化科技有限公司);分析纯磷酸氢二钾(国药集团化学试剂有限公司);37%发烟盐酸(Merck, 德国);60 mg/3 mL HLB固相萃取柱(Waters, 美国);0.22 μm有机相滤膜(天津市津腾实验设备有限公司)。
呋喃西林标准品(纯度为99.0%)和SEM标准品(纯度为99.85%) (Dr. Ehrenstorfer, 德国);SEM内标物标准品(纯度为99.8%) (Sigma, 美国)。水为超纯水。
1.3 仪器设备
液相色谱为Waters ACQUITY UPLC I-Class,配有样品管理器、二元溶剂泵和柱温箱。质谱为Xevo TQ-S三重四极杆质谱仪,配电喷雾(ESI)离子源,使用仪器提供的MassLynx 4.1软件对数据进行处理;高效液相色谱HPLC,Waters 2695配2998PDA检测器;Anke DL-600B型离心机(上海安亭科学仪器厂);ZHWY-200D型多轨道恒温振荡器(上海智城分析仪器公司);MS3 basic型旋涡振荡器(IKA, 德国);DTA-3型超声清洗仪(广州凯江仪器有限公司);N-EVAP12氮吹仪(Organomation公司,美国);JJ300型电子天平(常熟双杰测试仪器厂);XS204型万分之一电子天平(Mettler, 瑞士);FW100型高速万能粉碎机(天津泰斯特仪器有限公司)。
1.4 检测方法
罗氏沼虾和鲫鱼等生物样品的前处理参考农业部783号公告-1-2006,并进行了优化,具体如下:将HCl的体积由5 mL增加至10 mL,浓度由0.2 mol/L提高至0.5 mol/L。经乙酸乙酯萃取的样品,于40℃下氮气吹干,残渣用2 mL 10%甲醇溶液复溶,再经5 mL正己烷脱脂后过柱。先将HLB小柱用3 mL甲醇和3 mL水活化,然后,将复溶液以1 mL/min速率上样,弃流出液,3 mL 40%甲醇溶液淋洗后,挤干小柱,再用3 mL甲醇洗脱,收集洗脱液,40℃下氮气吹至近干,用初始比例的流动相定容至1 mL,过0.22μm有机相滤膜,待测。仪器检测方法参考实验室之前建立的方法(赵东豪等, 2016)。
池塘底泥和养殖水体中呋喃西林及SEM的检测,分别参考王强等(2016)和索纹纹等(2013)的方法;饲料中呋喃西林及SEM的检测,参考农业部1486号公告-8-2010及Islam等(2014)的方法。
2 结果与分析
2.1 酸解条件的优化
前处理过程参考农业部783号公告-1-2006,该标准主要针对的是水产品可食性部分中硝基呋喃类代谢物残留测定。2 g样品采用5 mL 0.2 mol/L HCl水解,目的在于破坏代谢物与蛋白质的结合,便于其以游离态与2-硝基苯甲醛衍生化。但由于该研究中涉及外壳/肢足等,其骨质结构中含有的CaCO3会与HCl发生反应,导致体系中HCl浓度下降,pH升高,会影响衍生化反应的效果,导致回收率降低(于慧娟等, 2012)。为提高酸解效率,方便后续的样品处理,该研究将HCl溶液的体积由5 mL增至10 mL。同时,采集外骨骼和经呋喃西林药浴后的罗氏沼虾肌肉,对比10 mL不同浓度的HCl溶液对两类样品的水解效果,测得的SEM含量见图1。当HCl溶液的浓度高于0.5 mol/L时,肌肉和外骨骼样品中SEM含量均不再明显提高,故所有测定SEM含量的样品,均用10 mL 0.5 mol/L HCl溶液水解。

图1 外骨骼和肌肉经不同浓度HCl溶液水解后测得的SEM含量(n=5)
2.2 固相萃取条件的优化
该研究涉及的样品种类比较多,为减少不同种类生物样品基质对SEM含量测定的影响,所有样品经酸解、衍生化、提取和浓缩后,再用HLB小柱净化处理。配制不同比例的甲醇–水溶液进行梯度洗脱实验,以获得最佳的净化效果。结果显示,3 mL 40%甲醇溶液复溶的样品上柱后,当3 mL淋洗液中甲醇的比例为40%以下时,SEM不会随柱漏穿;当甲醇的比例增加至50%时,回收的淋洗液中即可检测到少量目标物。为尽可能多地洗去杂质,且不损失目标物,确定淋洗液为3 mL 40%甲醇溶液。从图2可以看出,将SEM从HLB小柱上完全洗脱需要3 mL甲醇,故确定其为固相萃取时的洗脱液。优化后的方法适合罗氏沼虾、鲫鱼等多种组织样品中SEM衍生物的萃取。
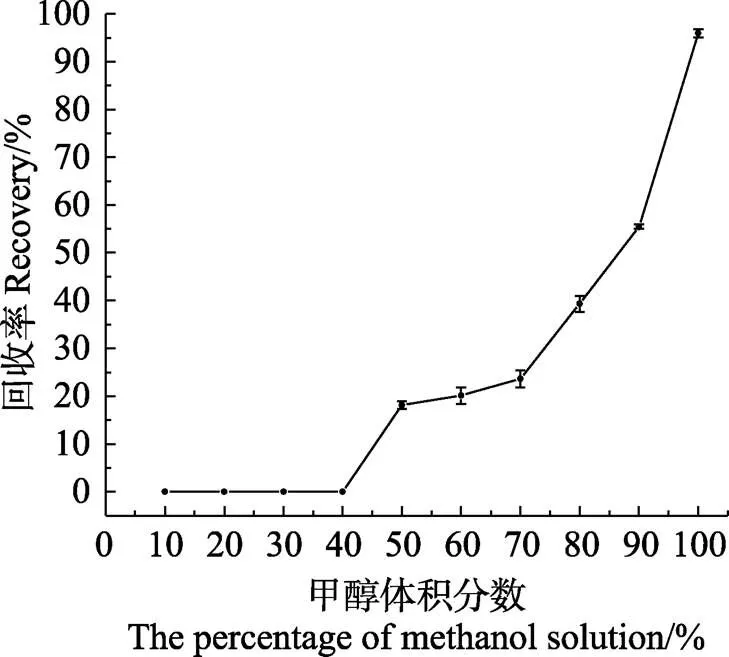
图2 SEM在60 mg/3 mL的HLB小柱上的洗脱曲线(n=5)
2.3 方法质量控制
该研究需要检测的样品除了罗氏沼虾的不同组织外,还包括底泥、养殖水、饲料及混养的鲫鱼等,不同样品采用不同的检测方法。为便于比较,在表1中列出不同检测方法检测过程中的质量控制结果,包括线性范围、加标回收率和相对标准偏差(RSD),并分别以3倍和10倍信噪比(/)计算各方法的检出限和定量限。从表1可以看出,使用的检测方法均能满足质量控制的要求,加标回收率在70%~120%范围内,RSD<15%,可以用于多种样品的检测。
2.4 罗氏沼虾样品检测结果
罗氏沼虾所有组织样品均检出不同含量的SEM (图3),不同组织中SEM含量从高到低为复眼>外壳>肢足>肠>鳃>肌肉表皮层>肝>生殖腺>肌肉。不同组织样品SEM的平均含量为(12.90±2.47) μg/kg,其中,复眼中SEM含量最高,达到(33.29±3.06) μg/kg;其次是外壳的(29.00±5.67) μg/kg和肢足的(28.10± 7.08)μg/kg;肌肉中SEM平均含量最低,为(1.83± 0.24)μg/kg。复眼中SEM含量是肌肉的18.20倍,外壳和肢足则分别是肌肉的15.85倍和15.35倍。复眼、外壳和肢足都可以看成是罗氏沼虾的外骨骼部分(杜娟等, 2018; 王克行, 2002),三者合计占罗氏沼虾SEM总含量的77.9%。即使是SEM含量最低的肌肉样品,也超过欧盟的限量要求1 μg/kg,仅以SEM的检测结果判断罗氏沼虾使用了呋喃西林,极易导致误判情形的发生。
表1 方法质量控制
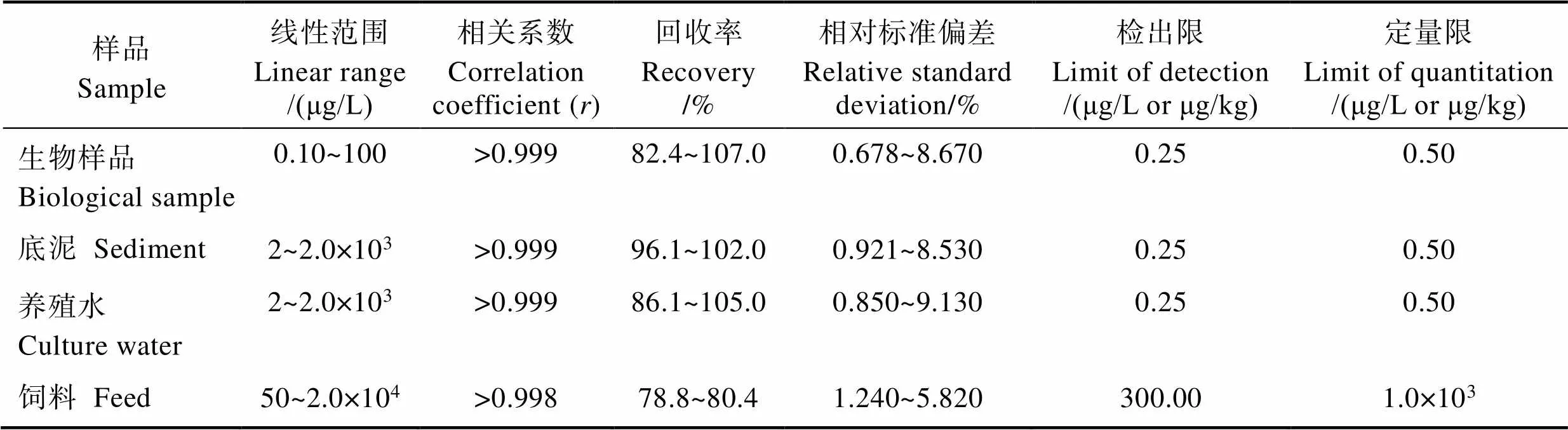
Tab.1 Method quality control

图3 罗氏沼虾成虾中不同组织的SEM含量
CE:复眼;S:外壳;LF:肢足;I:肠;G:鳃; ME:肌肉表皮层;L:肝;GO:生殖腺;M:肌肉
CE: Compound eyes; S: Shell; LF: Limbs and feet; I: Intestine; G: Gills; ME: Muscle epidermis; L: Liver; GO: Gonad; M: Muscle
由图3可见,外骨骼(复眼、外壳和肢足)中SEM含量最高,肌肉中含量最低,肌肉表皮层的含量高于肌肉,外骨骼是罗氏沼虾最易富集SEM的组织,而肌肉表皮层作为外骨骼和肌肉间的纤维膜,SEM平均含量为(5.41±1.40) μg/kg,是肌肉中含量的2.96倍。当罗氏沼虾去壳后,部分表皮层(合成新的外骨骼)留在壳上,部分留在肉上,会导致虾肌肉表皮层和肌肉的自然SEM水平不同。在表皮层中发现的SEM浓度会比在肌肉中发现的浓度高出3倍以上(McCracken, 2013)。因此,当开展罗氏沼虾中呋喃西林的残留检测时,制样过程中应小心分离肌肉表皮层,仅取肌肉部分。
2.5 罗氏沼虾中SEM的性别分析
雌虾和雄虾不同组织中的SEM含量见图4。雌虾的外骨骼、肠和鳃等组织中SEM含量明显高于雄虾,而雄虾肌肉表皮层、肝、生殖腺和肌肉中SEM含量则略高于雌虾。与其他组织相比,外骨骼中SEM的含量呈现出更明显的性别分化现象。精囊和卵巢中SEM含量分别为(2.77±0.72) μg/kg和(2.55±0.92) μg/kg。在所有样品中,发现4份受精卵样品(母虾抱籽),其SEM的平均含量为(1.17±0.06) μg/kg。van Poucke等(2011)将罗氏沼虾从受精卵孵化,杜绝呋喃西林药源,用配方饲料将罗氏沼虾喂养至成虾,从外壳样品中测得SEM的含量为25 μg/kg,同样证明SEM很可能在罗氏沼虾中天然存在。

图4 雌、雄罗氏沼虾SEM含量对比
2.6 环境及投入品样品的检测结果
底泥、养殖水等环境样品及喂养罗氏沼虾的饲料中均未检出呋喃西林,但从底泥中测得的SEM平均含量为(0.42±0.02) μg/kg。研究表明,虾养殖场或海域的沉积物和水样中残留有较高水平的SEM (Islam, 2014; Kwon, 2017; Tian, 2016)。事实上,SEM来源广泛,首先,养殖水因限排政策一直是循环利用的,养殖水和底泥中SEM可来源于罗氏沼虾代谢或者死亡后分解所致;其次,养殖过程中使用投入品可能带入SEM,包括杀菌剂、水质改良剂和非呋喃西林药品等;再次,用作虾塘增肥原料的畜禽粪便可能有SEM残留(Islam, 2014)。
值得注意的是,鲫鱼作为混养水产品,在鱼肉、肝和籽中均未检出SEM。相关研究表明,鱼、虾等使用呋喃西林后,会快速代谢产生SEM,在60~90 d消除至检出限以下(李东利等, 2015; 刘书贵等, 2013; 刘永涛等, 2013; 赵东豪等, 2012)。SEM在底泥中消除更加缓慢(索纹纹等, 2013),当底泥中SEM稍高于检出限浓度时,鱼不会对SEM明显富集。此外,野生罗氏沼虾的肉中也能测出痕量的SEM (Islam, 2014),说明罗氏沼虾很可能自然产生SEM。
2.7 罗氏沼虾内源性SEM对呋喃西林残留检测的影响
罗氏沼虾体内可自然产生SEM,且其化学结构、理化性质等与使用呋喃西林代谢后产生的SEM完全相同。仅依靠化学手段,目前,还难以区分罗氏沼虾体内SEM的内源性与外源性。按现行的标准方法测定,易造成未使用呋喃西林却被判定SEM不合格的情形。结合该研究的调查结果,商品规格罗氏沼虾肌肉中内源性SEM的本底含量为(1.83±0.24)μg/kg,可在进行呋喃西林的残留检测时,考虑SEM的本底含量因素,将判定限提高至5.00 μg/kg,以避免误判。但该研究涉及的样品数量和代表性均有限,研究结果尚需更多的实验数据进行验证。
3 结论
该研究优化了农业部783号公告-1-2006检测方法,使之适合罗氏沼虾多种组织的SEM检测,调查了未使用呋喃西林的罗氏沼虾不同组织中SEM的含量。所有样品均检出SEM,其中,复眼中含量最高,而肌肉中含量最低,罗氏沼虾体内可自然产生SEM。通过调查罗氏沼虾不同组织中SEM的本底含量,研究其分布特征,在进行呋喃西林的残留检测时,考虑减去SEM的本底含量因素,避免误判情形的发生。
CALLE M, ANKLAM E. Semicarbazide: Occurrence in food products and state-of-the-art in analytical methods used for its determination. Analytical and Bioanalytical Chemistry, 2005, 382(4): 968–977
CHEN Z L. Veterinary pharmacology (2). Beijing: China Agriculture Press, 2002, 314 [陈杖榴. 兽医药理学(2). 北京: 中国农业出版社, 2002, 314]
DU J, ZHANG J F, ZHENG Z F,. Changes in the ultrastructure of the carapace during the molt cycle of. Journal of Fishery Sciences of China, 2018, 25(2): 301–307 [杜娟, 张俊芳, 郑征帆, 等. 日本沼虾蜕皮过程中头胸甲外骨骼超微结构的改变. 中国水产科学, 2018, 25(2): 301–307]
DU N N, CHEN M M, SHENG L Q,. Determination of nitrofuran metabolites in shrimp by high performance liquid chromatography with fluorescence detection and liquid chromatography-tandem mass spectrometry using a new derivatization reagent. Journal of Chromatography A, 2014, 1327: 90–96
ISLAM M J, LISA A A, REZA A H M M,. Source identification and entry pathways of banned antibiotics nitrofuran and chloramphenicol in shrimp value chain of Bangladesh. Eurasian Journal of Biosciences, 2014(8): 71– 83
KWON J K. Semicarbazide: Natural occurrence and uncertain evidence of its formation from food processing. Food Control, 2017, 72: 268–275
LI D L, LI J, CHANG Z Q,. The elimination rules of nitrofurazone metabolites and its effects on activities of metabolic enzymes in. Progress in Fishery Sciences, 2015, 36(5): 87–94 [李东利, 李健, 常志强, 等. 呋喃西林代谢产物在中国对虾()体内的消除规律及其对代谢酶活性的影响. 渔业科学进展, 2015, 36(5): 87–94]
LI J, LIU J, ZHANG H C,. Broad specificity indirect competitive immunoassay for determination of nitrofurans in animal feeds. Analytica Chimica Acts, 2010, 678(1): 1–6
LI Z H, LI Z M, XU D K. Simultaneous detection of four nitrofuran metabolites in honey by using a visualized microarray screen assay. Food Chemistry, 2017, 221: 1813– 1821
LIU S G, WU S H, ZHENG G M,. Studies on the residue and degradation rules of nitrofurazone metabolites in hybrid snakehead [(♀)×(♂)]. Journal of South China Agricultural University, 2013, 34(2): 2481–253 [刘书贵, 吴仕辉, 郑光明, 等. 呋喃西林代谢物在杂交鳢(斑鳢♀×乌鳢♂)体内的残留消除规律研究. 华南农业大学学报, 2013, 34(2): 248–253]
LIU Y T, AI X H, SUO W W,. Tissue distribution and elimination rules of the metabolite of nitrofuranzone SEM residues in channel catfish () cultured in cage. Journal of Fujian Agriculture and Forestry University (Natural Sciences), 2013, 42(1): 72–76 [刘永涛, 艾晓辉, 索纹纹, 等. 网箱养殖条件下呋喃西林代谢物SEM在斑点叉尾鮰体内组织分布及消除规律研究. 福建农林大学学报(自然科学版), 2013, 42(1): 72–76]
MCCRACKEN R, HANNA B, ENNIS D,. The occurrence of semicarbazide in the meat and shell of Bangladeshi fresh-water shrimp. Food Chemistry, 2013, 136(3/4): 1562– 1567
PARK M S, KIM K T, KANG J S. Development of an analytical method for detecting nitrofurans in bee pollen by liquid chromatography-electrospray ionization tandem mass spectrometry. Journal of Chromatography B, 2017, 1046: 172–176
SHENDY A H, AL-GHOBASHY M A, GAD ALLA S A,. Development and validation of a modified QuEChERS protocol coupled to LC-MS/MS for simultaneous determination of multi-class antibiotic residues in honey. Food Chemistry, 2016, 190: 982–989
SUO W W, LIU Y T, AI X H,. Elimination rules of the semicarbazide in environment and assessment of semicarbazide in the channel catfish () tissue. Journal of Agro-Environment Science, 2013, 32(4): 681–688 [索纹纹, 刘永涛, 艾晓辉, 等. 环境中氨基脲消解规律及对斑点叉尾鮰残留评估. 农业环境科学学报, 2013, 32(4): 681–688]
TANG T, WEI F D, WANG X,. Determination of semicarbazide in fish by molecularly imprinted stir bar sorptive extraction coupled with high performance liquid chromatography. Journal of Chromatography B, 2018, 1076: 8–14
TIAN X H, XU Y J, SONG X K,. Temporal and spatial distribution of semicarbazide in western Laizhou Bay. Marine Pollution Bulletin, 2016, 112(1/2): 393–398
VAN POUCKE C, DETAVERNIER C, WILLE M,. Investigation into the possible natural occurence of semicarbazide inprawns. Journal of Agricultural and Food Chemistry, 2011, 59(5): 2107–2112
WANG D N, ZHOU F, LI S Y,. Background value survey and source analysis of semicarbazide in shellfish. Chinese Fishery Quality and Standards, 2016, 6(6): 6–11 [王鼎南, 周凡, 李诗言, 等. 甲壳类水产品中呋喃西林代谢物氨基脲的本底调查及来源分析. 中国渔业质量与标准, 2016, 6(6): 6–11]
WANG K X. Principle and technology of shrimp healthy culture. Beijing: Science Press, 2002, 447 [王克行. 虾类健康养殖原理与技术. 北京: 科学出版社, 2002, 447]
WANG Q, WANG X F, JIANG Y Y,. Determination of 5-nitro-2-furaldehyde as marker residue for nitrofurazone treatment in farmed shrimps and with addressing the use of a novel internal standard. Scientific Reports, 2019, 9(1): 19243
WANG Q, WANG X F, ZHAO D H,. Determination of four nitrofurans in water and sediment using ultra performance liquid chromatography. Food Science, 2016, 37(16): 249–253 [王强, 王旭峰, 赵东豪, 等. 超高效液相色谱法测定水体和沉积物中4种硝基呋喃类抗生素. 食品科学, 2016, 37(16): 249–253]
YU H J, LI B, CAI Y Q,. Determination of semicarbazide content in crustaceans by liquid chromatography tandem mass spectrometry. Chinese Journal of Analytical Chemistry, 2012, 40(10): 1530–1535 [于慧娟, 李冰, 蔡友琼, 等. 液相色谱-串联质谱法测定甲壳类水产品中氨基脲的含量. 分析化学, 2012, 40(10): 1530–1535]
ZHANG Y B, QIAO H O, CHEN C,. Determination of nitrofurans metabolites residues in aquatic products by ultra-performance liquid chromatography-tandem mass spectrometry. Food Chemistry, 2016, 192: 612–617
ZHAO D H, LI Z G, LI L D,. Assessment of nitrofurazone and furazolidone residues in shrimp seedling. South China Fisheries Science, 2012, 8(3): 54–58 [赵东豪, 黎智广, 李刘冬, 等. 虾苗使用呋喃西林和呋喃唑酮的残留评估. 南方水产科学, 2012, 8(3): 54–58]
ZHAO D H, WANG X F, WANG Q,. Influence of solvent on nitrofuran metabolites response by liquid chromatography- tandem mass spectrometry. South China Fisheries Science, 2016, 12(6): 108–114 [赵东豪, 王旭峰, 王强, 等. 液相色谱串联电喷雾质谱检测中溶剂对硝基呋喃类代谢物响应的影响. 南方水产科学, 2016, 12(6): 108–114]
Distribution Characteristics of Semicarbazone in Adult
MO Mengsong1,2, CAI Nan2, LI Laihao2①, WANG Xufeng2, WANG Qiang2, GUAN Wanqi2, ZHAO Donghao2①
(1. School of Food and Pharmacy of Zhejiang Ocean University, Zhoushan, Zhejiang 316022, China; 2. South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Aquatic Products Processing, Ministry of Agriculture and Rural Affairs, Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, Guangzhou, Guangdong 510300, China)
Asthe most stable metabolite of nitrofurazone (NFZ), semicarbazide (SEM) can be determined after the administration of NFZ in aquatic animals within a few hours. Because of extensive tissue distribution and a long residual period, SEM is used as the exclusive marker for NFZ. However, SEM is naturally present in the shells of crustaceans, such as crayfish, shrimp, prawns, and soft-shell crabs. To avoid false-positive results induced by SEM alone and to precisely identify the illegal use of NFZ, further investigations on the distribution characteristics of SEM in crustaceans is essential. In the present study, samples of shell, muscle, muscle epidermis, internal organs, and compound eye were collected fromshrimp farms that were not exposed to nitrofural, and SEM was determined in order to investigate the background concentrations in different tissues of the commercial shrimp. Samples were evaluated in accordance with Announcement No.783-1-2006 of the Ministry of Agriculture of the People’s Republic of China. As multiple tissue samples, including compound eye, outer shell, limbs, feet, intestine, gill, muscle epidermis, liver, gonad, and muscle were assessed, the method was suitable for monitoring the background concentration of SEM in different tissues of. The average concentration of SEM across all tissues was (12.90±2.47) μg/kg. The average concentrations of SEM in compound eyes, shells, and limbs were (33.29±3.06), (29.00±5.67), and (28.10±7.08) μg/kg, respectively. The lowest concentration of SEM was found in muscle samples, with an average value of (1.83±0.24) μg/kg. The concentration of SEM in commercialtissues could be ordered as compound eye > outer shell > limbs and feet > intestine > gill > muscle epidermis > liver > gonad > muscle. Considering that it was difficult to distinguish the source of SEM in, the background concentration of SEM should be deducted when determining NFZ residues in this species
; Semicarbazide; Nitrofurazone; Distribution characteristics
O657.63
A
2095-9869(2022)03-0103-07
10.19663/j.issn2095-9869.20210322001
http://www.yykxjz.cn/
莫梦松, 蔡楠, 李来好, 王旭峰, 王强, 关婉琪, 赵东豪. 罗氏沼虾成虾中氨基脲的分布特征. 渔业科学进展, 2022, 43(3): 103–109
MO M S, CAI N, LI L H, WANG X F, WANG Q, GUAN W Q, ZHAO D H. Distribution characteristics of semicarbazone in adult. Progress in Fishery Sciences, 2022, 43(3): 103–109
LI Laihao, E-mail: laihaoli@163.com; ZHAO Donghao, E-mail: donghaozhao@126.com
* 中国水产科学研究院南海水产研究所中央级公益性科研院所基本科研业务费专项资金(2021SD20)和广州市科技计划项目(201904010391)共同资助 [This work was supported by Central Public-Interest Scientific Institution Basal Research Fund, South China Sea Fisheries Research Institute, CAFS (2021SD20), and the Guangzhou Science and Technology Project (201904010391)]. 莫梦松,E-mail: 1297260525@qq.com
李来好,研究员,E-mail: laihaoli@163.com;赵东豪,副研究员,E-mail: donghaozhao@126.com
2021-03-22,
2021-04-28
(编辑 冯小花)

