响应面法优化软枣猕猴桃茎黄酮提取工艺
张雨欣,陈 罡,李怀业,祝儒刚,刘怡菲,鞠文鹏
(1.辽宁大学 轻型产业学院,辽宁 沈阳 110036;2.辽宁省林业科学研究院,辽宁 沈阳 110032;3.辽宁白石砬子森林生态系统国家定位观测研究站,辽宁 丹东 118201;4.清原满族自治县自然资源局,辽宁 抚顺 113300;5.抚顺市林业发展服务中心,辽宁 抚顺 113009)
软枣猕猴桃Actinidia arguta为猕猴桃科,猕猴桃属多年生落叶攀缘藤本植物[1],软枣猕猴桃果实一般为圆形或椭圆形,成熟时颜色为黄绿色。其果实鲜嫩多汁,香甜可口,营养丰富[2],含有多种活性成分,如多糖、黄酮、维生素、生物碱、三萜类等[3-4]。研究表明,黄酮具有多种生理功能,有抗氧化、抗病毒、抗肿瘤、降血糖等功效[5-9]。目前,研究人员主要利用软枣猕猴桃果实来提取软枣猕猴桃黄酮[10],而对从其他部位中提取软枣猕猴桃黄酮的报道较少。在软枣猕猴桃生长过程中会不断产生且修剪大量的茎[11],这些茎常作为繁育材料用于组培、扦插及嫁接等,或在树体修剪后通过焚烧、丢弃等方式进行处理,造成资源的浪费及环境污染。为充分利用软枣猕猴桃树体资源,提高其附加值,本研究以软枣猕猴桃茎为材料,利用超声辅助提取方法对茎中的黄酮进行提取并优化,以最大限度得到软枣猕猴桃黄酮,为今后进一步研究软枣猕猴桃黄酮效用及深加工奠定工作基础。
1 材料与方法
1.1 材料与试剂
软枣猕猴桃茎取自辽宁省林业科学研究院新宾县永陵镇软枣猕猴桃种植基地,取样时剪取木质化的茎段部分。芦丁标准品购于上海源叶生物科技有限公司。实验用试剂无水乙醇、石油醚、NaOH、NaNO2、Al(NO3)3均为分析纯。其中,无水乙醇购自沈阳市苏家屯区辽河化工厂;石油醚购自天津市北辰方正试剂厂;NaNO2、Al(NO3)3、NaOH均为分析纯,购自国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 软枣猕猴桃茎黄酮类化合物的提取工艺
取新鲜软枣猕猴桃茎,擦净后剪碎,置于50 ℃烘箱中烘24 h 后取出,用粉碎机粉碎后过30 目筛,得到软枣猕猴桃茎粉末。之后用石油醚[12]抽提12~15 h 以去除粉末中的色素及脂溶性物质,将脱色完全的粉末再次烘干备用。称取其粉末2 g 于烧杯中,加入80% 乙醇溶液,并置入超声清洗机内进行提取处理(280 W、60 ℃、6 min),而后60 ℃水浴2 h。将浸提后的提取液以10 000 r·min-1离心15 min,取上清液后抽滤,得到完全澄清的黄酮粗提液,将黄酮粗提液定容至100 mL 容量瓶中,取1 mL 进行黄酮含量的测定。
1.2.2 芦丁标准曲线的绘制
黄酮含量测定方法为Al(NO3)3-NaNO2显色法[10]。用80% 乙醇配置0.2 mg·mL-1的芦丁标准液。依次取芦丁溶液0、0.4、0.8、1.2、1.6、2.0、2.4 mL于7 个10 mL 比色管中,加入5% NaNO20.2 mL并静置6 min,再加入10%Al(NO3)30.2 mL 并静置6 min,最后加入4% 氢氧化钠2.0 mL,加入蒸馏水稀释至10 mL,15 min 后于波长510 nm 测定吸光度。
1.2.3 软枣猕猴桃茎黄酮类化合物含量的测定
取1.0 mL 软枣猕猴桃茎黄酮提取液于比色管中,依据标准曲线绘制的方法测定其中黄酮含量,代入标准方程,并依据下式求得茎黄酮的提取率。
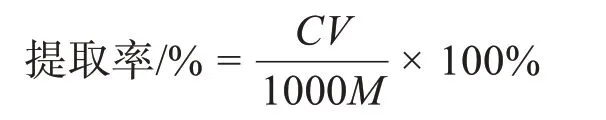
式中:C为软枣猕猴桃茎总黄酮的质量浓度(mg·mL-1);M为软枣猕猴桃茎粉末的质量(g);V为黄酮粗提液体积(mL)。
1.2.4 超声波辅助提取茎黄酮的单因素试验
取新鲜软枣猕猴桃茎粉末2.0 g 于烧杯中,研究不同乙醇体积分数(40%、50%、60%、70%、80%、90%),不同液料比(15、25、35、45、55、65 mL·g-1),不同超声时间(2 min、6 min、10 min、14 min、18 min),不同超声温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃),不同超声功率(200 W、240 W、280 W、320 W、360 W、400 W)对茎黄酮提取率的影响。
1.2.5 响应面试验
为了进一步确定最佳提取条件,根据单因素试验结果,选取其中3 个因素(超声温度、乙醇体积分数和液料比)进行响应面试验,具体见表1。

表1 响应面分析因素及水平
1.2.6 数据处理
使用Design-Expert 10.0 进行响应面优化试验,试验结果用Excel 2019 进行数据处理并绘图。
2 结果与分析
2.1 芦丁标准曲线的绘制
所得标准曲线如图1,回归方程为y=1.0393x-0.0043,R2=0.999 2。

图1 芦丁标准曲线
2.2 软枣猕猴桃茎黄酮提取的单因素试验
2.2.1 超声时间对提取率的影响
由图2 可知,当超声时间少于6 min,黄酮不能完全提取出来,原因可能是时间过短,黄酮尚未全部溶出,超声作用即停止;当提取时间超过6 min,提取率降低,可能是时间过长溶出的黄酮又发生分解,故将提取时间控制在6 min 为宜。

图2 超声时间对提取率的影响
2.2.2 超声温度对提取率的影响
由图3 可知,超声温度小于60 ℃时,提取率与超声温度呈现正相关。温度升高,分子间热运动越快,导致物质交换加快,黄酮溶出增加;温度超过60 ℃,高温耐受性较差的黄酮类物质出现分解,提取率下降;当温度为60 ℃时,提取率最高。

图3 超声温度对提取率的影响
2.2.3 乙醇体积分数对提取率的影响
乙醇体积分数对提取率的影响见图4。

图4 乙醇体积分数对提取率的影响
由图4 可见,随着乙醇体积分数的增加,茎黄酮类化合物的提取率表现为先升高后降低的趋势。当乙醇质量分数为50% 时,提取率最高。由此可见,过高或过低体积分数的乙醇溶液都不利于黄酮的提取。
2.2.4 液料比对提取率的影响
由图5 可知,软枣猕猴桃茎黄酮类化合物提取率表现出先升高后降低的趋势,这可能是当液料比较低时,现有体积的溶剂不能将原料中的黄酮完全提取出来;当液料比达到55 mL·g-1时,茎中的黄酮类物质提取较完全,提取率最大。

图5 液料比对提取率的影响
2.2.5 超声功率对提取率的影响
由图6 可知,软枣猕猴桃茎黄酮提取率随超声功率的增加表现不稳定,过低和过高的功率都不能最大程度提取黄酮。故选择240 W 作为软枣猕猴桃茎黄酮的提取功率。

图6 超声功率对提取率的影响
2.3 响应面法优化试验
2.3.1 回归方程的建立与显著性
采用Design-Expert 10.0 软件对表2 中试验结果归纳分析,得到超声温度(A)、乙醇体积分数(B)、液料比(C)的回归方程为:Y=5.83+0.015A+0.18B+1.250E-003C-0.18AB-0.10AC-0.16BC-0.15A2-0.28B2-0.16C2。

表2 响应面分析方案及试验结果
由表3 可知,该模型差异高度显著(P<0.01),失拟项差异不显著(P>0.05),说明本试验能够较好地反映实际情况;相关系数R2=0.961 7,说明模型拟合程度比较好,可用于软枣猕猴桃茎总黄酮提取工艺的优化。
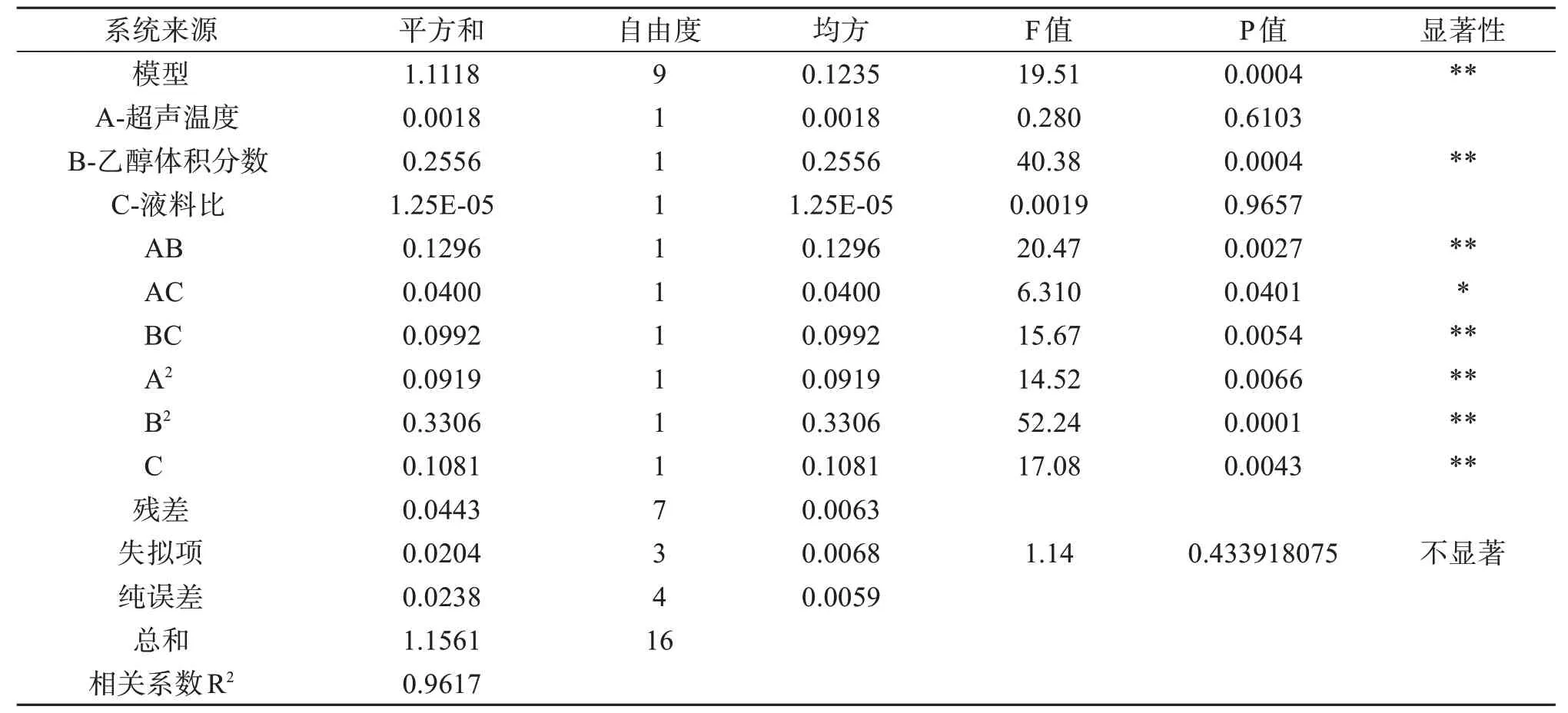
表3 回归统计分析
2.3.2 响应面交互作用图
图7 为响应面各因素交互作用图,三图均有最高点,说明在试验限度内均可找到一个值使得提取率达到最大。从图7 可以观察到,响应曲面图形均成凸形,表明每两个因素之间的交互作用显著。
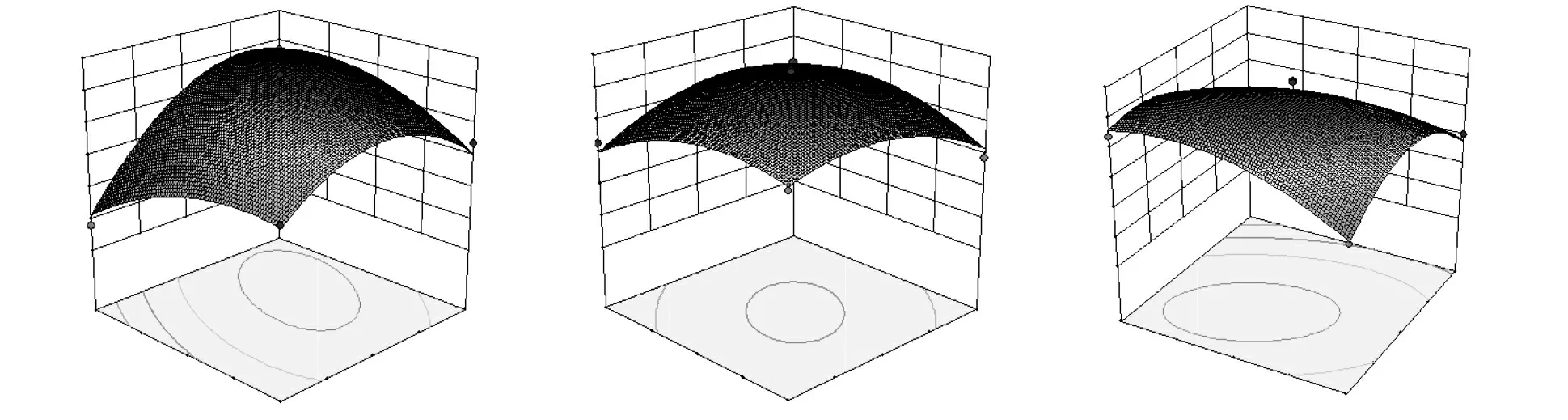
图7 两因素交互作用响应面
2.3.3 最佳工艺条件的确定
由以上响应面分析可知,软枣猕猴桃茎黄酮提取率存在最大值,结合软件分析结果及相应调整后,最终得到最佳提取条件,即超声温度为70 ℃、乙醇体积分数为50%、液料比为65 mL·g-1时,黄酮提取率最高,为5.713%,该结果与软件预测值非常接近,证明了该模型的有效性。
3 结 论
以往常用软枣猕猴桃果实来提取黄酮等有效成分,不仅提取成本较高,而且提取量有限。已有研究表明,软枣猕猴桃枝条中含有多种有效成分[13-16],本研究以软枣猕猴桃茎为原料进行黄酮提取,其预处理简单、操作方便,材料充足、提取成本低,且从试验结果来看与从果实中提取黄酮的含量相差不大,因此,从软枣猕猴桃茎中提取黄酮是一种新途径。本研究根据单因素试验结果选取其中3个因素进行响应面试验,得到最佳工艺为:超声功率240 W、超声时间6 min、超声温度70 ℃、乙醇体积分数50%、液料比65 mL·g-1,该条件下软枣猕猴桃茎中黄酮的提取率最大。本研究为提高软枣猕猴桃茎利用率以及今后进一步研究软枣猕猴桃黄酮性质和效用奠定理论基础。

