甜橙ERF B3亚组转录因子的鉴定和表达分析*
李 玲,刘新军,张保莲,张斯羽,欧阳智刚,†
(1. 赣南师范大学 生命科学学院;2. 国家脐橙工程技术研究中心,江西 赣州 341000)
植物在生长发育过程中一直遭受干旱、高盐、低温及病虫害等各种生物和非生物胁迫的影响[1].在长期的协同进化中,植物形成了一个复杂、有效的信号传导网络,以抵抗外界不利环境[2].转录因子作为反式作用元件,通过与靶标基因上游的顺式作用元件特异性结合来调节基因表达,以转录水平的调控方式来精确地应答胁迫反应[3].近年来研究显示AP2/ERF(APETALA 2/ethylene-responsive element bindingfactor)、bZIP(Basic-domain leucine-zipper)、WRKY、MYB、NAC(NAM、ATAF1/2 和CUC2)、bHLH(Basic helix-loop-helix)、NF-Y(Nuclear Factor Y)和CAMTA (CaM-binding transcription activator)等转录因子参与了调控植物多种逆境胁迫反应[4-11].其中AP2/ERF转录因子是最大的家族之一.
AP2/ERF转录因子编码的蛋白含有高度保守的AP2结构域.AP2结构域包含58个或59个氨基酸,与靶标DNA序列具有高亲和力.根据AP2结构域的数量和特征,AP2/ERF家族可分为四个亚家族,包括AP2(APETALA2)、RAV(related to ABI3/VP1)、REB(脱水反应性元素结合蛋白, dehydration-responsive element binding protein)和ERF(乙烯反应因子, ethylene-responsive factor)[12].AP2家族含2个AP2/EREBP结构域,ERF和DREB家族仅含1个AP2/EREBP结构域,这两个家族均又进一步细分为6或7个亚组 (A1-A6;B1-B6或-B7).RAV家族除含有一个AP2/EREBP结构域外,还包含1个B3结构域[13-14].ERF家族是AP2/ERF转录因子大家族中的一个主要亚家族,ERF蛋白可以与许多乙烯调节的防御基因启动子区域GCC框(AGCCGCC)的顺式元件特异性结合,起转录激活因子或阻遏物的作用[15].ERF转录因子广泛分布于植物中,Nakano等(2006)在拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)基因组中分别鉴定了65和77个ERF转录因子[16-17].最近几年随着多种植物基因组测序完成,相继在凤梨(Ananascomosus)、芹菜(Apiumgraveolens)、二穗短柄草(Brachypodiumdistachyon)、甘蓝型油菜(Brassicanapus)、棉花(Gosssypiumraimondii)、苹果(Malus×domestica)、甘蔗(Saccharumspontaneum)、番茄(Solanumlycopersicum)、绿豆(Vignaradiata)、葡萄(Vitisvinifera)和玉米(Zeamays)等中筛选和鉴定了ERF转录因子[18-28].
ERF亚家族不同亚组中的成员具有不同的功能.研究表明ERF B3亚组转录因子在植物防御病菌的反应中发挥重要作用.本文根据ERF B3亚组转录因子的结构特点,在甜橙基因组数据库中筛选和鉴定了21个ERF B3亚组转录因子,进一步分析了甜橙ERF B3亚组转录因子受黄龙病菌和外源激素的诱导表达情况.同时研究了甜橙ERF B3亚组转录因子的亚细胞定位及转录激活活性.本文的研究可以为甜橙ERF B3亚组转录因子的功能分析提供理论参考.
1 材料与方法
1.1 供试材料和前处理
本试验所用柑橘材料为赣南早(CitrussinensisOsbeck cv. Gannanzao)幼苗,均由赣南师范大学国家脐橙工程与技术研究中心提供.激素诱导处理:分别用1 mM SA,100 μMJA,100 μM ABA喷雾处理赣南早幼苗,对照为等量喷无菌水,恒温保湿培养[29].分别于0 h、24 h和48 h后采集样品叶片,-80 ℃下保存.
1.2 植物叶片总RNA提取
将植物叶片置于液氮中磨碎,每0.5 g叶片加入1 mL Trizol,震荡混匀,并室温放置5 min,4 ℃ 10 000 g离心10 min,取上清,每使用1 mL Trizol加入0.2 mL氯仿,剧烈振荡15 s,于室温放置5 min.4 ℃ 10 000 g离心10 min,取上清,重复加入0.2 mL和0.5 mL氯仿萃取2次.离心后把水相转移到新管中,等体积加入异丙醇,于室温放置10 min.4 ℃ 10 000 g离心10 min,弃上清.用75%乙醇洗涤RNA沉淀.每使用1 mL Trizol至少加1 mL 75%乙醇.4 ℃不超过5 000 g离心5 min,弃上清.室温放置干燥5 min,再加入20 μL~30 μL无RNase的水溶解RNA,置于-80 ℃下保存.
1.3 柑橘ERF B3亚组转录因子的系统筛选
从柑橘基因组数据库(https://www.citrusgenomedb.org/)下载甜橙全基因组1.0(ftp://ftp.bioinfo.wsu.edu/www.citrusgenomedb.org/Citrus_sinensis/C.sinensis_Hzau_v1.0_genome/annotation/)蛋白组数据. 利用HMMER 3.1b2软件包中的hmmbuild程序对ERF结构域种子序列(PF04404)建立隐马尔可夫模型,利用hmmsearch程序在甜橙蛋白组数据中进行搜索(E-value<10-3),获得含ERF结构域蛋白. 将挖掘出的所有含ERF结构域蛋白和已报道的893条真核及原核生物中的含ERF结构域蛋白序列一起利用hmmalign程序基于PF04404的隐马尔可夫模型进行多重序列比对,得到比对序列. 利用MEGA7软件打开比对文件,并人工调整. 利用Smart model selection软件对比对序列最适的最大似然法建树模型进行检测. 根据最适建树模型,利用PhyML3.0对比对文件建立系统发生关系,利用外群法确定树根. 系统发生树上,与植物含ERF结构域序列形成单系群的甜橙含ERF结构域序列为甜橙的ERF B3亚组转录因子.
1.4 甜橙ERF B3亚组转录因子亚细胞定位
以甜橙cDNA为模板,根据数据库序列设计引物,特异性扩增目的基因全长序列(引物见附表1),将PCR产物插入瞬时表达载体pGR106中,分别命名为pGR106:CsERF B3-9/10/13/20/21并转入农杆菌GV3101中. 将携带pGR106:CsERF B3-9/10/13/20/21的农杆菌在含有50 mg/L卡那霉素(Kan)、50 mg/L氯霉素(Chol)和25 mg/L庆大霉素(Gen)的YEP平板上划线,放置于28 ℃恒温培养箱内培养2 d,并采用菌落PCR验证转化结果. 按1:50~1:100的比例接种于10 mL含相同抗生素的YEP中,28 ℃、220 rpm培养8 h~12 h扩大培养至OD600=0.8~1.2,4 000 rpm,4 ℃离心10 min收集菌体,弃上清,用含有乙酰丁香酮(50 mmol/L, AS)的侵染液(1 mmol/L MgCl2, 1 mmol/L MES, pH 5.6)悬浮菌体,使其OD600=1.0~1.5,室温放置3 h后,以携带pGR106:GFP载体的GV3101为阴性对照,用不带针头的1 mL针管抵住烟草叶片的背面,注入叶片,48 h后在激光共聚焦显微镜下观察蛋白定位.
1.5 甜橙ERF B3亚组转录因子的转录活性分析
以甜橙cDNA为模板,根据数据库序列设计CsERFB3-9/10/13/20/21引物特异性PCR扩增其全长序列(引物见附表1),将PCR产物酶切插入载体pGBKT7中.将重组质粒和pGBKT7空白载体分别转入酵母菌株YRG-2中.酵母转化方法:用YPDA固体培养基(10 g/L Yeast extract,20 g/L Tpyptone,20 g/L Agar,2% dextrose glucose)培养酵母菌株2 d~3 d后,刮取25 μL酵母菌落悬于1 mL ddH2O中,高速离心5 s后,用1 mL 100 mM LiAc悬浮沉淀;30 ℃水浴中温育5 min,高速离心5 s,弃上清;在沉淀物中按顺序分别加入以下液体:240 μL PEG(50% w/v,重量/体积),36 μL LiAc(1.0 M)、50 μL ssDNA(2.0 mg/mL)、5 μL plasmid DNA(100 ng至5 μg)、20 μL ddH2O;涡旋1 min,42 ℃温育40 min后;12 000 rpm离心10 s,弃去上清,用200 μL~400 μL ddH2O 重悬沉淀,取适量涂于SD/-Trp培养基上,30 ℃培养2 d.挑单菌落分别划线于SD/-Trp/-His培养基上,2 d后观察转录因子活性结果.
1.6 RT-qPCR
按SuperScript III Kit(Invitrogen, 中国上海)方法对提取的RNA进行反转录合成cDNA.根据数据库中的ERF B3亚组转录因子的序列设计RT-qPCR特异性引物(引物见附表1),以基因CitEF1作为内参.每个RT-qPCR反应体系包含12.5 μL SYBR® Premix Ex TaqTM、1 μL正反向引物(10 μmol/L)、1 μL cDNA模板和9.5 μL RNAse-free水.反应程序为94 ℃ 5 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 45 s,34个循环.

图1 甜橙(C. sinensis)、拟南芥(A. thaliana)、番茄(S. lycopersicum)、甘蔗(S. spontaneum)、玉米(Z. mays ssp)和葡萄(V. vinifera)ERF B3亚组转录因子氨基酸序列系统进化树
2 试验结果
2.1 甜橙ERF B3亚组转录因子系统进化分析
本文在柑橘数据库中筛选和鉴定了21个甜橙ERF B3亚组转录因子. 根据染色体上的位置,我们将其分别命名为CsERFB3-1~21(对应的Gene ID分别为:Cs1g03250_1、Cs1g03260_1、Cs1g03270_1、Cs1g03280_1、Cs1g03290_1、Cs1g03300_1、Cs1g03310_1、Cs2g05270_1、Cs2g05280_1、Cs5g08360_1、Cs5g23980_1、Cs5g24010_1、Cs5g29870_1、Cs5g29880_1、Cs5g29890_1、Cs5g29900_1、Cs8g12780_1、Cs9g10680_1、Cs9g13610_1、Cs9g13620_1、Cs9g13630_1).将CsERF B3亚组转录因子蛋白序列与拟南芥、甘蔗、番茄、玉米和葡萄共149个ERF B3亚组转录因子蛋白序列构建亲缘关系进化树(如图1所示).ERF B3亚组转录因子被分为4组,其中第1组中包括12个甜橙、4个拟南芥、5个甘蔗、12个番茄、5个玉米和6个葡萄ERF B3亚组转录因子;第2组包括1个甜橙、1个甘蔗、1个番茄、1个玉米和1个葡萄ERF B3亚组转录因子;第3组分别包括4个甜橙、10个拟南芥、5个甘蔗、11个番茄、2个玉米和20个葡萄ERF B3亚组转录因子;第4组4个甜橙、3个拟南芥、5个番茄、12个甘蔗、10个玉米和14个葡萄ERF B3亚组转录因子.此外我们发现几个甜橙ERF B3亚组转录因子与番茄已报道的具有抗病功能的转录因子聚类关系比较近,比如CsERFB3-10和番茄SlERF.A1、CsERFB3-17和番茄SlERF.C3、CsERFB3-19与CsERFB3-20和SlERF.B4、CsERFB3-21和SlERF.A4以及CsERFB3-13和拟南芥AtERF93/94等.
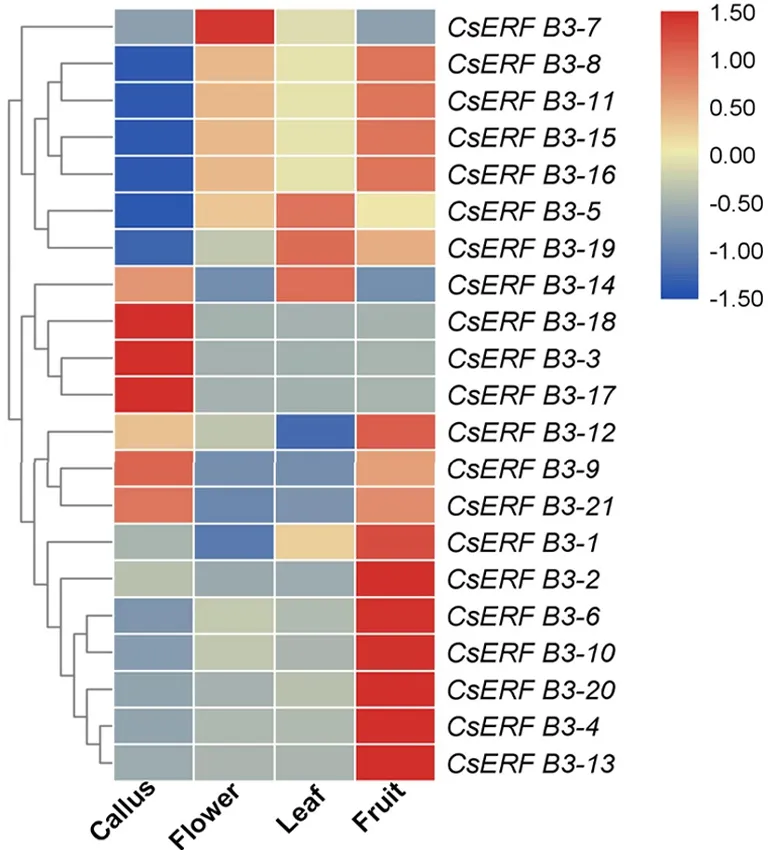
图2 甜橙ERF B3亚组转录因子在不同组织中的表达分析
2.2 甜橙ERF B3亚组转录因子在不同组织中的表达特征
我们在柑橘基因组数据库(http://citrus.hzau.edu.cn/orange/)中下载甜橙ERF B3亚组转录因子在愈伤组织、花、叶和果实中的表达数据进行分析,发现甜橙ERF B3亚组转录因子在不同组织中的表达模式不一样(如图2所示.Callus:愈伤组织;Flower:花;Leaf:叶;Fruit:果实).CsERFB3-3/7/8/11/12/14/15/16/17/18在愈伤组织、花、叶和果实这四个组织中表达均很低.在其余的CsERF B3亚组转录因子中,除了CsERFB3-19之外,其他CsERF B3亚组转录因子均在果实中表达最高,叶片中的表达量次之.
2.3 甜橙ERF B3亚组转录因子在感染黄龙病不同柑橘品种的表达特征
甜橙ERF B3亚组转录因子对黄龙病菌有着不同的响应,相同基因在不同的品种中也存在差异表达.我们根据不同品种感染黄龙病的转录组数据[30],分析了柑橘ERF B3亚组转录因子在道县野橘(C.daoxianensis)、宜昌橙(C.ichangensis)和甜橙中应答黄龙病侵染的表达特征(如图3所示.FPKM.CD-HLB:道县野橘黄龙病患病植株FPKM值;FPKM.CD-MOCK:健康道县野橘FPKM值;FPKM.CI-HLB:宜昌橙黄龙病患病植株FPKM值;FPKM.CD-MOCK:健康宜昌橙FPKM值;FPKM.CS_HLB:甜橙黄龙病患病植株FPKM值;FPKM.CD_MOCK:健康甜橙FPKM值).
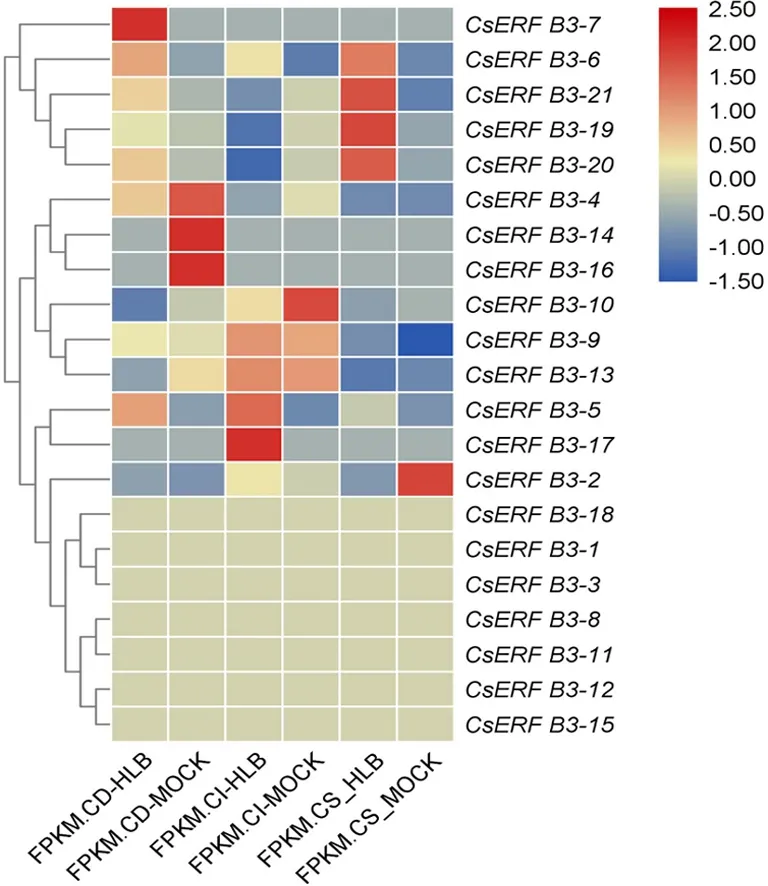
图3 甜橙ERF B3亚组转录因子受HLB病原菌诱导的表达分析
该转录组数据显示,CsERFB3-1/2/3/7/8/11/12/14/15/16/17/18这12个基因的表达丰度在3个品种中表达都非常低,FPKM (Fragments Per Kilobase Million)值大部分为0或接近于0,这与柑橘基因组数据库中的表达情况相似(图2).在道县野橘中,CsERFB3-2/5/6/21这四个基因在感染黄龙病后上调表达显著,相反CsERFB3-10和CsERFB3-13两个基因下调表达显著;在宜昌橙中,CsERFB3-5和B3-6两个基因是上调表达,CsERFB3-19/20/21为下调表达;在甜橙中,CsERFB3-5/6/9/19/20/21六个基因显著上调表达,只有CsERFB3-1一个基因下调表达.同时还发现CsERFB3-5和B3-6这两个基因在3个品种中均呈上调表达,但CsERFB3-21在道县野橘和甜橙中上调表达显著,而在宜昌橙中则为下调表达显著.
2.4 激素诱导ERF B3亚组转录因子的表达特征
根据柑橘感染黄龙病菌的转录组数据,我们挑选了表达相对较高的CsERF B3亚组转录因子(CsERFB3-4/5/6/9/10/13/19/20/21)进行外源激素诱导表达分析(如图4所示).通过荧光定量PCR技术分析激素处理后甜橙ERF B3亚组转录因子表达情况,结果显示CsERFB3-9/10/13/20/21基因在12 h和24 h两个时间点受SA诱导上调表达显著,而CsERFB3-4显著下调表达.受JA诱导12 h或/和24 h后CsERFB3-10/13/20/21四个基因显著上调表达,同样CsERFB3-4基因下调表达显著.ABA诱导对CsERF B3亚组转录因子的表达影响较小,只有在24 h时,CsERFB3-4和CsERFB3-21分别下调和上调表达显著.另外CsERFB3-5/6/19这三个基因在3种激素诱导下表达均无差异.

图4 甜橙ERF B3亚组转录因子受激素诱导的表达分析
2.5 甜橙ERF B3亚组转录因子亚细胞定位
为了明确甜橙ERF B3亚组转录因子的亚细胞定位,根据ERF B3亚组转录因子应答黄龙病病原菌的表达情况,我们挑选了CsERFB3-9/10/13/20/21五个转录因子进行亚细胞定位研究.结果显示:在对照组中,本氏烟细胞核和细胞膜上均可观察到GFP信号,而CsERF B3-9/10/13/20/21-GFP融合蛋白则只定位在细胞核上(如图5所示),表明CsERF B3-9/10/13/20/21-GFP为核定位蛋白.
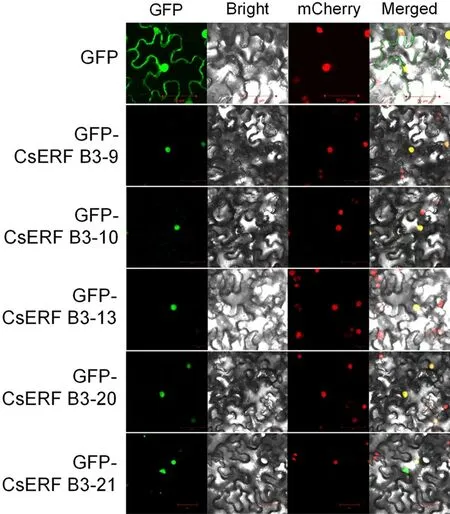
图5 甜橙ERF B3亚组转录因子亚细胞定位

图6 甜橙ERF B3亚组转录因子 转录激活活性检测
2.6 甜橙ERF B3亚组转录因子转录活性分析
在携带对照载体pGBKT7的酵母细胞中,载体上酵母转录激活因子GAL4 DNA结合域(DNA binding domain, BD)可以和上游激活序列结合,但不能引起报告基因LacZ转录.如将一段具有转录激活活性的转录因子构建到pGBKT7载体上,其表达产生的BD与上游激活序列结合,同时引起下游报告基因LacZ的转录,进而水解培养基上的x-α-Gal,使菌落产生蓝斑.利用这一原理,我们对CsERFB3-9/10/13/20/21进行了转录活性验证.结果表明(如图6所示),携带pGBKT7:CsERF B3-9/10/13/20/21的酵母均能在双缺培养基SD/-Trp/-His上正常生长,并且双缺培养基中加入x-α-gal 后显示蓝色反应,说明CsERFB3-9/10/13/20/21均具有转录激活活性.
3 讨论
ERF转录因子是植物AP2/ERF转录因子家族中最大的亚家族之一,根据其结构特点又进一步分为6~7个亚组(B1~B7)不等,比如在拟南芥、水稻、番茄、葡萄和玉米等植物中分为6个亚组[16-17,25,27-28],而在二穗短柄草和棉花等植物中则分为7个亚组[20,22].在ERF亚家族中,ERF B3亚组成员相对较多.比如在小麦中有22个,在拟南芥中有18个,葡萄有37个[16,27-28].本文在柑橘基因组数据库中筛选鉴定了21个ERF B3亚组成员.我们进一步对植物ERF B3亚组转录因子进行了聚类分析,发现甜橙ERF B3亚组转录因子与番茄和拟南芥中已报道的具有抗病功能的转录因子聚类关系比较近,比如CsERFB3-10和番茄SlERF.A1、CsERFB3-17和番茄SlERF.C3、CsERFB3-19与CsERFB3-20和SlERF.B4、CsERFB3-21和SlERF.A4以及CsERFB3-13和拟南芥AtERF93/94等.聚类关系较近的基因在功能上具有相似性,我们推测与报道的具有抗病功能的转录因子聚类关系较近的甜橙CsERF B3亚组转录因子可能在抗病反应中也发挥作用.
植物ERF蛋白可以作为转录激活物或抑制因子发挥作用[31].顺式作用元件GCC盒是ERF转录因子的主要靶位点,ERF转录因子能结合启动子中GCC盒调控靶标基因的表达.研究表明拟南芥AtERF15(AtERF93)、TERF1、番茄SlERF.A1、SlERF.B4和SlERF.C3在酵母细胞中均具有转录激活活性[29,32-33].此外拟南芥ERF1和ORA59可以和JA/ET响应的病原相关基因PDF1.2和b-CHI上的CGG box结合来诱导其表达[34-35].本文中,CsERFB3-9/10/13/20/21等5个甜橙ERF B3亚组转录因子也均有转录激活作用,并且位于细胞核内,因此我们推测该5个甜橙ERF B3亚组转录因子也具有诱导含有CGG box基因表达的能力.
植物激素水杨酸、茉莉酸和乙烯在抗生物胁迫信号转导途径的调节中起主要作用.这种调节是通过连接不同途径的复杂调节网络来实现的,从而使每个途径根据需要协助或拮抗其他途径来微调对单个病原体的防御反应.一般认为SA在激活对活体营养性病原菌的防御中起主要作用,而JA和ET则对坏死性病原菌攻击的防御相关,此外SA抗病信号途径和JA/ET抗病信号途径间存在相互拮抗的关系.比如SA可以通过下调ORA59的表达拟制JA应答相关基因的表达.EFR B3亚组转录因子能通过依赖SA和/或JA途径激活植物对病原菌的抵抗力.研究表明GbERFb、GmERF113、拟南芥ERF1(AtERF92)、AtERF15(AtERF93)、ORA59(AtERF94)、ATERF14(AtERF97)、NbERF173、番茄SlERF.A1、SlERF.B4、SlERF.C3、ZmERF105、小麦TaERF3和TaAP2-155等EFR B3亚组转录因子参与了植物对病原菌的防御反应[29,33,35-36].反过来ERF B3亚组转录因子受病原菌诱导存在差异表达,例如SlERF.A1、SlERF.B4和SlERF.C3受病原菌的诱导上调表达显著[29].本文CsERFB3-9/10/13/20/21被SA和/或JA诱导表达,同时也受黄龙病菌的诱导上调表达显著.我们推测这5个ERF B3亚组转录因子可能通过依赖SA和JA信号传导途径正调控甜橙对黄龙病菌的抗性反应.然而要证明这些推测,还需要通过进一步的实验验证,比如通过过表达或基因沉默来验证基因功能.

