QuEChERS技术结合高效液相色谱-串联质谱法测定鱼肉中6种替考拉宁残留量
金 慧,赵 城,郑光明,魏琳婷,史晓娜,林嘉薇,李丽春,单 奇,马丽莎,尹 怡*
(1.上海海洋大学 食品学院,上海 201306;2.中国水产科学研究院 珠江水产研究所/农业农村部水产品质量安全风险评估实验室(广州)/广东省水产动物免疫技术重点实验室,广东 广州 510380)
替考拉宁(Teicoplanins)是一种从游离放线菌Actinoplanes teichomyceticus 中分离出的新型糖肽类抗生素[1]。它由替考拉宁A2-1(TA2-1)、替考拉宁A2-2(TA2-2)、替考拉宁A2-3(TA2-3)、替考拉宁A2-4(TA2-4)、替考拉宁A2-5(TA2-5)、替考拉宁A3-1(TA3-1)6 种结构相似但抑菌活性不同的成分组成[2],对革兰氏阳性需氧菌和厌氧菌具有良好的抗菌活性[3]。1975年,第一代糖肽类抗生素阿伏霉素在英国、挪威等一些国家作为食品动物的饲料添加剂,用于疾病治疗与促生长[4],但引起了耐药性细菌的产生与大范围传播[5]。随后,另一种糖肽类抗生素——万古霉素被用在食品动物的养殖中并加重了细菌耐药性问题[6],替考拉宁则是继万古霉素之后的新型糖肽类抗生素。在水产养殖中违规使用、甚至滥用糖肽类抗生素,均会对我国水产品出口贸易及消费者身体健康产生不利影响。为确保食品安全和人类健康,许多国家制定了糖肽类抗生素的限量标准。日本规定了食品动物中万古霉素的限量为10 μg/kg[7],我国2020年发布的农业农村部250公告也将万古霉素列为水产品等食品动物中的禁用药[8],欧盟规定食品动物中禁止使用阿伏霉素和万古霉素[9],而美国规定进口动物源性食品中禁止使用替考拉宁等糖肽类抗生素[10]。Yin 等[11]在我国珠江及沿海流域的水环境中检出痕量替考拉宁,表明水产鱼类面临潜在的安全风险。因此,需要建立一种准确高效的检测方法用于分析鱼肉中替考拉宁的残留水平及其风险。
替考拉宁分子量大、结构复杂、组成成分多且相似,实现其在复杂基质中的高效、灵敏检测存在困难。常见测定替考拉宁的分析方法有荧光偏振免疫分析法(FPIA)[12-13]、高效液相色谱法(HPLC)[14-15]、高效液相色谱-串联质谱法(HPLC-MS/MS)[16-18]等。其中,FPIA 法测定替考拉宁易产生假阳性结果,准确度低。HPLC法难以进行替考拉宁多组分的区分测定,且分析时间长、灵敏度低。LC-MS/MS法可通过特定的母离子和子离子实现替考拉宁多组分的准确识别及高灵敏检测[19-20]。由于水产品中富含不饱和脂肪酸、蛋白质等复杂成分,且待测物含量低,分析常需要复杂的前处理方法净化,操作较繁琐耗时。QuEChERS 技术是2003 年Anastassiades 等提出的样品前处理技术,包含了样品的提取和净化两个步骤,具有简单、快速、准确、高效等优点[21]。该技术早期在水果、蔬菜等食品基质的多农药残留检测中展现了良好的分析效果[22]。近年来,QuEChERS 技术在一些复杂基质如水产品[23]、蜂蜜[24]、乳制品[25]、土壤[26]等领域均得到应用,涉及的检测目标物包括氟虫腈[27]、喹烯酮[28]、雌激素[29]、真菌毒素[30]等。然而在糖肽类抗生素的检测中,QuEChERS 技术目前鲜有报道。基于此,本研究建立了QuEChERS 技术结合HPLC-MS/MS 测定鱼肉中6种替考拉宁组分的分析方法,进行了方法学评价并应用于实际样品的检测。该方法灵敏度高、精密度好、简单高效,可用于鱼肉中替考拉宁残留的定量分析。
1 实验部分
1.1 仪器与试剂
1290 高效液相色谱和6470 三重四极杆质谱(美国Agilent 科技公司);FP3010 料理机(德国Braun 公司);电子天平(瑞士Mettler Toledo 公司);Genie 15 超纯水系统(中国Rephile 公司);TDL-5-A 离心机(上海安亭公司);IKA MS3 basic 旋涡振荡仪(德国IKA 公司);KQ5200E 超声清洗仪(昆山市超声仪器公司);N-EVAP112氮吹仪(美国Organomation公司)。
替考拉宁标准品(纯度为98%,含有TA3-1,TA2-1,TA2-2,TA2-3,TA2-4,TA2-5,上海ZZBIO公司);硫酸多粘菌素B(纯度为91%,Dr.Ehrenstorfer公司);甲醇、乙腈(色谱纯,Merck公司);甲酸(色谱纯,东京化成工业株式会社);乙酸铵(分析纯,阿拉丁公司);氨水(25%)、三氯乙酸、无水硫酸镁、无水硫酸钠(分析纯,麦克林公司);氯化钠(分析纯,广州化学试剂厂);乙二胺-N-丙基硅烷(PSA,50 μm)、十八烷基键合硅胶(C18,50 μm)购自天津Agela 公司;石墨化炭黑(GCB)购自CNW 公司;陶瓷均质子15 mL tubes 购自美国Agilent 科技公司;0.22 μm PTFE 微孔滤膜购自天津Agela 公司;实验用水为超纯水。
1.2 标准溶液的配制
分别准确称取替考拉宁标准品和硫酸多粘菌素B(内标),用0.1%甲酸水分别溶解定容至10 mL,制得1 mg/mL 标准储备液,于-18 ℃避光保存。用甲醇-0.1%甲酸(1∶1,体积比)分别稀释标准贮备液制得10 μg/mL 标准工作液,于4 ℃避光保存。用甲醇-0.1%甲酸(1∶1)将替考拉宁稀释成质量浓度分别为1、2、5、10、20、50、100 ng/mL的标准工作曲线校准溶液(均含有内标30 ng/mL)。
1.3 样品前处理
提取:准确称取1.00 g已绞碎混匀的鱼肉样品于15 mL聚丙烯离心管中,加入30 μL 1 μg/mL 的硫酸多粘菌素B 溶液作为内标,涡旋10 s 后常温下放置30 min。加入2.5 mL 乙腈-10%三氯乙酸溶液(6∶4)和陶瓷均质子,涡旋混匀1 min,超声10 min,5 000 r/min 离心5 min,上清液转移至15 mL 聚丙烯离心管;残渣重复提取1次,合并上清液。
净化:向上清液中加入100 mg PSA,涡旋30 s,5 000 r/min 离心5 min。上清液转移至10 mL 玻璃离心管中,40 ℃氮吹至近干,用1 mL 0.1% 甲酸乙腈-水(4∶6)定容,过0.22 μm 微孔滤膜,待HPLC-MS/MS检测。
1.4 色谱-质谱条件
色谱柱:Agilent SB C18色谱柱(2.1 mm × 100 mm,1.8 μm),柱温:35 ℃,流速:0.30 mL/min,进样量:10 μL。流动相:A 为0.1%甲酸乙腈,B 为0.1%甲酸。梯度洗脱:0~0.5 min,5%B;0.5~1.0 min,5%~30%B;1.0~2.0 min,30%~40%B;2.0~3.0 min,40%~95%B;3.0~3.1 min,95%~5%B;3.1~4.0 min,5%B。
离子源:电喷雾离子源,扫描方式:正离子模式,监测模式:多反应监测模式,干燥气温度:300 ℃,干燥气流速:5 L/min,雾化气压力:0.24 MPa,鞘气温度:325 ℃,鞘气流速:9 L/min,毛细管正向电压:3 500 V,喷嘴正向电压:500 V。6种替考拉宁组分和内标物的质谱参数见表1。

表1 多反应监测模式下6种替考拉宁的质谱参数Table 1 MS parameters of six teicoplanins in the multi-reaction monitoring mode
1.5 基质效应
基质效应(ME)通常由与分析物共萃取的基质组分引起,可以抑制或增强分析物在ESI条件下的电离响应,导致定量结果不准确。通过在流动相溶剂中配制的标准曲线的斜率与基质标准曲线的斜率进行比较,可计算出基质效应[31],其计算公式为:ME(%)=(Bs-As)/As×100%,式中Bs表示基质匹配标准曲线的斜率,As表示溶剂标准曲线的斜率。
2 结果与讨论
2.1 质谱条件的优化
将1 mg/L替考拉宁标准工作液以0.01 mL/min流速注入电喷雾离子源中,对6种替考拉宁组分的质谱参数进行优化。在正离子模式下,替考拉宁的6个组分均易带多个电荷,如[M+H]+、[M+2H]2+和[M+3H]3+。对其灵敏度进行比较,发现替考拉宁各组分的[M+2H]2+离子具有较好的丰度值。利用选择的母离子进一步碰撞产生子离子,每个分析物通过一个母离子和两个子离子进行监测。通过优化碎片电压、碰撞能等参数确定最佳定性、定量离子。通过优化鞘气温度、鞘气流速等离子源参数确定最佳离子源条件。结果显示,替考拉宁中的TA2-2 和TA2-3、TA2-4 和TA2-5 为两对同分异构体,在定性时无法进一步分离,只能进行总量测定。硫酸多粘菌素B 与替考拉宁具有相似的化学结构,均为极性较强的化学物质,在LC-MS/MS中可以较好地分离,不对待测组分的检测造成干扰。此外,由于水产行业内不使用硫酸多粘菌素B,因此本研究选取硫酸多粘菌素B作为内标物。
2.2 色谱条件的优化
对比了流动相分别为甲醇和乙腈的分离效果,结果发现乙腈对6种替考拉宁组分的分离效果更好。通过向流动相中加入0.1%甲酸、0.2%甲酸以及0.01 mol/L乙酸铵观察峰形及灵敏度变化,结果显示替考拉宁各组分在0.1%甲酸流动相中具有最佳的响应值且峰形尖锐对称。因此,实验采用0.1%甲酸乙腈-0.1%甲酸作为流动相进行梯度洗脱。在此条件下,6 种替考拉宁组分得到良好的分离和较高的灵敏度,分析物的色谱图如图1所示。
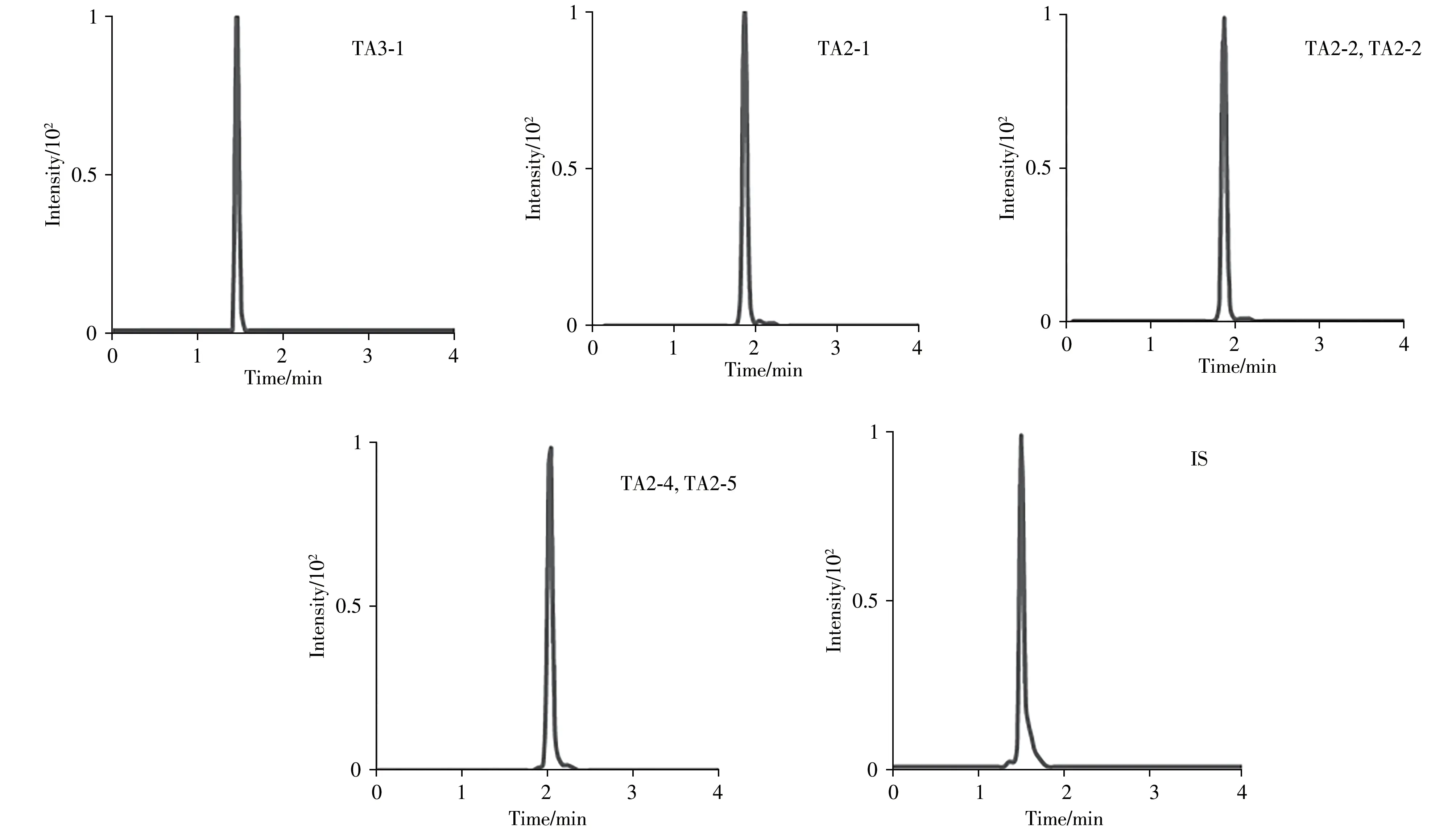
图1 6种替考拉宁组分及内标物(10 ng/mL)的色谱图Fig.1 Typical chromatograms of six teicoplanin components and the internal standard substance at 10 ng/mL
2.3 提取条件的优化
替考拉宁是一种极性较强的多肽类物质[2],根据相似相溶原则,实验对比了甲醇、乙腈和水等溶剂对替考拉宁的提取效果。发现采用甲醇和乙腈进行提取时,提取效率较低;采用水进行提取时,提取液中杂质较多,目标物受基质影响导致灵敏度降低。基于乙腈和三氯乙酸沉淀蛋白的优势,本研究考察了不同浓度乙腈-三氯乙酸水溶液的提取与净化效果。结果显示,随着乙腈体积分数的升高,目标物的回收率上升,当乙腈体积分数为20%~60%时,目标物的回收率在75%左右,为达到好的净化效果,实验选择60%乙腈水溶液进行提取(图2A)。进一步调节三氯乙酸体积分数发现,在三氯乙酸为0%~10%时,目标物的回收率不断上升至接近90%,三氯乙酸为10%~40%时,目标物的回收率趋于稳定并有下降趋势。依据经济环保原则,实验选择10%的三氯乙酸(图2B),即选择乙腈~10%三氯乙酸(6∶4,体积比)作为最佳提取溶剂。进一步考察了不同体积(2、4、5、6、8、10 mL)提取溶剂的影响,结果发现5 mL提取溶剂可实现良好的提取效果(图2C)。

图2 不同提取条件对6种替考拉宁组分回收率的影响Fig.2 Effects of different extraction conditions on recoveries of six teicoplanin components
在QuEChERS 方法中,常采用无机盐使有机相与水相分层,促进目标物从水相转移到有机相中。实验比较了不加入无机盐,加入2.0 g 无水硫酸钠及加入2.0 g 无水硫酸镁时对目标物回收率的影响。发现盐的加入降低了目标物的回收率(图2D)。因此,实验选择不加无水硫酸钠等盐。
2.4 净化条件的优化
在净化过程中,吸附剂通过吸附作用减少基质干扰物的含量,从而提高目标物的回收率。实验采用100 μg/kg的空白基质加标样品作为对照,比较了不同吸附剂(PSA、C18和GCB)对目标物回收率的影响(图3A)。发现使用PSA后,替考拉宁各组分的回收率约为90%;使用C18后,替考拉宁各组分的回收率低于80%;而使用GCB 后,各组分的回收率均低于60%,原因可能是其吸附含有苯环平面的物质[32]。因此,实验选择PSA作为最佳净化剂。
为获得良好的净化效果,进一步对不同PSA 用量(25、50、75、100、150 mg)进行优化,结果如图3B 所示。当PSA 用量增加时,替考拉宁各组分的回收率不断上升,在100 mg时,6种替考拉宁均获得最佳回收率,当PSA达到150 mg时,目标物的回收率明显下降。因此,实验选择100 mg PSA 用于样品净化。
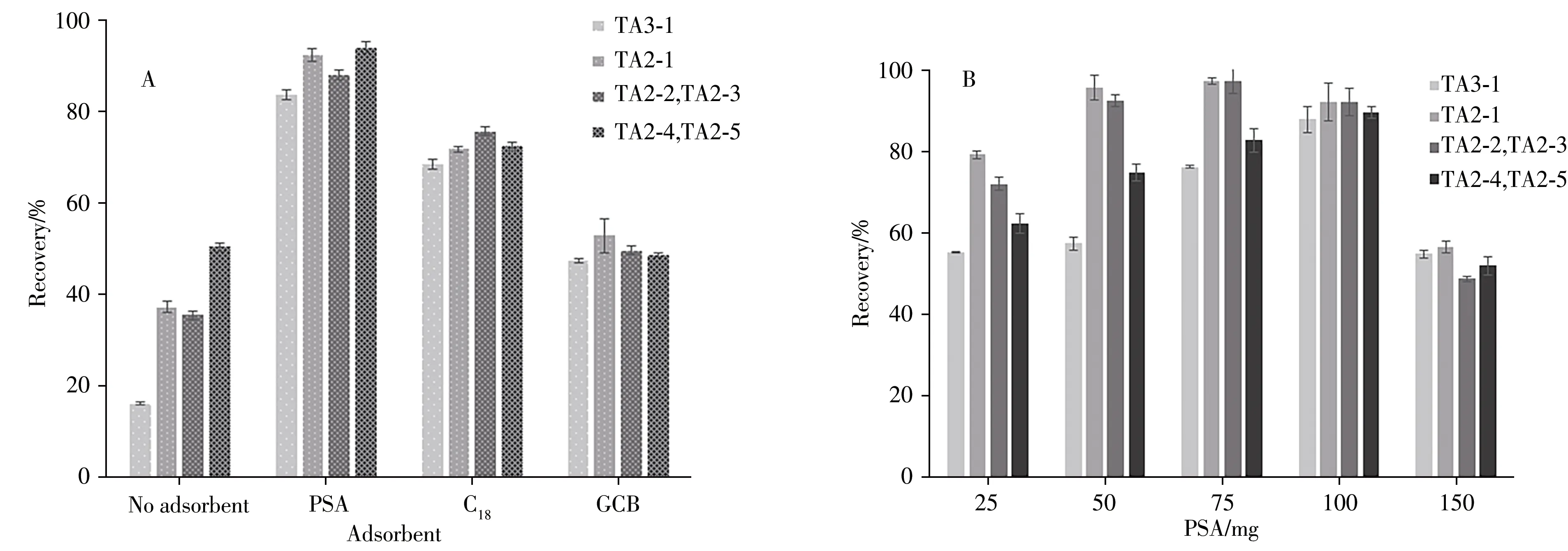
图3 吸附剂种类(A)及用量(B)对6种替考拉宁组分回收率的影响Fig.3 Effects of adsorbent type(A)and dosage(B)on recoveries of six teicoplanin components
2.5 基质效应
由于鱼肉样品富含脂肪、蛋白质等基质,在进行LC-MS/MS 样品分析时易引起基质效应。采用5 种空白基质(罗非鱼、鲫鱼、鲤鱼、大黄鱼和鳜鱼)配制相应的基质标准曲线,与流动相配制的溶剂标准曲线进行比较,评价了6种替考拉宁组分在不同种类鱼中的基质效应(ME)。当ME 为正值时表示信号增强,为负值时表示信号抑制,|ME|范围在0~20%、20%~50%和>50%时分别呈现弱、中、强基质效应[33]。采用本方法进行检测,不同鱼肉基质中替考拉宁组分的基质效应如图4 所示,5 种鱼肉中替考拉宁均表现出基质抑制作用,|ME|在1.16%~19.82%之间,表明基质效应较弱。
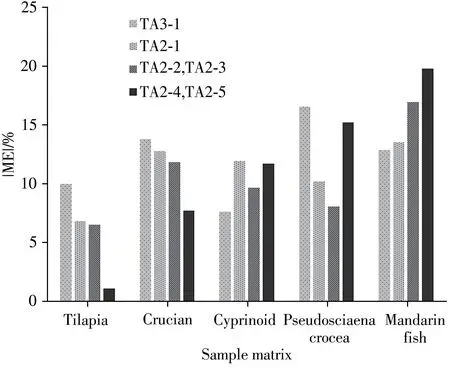
图4 替考拉宁组分在5种鱼类中的基质效应Fig.4 Matrix effects of six teicoplanin components in five fishs
2.6 线性范围、检出限与定量下限
采用“1.2”配制的质量浓度分别为1、2、5、10、20、50、100 ng/mL的替考拉宁系列标准工作溶液,加入内标物(质量浓度为30 ng/mL),绘制标准曲线并做线性回归分析,结果如表2所示。6种替考拉宁的相关系数(r2)均大于0.998,线性范围为1~100 ng/mL 或2~100 ng/mL。在空白样品中添加目标物,以信噪比为3和10分别计算检出限(LOD)和定量下限(LOQ),测得其LOD为0.5~2.0 μg/kg,LOQ为2.0~5.0 μg/kg。
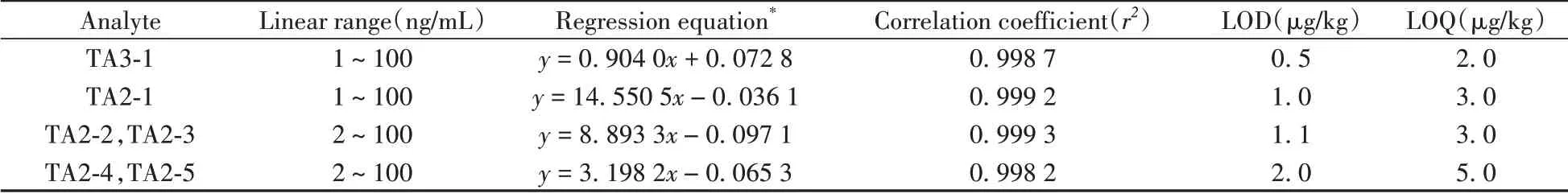
表2 替考拉宁组分的线性关系、检出限及定量下限Table 2 Linear relations,limits of detection(LODs)and limits of quantitation(LOQs)of six teicoplanins
2.7 回收率与相对标准偏差
采用罗非鱼、鲫鱼、鲤鱼、大黄鱼和鳜鱼等5 种阴性样品作为空白基质进行加标回收实验。分别在5.0、10.0、25.0 μg/kg 3 个浓度水平添加6 种替考拉宁,计算加标回收率和相对标准偏差(n=6),结果见表3、表4。所有分析物的加标回收率为84.3%~93.3%,日内及日间相对标准偏差分别不大于7.0%、6.2%,结果表明该方法准确度高、精密度好,能够满足多种鱼肉的日常检测需求。
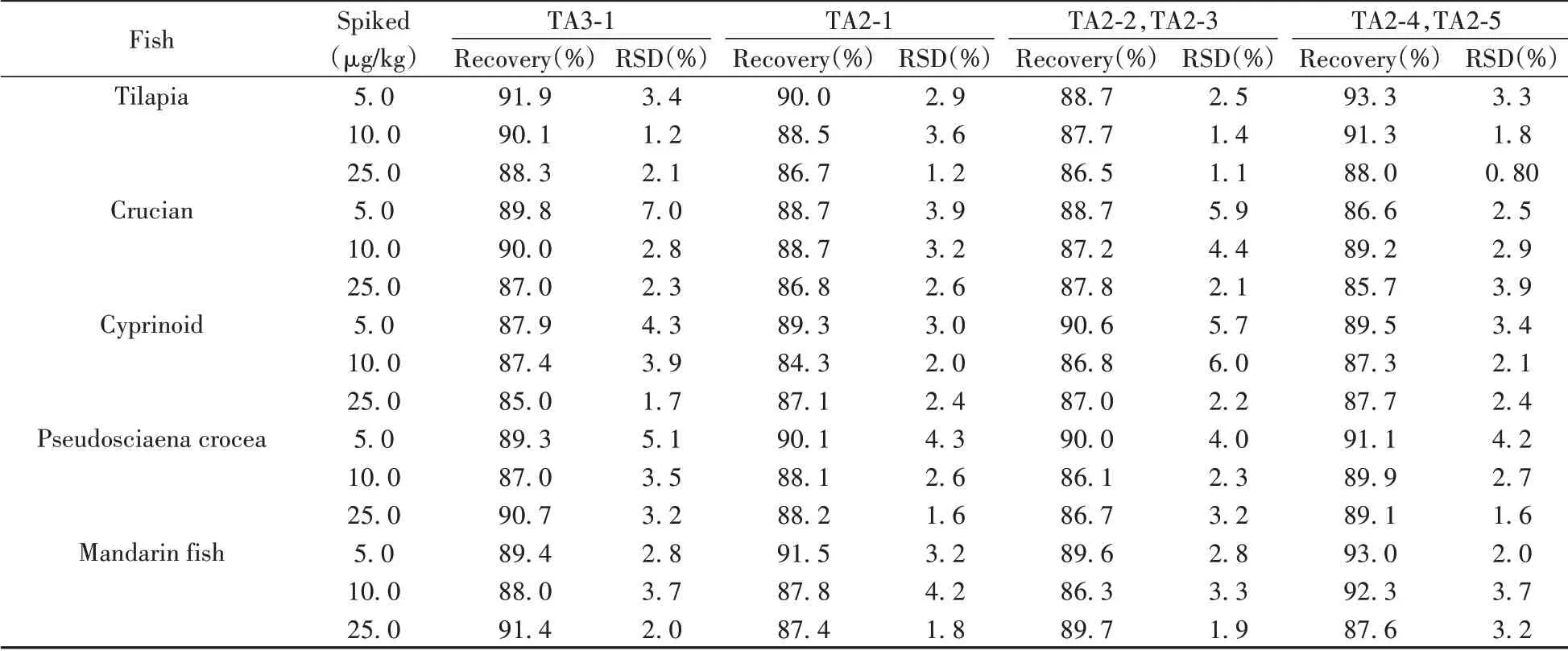
表3 6种替考拉宁在鱼肉样品中的回收率及日内相对标准偏差(n=6)Table 3 Average recoveries and RSDs of intra-day of six teicoplanin in spiked fish(n=6)
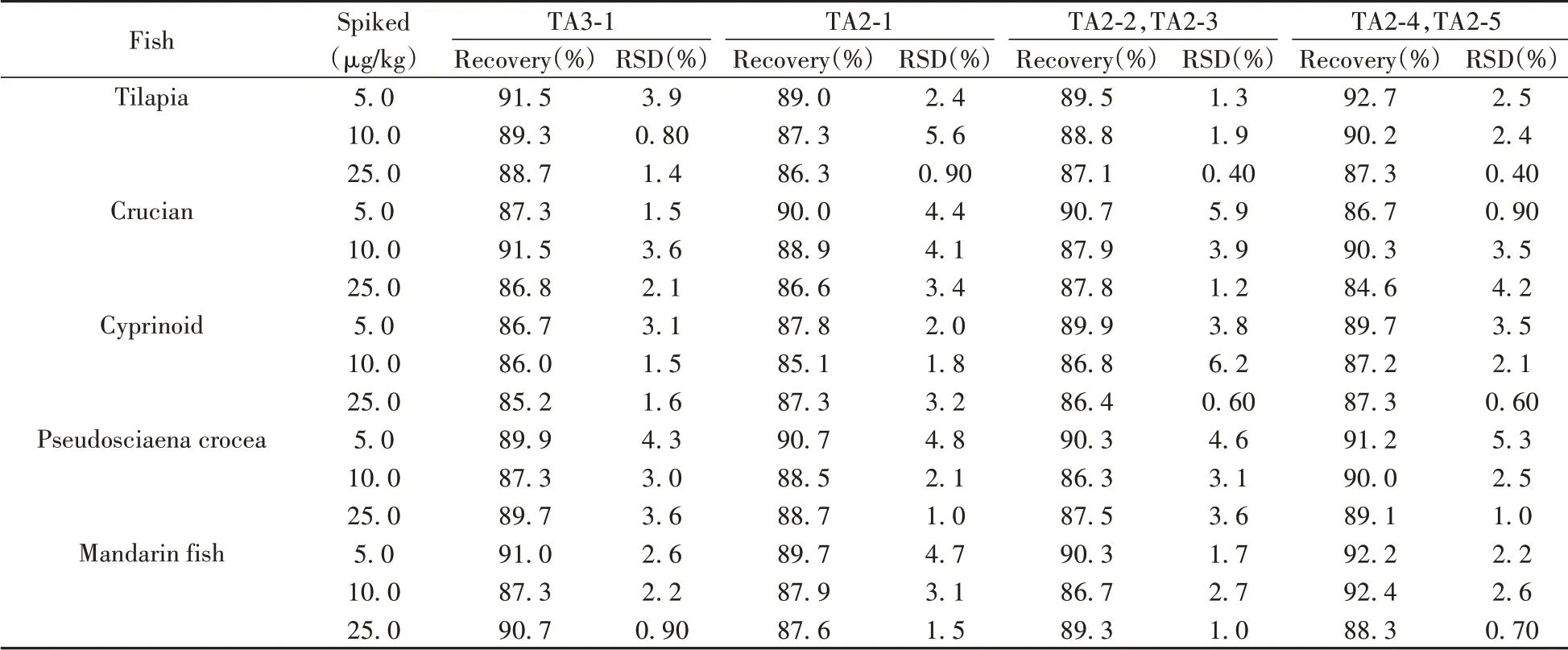
表4 6种替考拉宁在鱼肉样品中的回收率及日间相对标准偏差(n=6)Table 4 Average recoveries and RSDs of inter-day of six teicoplanins in spiked fish(n=6)
2.8 实际样品的测定
从市场购得40份鱼肉样品,包括鲫鱼、鲤鱼、草鱼、鲢鱼、鳙鱼、鳜鱼、罗非鱼、大黄鱼和大菱鲆等9 个品种。采用建立的方法进行实际样品测定,发现40 份鱼肉样品中均未检出替考拉宁成分。选取其中3种空白鱼肉样品,按5.0 μg/kg 浓度水平添加替考拉宁混合标准溶液,按照本方法进行提取和测定,得到加标回收率为86.7%~91.2%,符合质控要求,表明该方法可用于实际样品的分析。
3 结 论
本研究采用QuEChERS 结合高效液相色谱-串联质谱建立了同时测定鱼肉样品中多种替考拉宁组分的检测方法。实验优化了质谱条件、色谱条件及QuEChERS 前处理步骤,考察了多种鱼肉样品中的基质效应并进行了方法学评价。所有分析物在各自浓度范围内线性关系良好,检出限为0.5~2.0 μg/kg,定量下限为2.0~5.0 μg/kg。目标物在多种鱼肉样品中的回收率为84.3%~93.3%,日内及日间相对标准偏差均不大于7.0%,基质效应弱。结果表明该方法简单、高效、准确性好、灵敏度高,可用于实际鱼肉样品6种替考拉宁组分的准确定量分析。

