氧化应激对猪前体脂肪细胞分化及PPARγ选择性剪接的影响
魏 芳,李帅兵,宋苏堤,苗 健,张国华,卢建雄
(西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
脂肪细胞分化是脂肪形成的基础,影响动物胴体品质和肉质性状。揭示脂肪细胞分化机制,对于提高畜禽生产效益和改善肉品质具有重要意义。机体内、外环境多种因素影响脂肪细胞分化,其中氧化还原平衡是维持细胞各种生物学功能的基础。体外环境变化及体内物质代谢产生的超氧阴离子(O2-)、过氧化氢(H2O2)和一氧化氮(NO)等各种活性氧(ROS)均可造成机体及组织细胞氧化应激,影响细胞发育、分化、凋亡及代谢。脂肪细胞摄取能量物质后产生活性氧,改变细胞氧化还原电位,促进脂肪生成[1]。脂肪细胞的氧化应激会影响脂肪细胞增殖分化、脂肪合成及分解、细胞因子的分泌以及胰岛素敏感性等,进而对脂肪沉积产生影响[2]。
过氧化物酶体增殖物激活受体γ(PPARγ)作为配体激活的转录因子,在脂肪细胞分化中起着枢纽作用[3]。PPARγ激活后启动脂肪细胞分化及脂肪生成基因表达,导致甘油三酯合成与持续积累,调控脂肪细胞从发育到代谢的各个生物学过程[4],包括脂肪细胞分化、胰岛素敏感性、脂肪生成和细胞生存[5]。PPARγ编码基因富含外显子和内含子顺式调控元件,因而可以产生严格的选择性剪接调控[6]。研究表明,PPARγ外显子6中有丝氨酸/精氨酸富集剪接因子1(serine/arginine-rich splicing factor 1,SRSF1)的结合位点[7],SRSF1与PPARγ外显子6结合可能有助于跳过外显子5产生PPARγ选择性剪接亚型PPARγΔ5[8]。PPARγ外显子5跳跃是一种自然发生的选择性剪接事件,在人类皮下和内脏脂肪组织、脂肪细胞、APCs和HEK239等细胞均检测到PPARγΔ5[9-10]。RNA免疫沉淀实验也证实,剪接因子SRSF1与PPARγ的前体及成熟mRNA结合促进外显子5跳跃。PPARγ外显子5跳跃导致蛋白质编码框移位,产生缺失配体结合域的PPARγ亚型PPARγΔ5。PPARγΔ5对野生型PPARγ活性具有显性负性影响[8],可能通过影响PPARγ的作用调控脂肪细胞的分化。因此,本文就氧化应激对猪前体脂肪细胞分化及PPARγ选择性剪接的影响做了初步研究,为深入了解猪脂肪形成的调控机制提供参考。
1 材料与方法
1.1 材料
3~6日龄杜×长×大杂交仔猪由兰州瑞源农业科技有限公司提供;DMEM/F12 1:1培养基(HyClone公司);胎牛血清FBS(浙江天杭生物科技股份有限公司);注射用青霉素钠和硫酸链霉素、0.25% EDTA胰酶、油红O和DMSO、I型胶原酶(Solarbio公司);牛血清白蛋白(Gibco公司);地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、胰岛素(INS)、葡萄糖(Sigma公司);细胞总RNA抽提试剂盒、反转录试剂盒和荧光定量PCR试剂盒(TaKaRa公司,大连);无水乙醇(天津市富宇精细化工有限公司)、DEPC水(大连美仑生物技术有限公司)。
1.2 方法
1.2.1原代猪前体脂肪细胞培养 将仔猪麻醉处死、体表消毒后,在无菌状态下分离皮下脂肪组织,PBS清洗后剪碎,用0.1% Ⅰ型胶原酶消化液于37 ℃水浴锅中消化1 h左右,终止消化并过滤,滤液离心10 min,弃上清,加入培养液吹打均匀,然后用含FBS 10%的DMEM/F12培养液重悬,接种于6孔板中,于37 ℃、5 %CO2培养箱中培养,隔天换液[11-12]。细胞生长至80%汇合后,用5 g/L胰蛋白酶37 ℃消化,接种至12孔细胞培养板。
1.2.2过氧化氢处理12孔板培养的前体脂肪细胞生长至80%汇合后,用含0.5 mm IBMX、1 μm DEX和5μg/ml胰岛素的DMEM/F12诱导分化培养液培养72 h,然后用DMEM/F12维持培养液培养,隔天换液。分别在诱导分化后2 d、4 d和6 d,用H2O2终浓度为500 μmol/L的培养液培养24 h构建氧化应激细胞模型,检测细胞分化及提取总RNA。
1.2.3油红O染色提取法检测细胞分化12孔板培养的细胞H2O2处理24 h后,按于淇等[13]报道的油红O染色提取法检测细胞分化,并在显微镜下观察、拍照。
1.2.4基因mRNA表达检测 吸出培养液,PBS清洗细胞后,提取细胞R N A。提取的R N A用超微量紫外分光光度计(Nanodrop One)检测R N A纯度和浓度,按照逆转录试剂盒说明书,反转录合成c D N A。反转录反应体系(10 μl):5×Primer 2 μl,1~3 μl RNA,ddH2O补至10 μl。反应程序:37 ℃、15 min,84 ℃、5 s,4 ℃、30 min。cDNA于-20 ℃冰箱保存。按TaKaRa公司GreenTM Premix Ex TaqTM II(Tli RNaseH Plus)试剂盒使用说明书,用实时荧光定量PCR仪(CFX96,BIO-RAD公司,美国)检测相关基因的表达量,所用引物(由湖南艾科瑞生物工程有限公司合成)见表1,反应体系:cDNA 1 μl,上、下游引物(5 μmol/L)各0.4 μl,SYBR®Premix Ex TaqTMⅡ (2×) 5 μl,ddH2O 3.2 μl,共10 μl。参考岳小婧等[12-14]反应程序进行PCR反应。采用2-ΔΔCt法计算基因mRNA相对表达量。

表1 PCR引物
1.2.5统计分析 试验数据采用SPSS 25.0软件统计处理,用One-Way ANOVA进行单因素方差分析,用最小显著极差法(LSD)进行多重比较。结果用平均值±标准差表示。
2 结果
2.1 氧化应激抑制猪脂肪细胞分化
猪前体脂肪细胞成脂诱导后,用H2O 2处理24 h造成细胞氧化应激,油红O染色提取法检测诱导后3 d、5 d和7 d细胞的分化。从图1可以看出,与对照组相比,H2O2处理显著降低成脂诱导第5 d和第7 d前体脂肪细胞的分化(P<0.05),成脂诱导第3 d细胞的分化仅有降低趋势(P>0.05)。图2显示成脂诱导后7 d脂肪细胞油红O染色结果。H2O2处理后,油红O染色细胞数减少,脂滴较小。可见,H2O2处理诱导的氧化应激可抑制猪前体脂肪细胞分化。
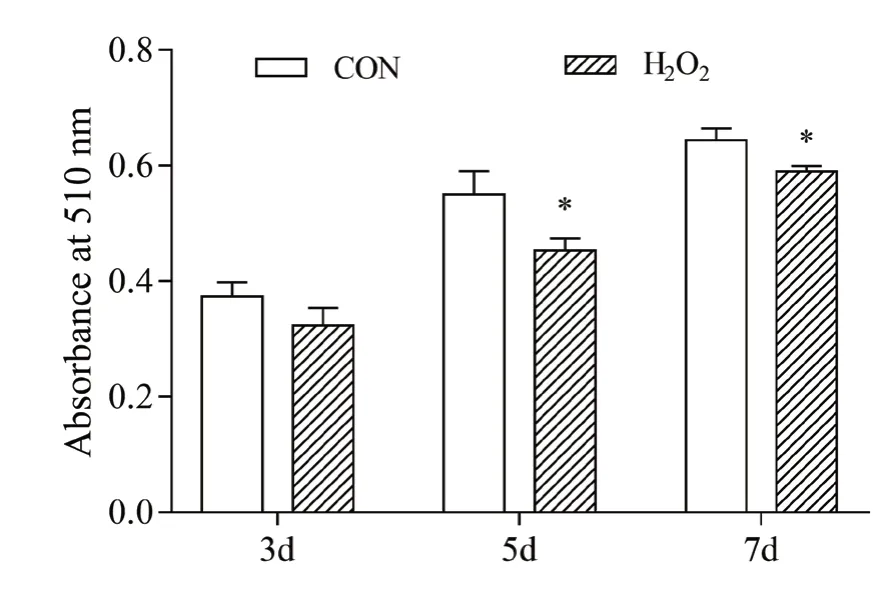
图1 H2O2处理对猪前体脂肪细胞分化的影响
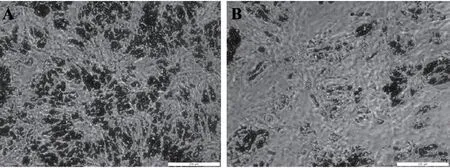
图2 成脂诱导后7d猪前体脂肪细胞油红O染色结果
2.2 H2O2处理对猪脂肪细胞成脂分化基因表达的影响
成脂诱导6 d的脂肪细胞用H2O2处理24 h后,提取RNA,检测分化相关基因mRNA表达的变化,结果如图3所示。与对照组相比,H2O2处理极显著降低细胞FABP4、C/EBPα、SCD和PPARγ mRNA表达(P<0.01),但Txnip和LPL表达极显著提高(P<0.01),表明氧化应激通过影响细胞成脂分化相关基因表达抑制猪前体脂肪细胞分化。
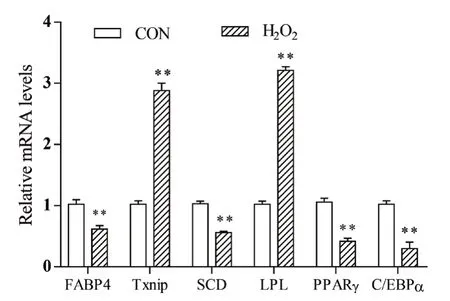
图3 H2O2处理对猪脂肪细胞基因表达的影响
2.3 氧化应激抑制脂肪细胞PPARγ选择性剪接
如图4所示,H2O2处理24 h,脂肪细胞选择剪接异构体PPARγΔ5和剪接因子SRSF1 mRNA表达均极显著降低(P<0.01)。可见,氧化应激可以抑制PPARγ的选择性剪接。
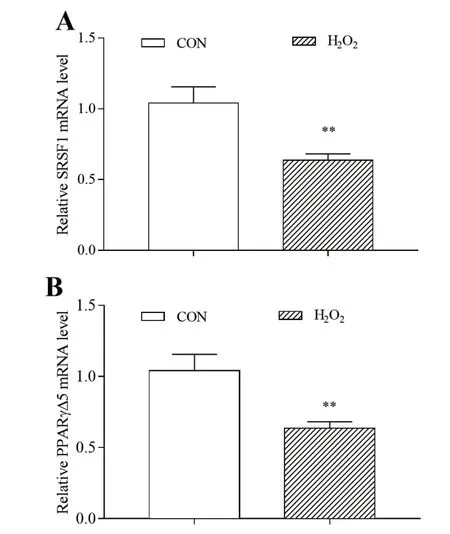
图4 氧化应激对猪脂肪细胞SRSF1、PPARγΔ5 mRNA表达的影响
3 讨论
氧化应激(Oxidative Stress)是指生物体内氧化与抗氧化作用失衡的一种状态。许多因素如动物生理阶段改变、环境变化和外源致病菌及毒素等都会破坏机体氧化还原平衡,引发氧化应激。营养物质在体内代谢过程中也可以产生大量超氧阴离子、过氧化氢和一氧化氮等活性氧。体内积累的过多活性氧破坏组织器官黏膜屏障,导致机体功能和代谢损伤,引起疾病发生[15]。机体超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶及非酶抗氧化系统与氧自由基相互作用,维持机体适度的氧化还原平衡。研究表明,氧化还原平衡影响脂肪细胞分化及脂质代谢。细胞内氧化还原电位在脂肪细胞分化过程中经历了显著变化[16],细胞外氧化还原环境通过影响细胞内活性氧的产生影响细胞过程[17]。然而,氧化应激对脂肪细胞分化的影响还存在争议。过氧化氢诱导的氧化应激促进3T3-L1细胞PPARγ表达及成脂分化[18],增强机体脂肪积累[19-20]。在小鼠OP9前体脂肪细胞分化过程中,随着细胞内活性氧的积累,脂滴增加[21]。然而,Pessler等[22]报道,氧化应激通过降低C/EBP的DNA结合活性抑制3T3-L1前体脂肪细胞分化。同样,Nitta等[23]也发现,H2O2处理诱导的氧化应激可下调3T3-L1细胞PPARγ表达,降低C/EBP DNA结合活性,抑制细胞分化。与此一致,本研究用H2O2处理原代培养猪前体脂肪细胞时,细胞分化显著减弱,成脂分化关键转录因子C/EBPα和PPARγ及其下游生脂基因FABP4和SCD表达降低,而脂解基因LPL表达提高。研究证明,氧化还原环境通过影响细胞内活性氧的产生影响细胞过程[17],C/EBPα和PPARγ是介导活性氧影响脂肪生成的主要因子[24]。由此可见,H2O2诱导的氧化应激通过下调C/EBPα和PPARγ表达抑制猪前体脂肪细胞分化。
作为一种氧化还原调节蛋白,硫氧还蛋白互作蛋白(Txnip)参与许多细胞生理过程[25],可通过抑制硫氧还蛋白(thioredoxin,Trx)的还原活性调节细胞的氧化还原状态[26]。Txnip是PPARγ的负调控因子,过表达Txnip可抑制猪前体脂肪细胞分化、下调PPARγ表达[13];相反,Txnip表达沉默上调PPARγ表达、促进分化[12]。本研究用过氧化氢处理猪前体脂肪细胞,Txnip表达显著提高。与此一致,H2O2处理引起细胞氧化应激、生长停滞,Txnip表达提高[27-28]。这些结果也支持了氧化应激抑制猪前体脂肪细胞分化的观点。
前体mRNA(pre-mRNA)选择性剪接是真核生物基因表达的重要调控方式,95%以上的人类基因存在选择性剪接[29]。通过选择性剪接可形成结构与功能多样的蛋白质,精密调控组织类型和细胞发育。PPARγ蛋白含有不依赖配体激活的N-端结构域、DNA结合域(DNA binding domain,DBD)和依赖配体激活的C端-配体结合域(ligand binding domain,LBD)。经天然或合成的配体激活后,PPARγ与其分子伴侣RXR形成异二聚体,转运到细胞核,与反应元件PPREs序列结合,以配体应答方式依赖LBD反式激活靶基因表达[8,30]。剪接因子SRSF1是一种非典型的SR蛋白,作为序列依赖性剪接激活因子发挥作用,是脂肪细胞分化必需的调节因子[31]。PPARγ第6外显子上有SRSF1的结合位点,SRSF1与之结合促进外显子5跳跃,产生缺失配体结合域的PPARγ亚型PPARγΔ5[8]。用PPARγ和PPARγΔ5过表达质粒共转染细胞后,配体诱导的PPARγ反式激活活性降低约50%,说明PPARγΔ5对野生型PPARγ的活性具有抑制作用,是PPARγ的显性负性亚型[8],可能在脂肪细胞分化和脂质代谢调控中发挥作用。用H2O2处理猪前体脂肪细胞后,剪接因子SRSF1与剪接异构体PPARγΔ5的表达水平均显著降低,即PPARγΔ5的表达可能因氧化应激抑制SRSF1表达而降低。因此,PPARγΔ5也可能参与了氧化应激对猪前体脂肪细胞分化的影响,但其功能作用有待进一步研究。
4 结论
氧化应激可通过抑制转录因子C/EBPα和PPARγ表达及促进Txnip表达减弱猪前体脂肪细胞分化,并抑制PPARγ基因选择性剪接。研究结果为进一步探讨猪脂肪形成的调控机制提供了基础。

